修回日期: 2005-10-27
接受日期: 2005-10-31
在线出版日期: 2006-01-08
目的: 探讨脂多糖(LPS)对D-半乳糖胺(D-GalN)致敏大鼠在亚致死剂量下的肝损伤作用.
方法: 48只大鼠随机分为三大组, 即6 h、24 h和48 h取材组, 每组各16只动物; 每个大组再分为两个小组, 即处理组和对照组, 各8只大鼠. 所有处理组大鼠均以LPS(50 µg/kg)+D-GalN(300 mg/kg), 用1 mL无菌生理盐水溶解后腹腔内注射, 对照组大鼠仅腹腔内注射1 mL生理盐水. 在相应时间点, 采血查谷丙转氨酶(ALT)、谷草转氨酶(AST)和胆红素(BIL); 肝组织常规固定, HE染色后光镜检查; 肝组织细胞凋亡的TUNEL分析采用多聚甲醛固定; 肝组织炎性细胞因子TNF-α、IL-1β和细胞凋亡诱导基因bax的表达通过RT-PCR的方法检测.
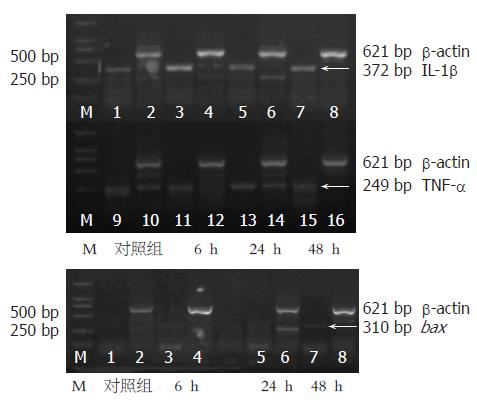
结果: 所有处理组大鼠ALT、AST和TBIL在6 h内即显著升高, 24 h达到峰值, 48 h仍维持于高水平; 肝脏大体形态显示: 肝脏明显肿胀、失去正常红润光泽而略显苍白、表面见散在的点状及片状出血点、质地偏韧; HE染色可见药物处理6 h, 肝组织即呈现充血, 碎片状坏死和大量炎性细胞浸润. 24 h肝细胞开始空泡变性、肿胀, 并见大片坏死及中性粒细胞浸润. 48 h则多数肝细胞空泡状变性, 肝组织小叶结构紊乱, 点状坏死, 炎症细胞浸润较前减少. TUNEL分析显示, 对照组未见凋亡的肝细胞, 6 h处理组仅见少量凋亡细胞, 凋亡指数(AI)为4.3±1.2%, 24 h和48 h处理组肝组织内则见较多的凋亡细胞, AI分别为20.6±3.3%、21.2±5.7%, 但两者P>0.05; 24 h处理组凋亡细胞百分数为15.83%, 对照组凋亡细胞占0.39%, 两组间存在显著差异(P<0.001); 处理组各时间点TNF-α、IL-1β的表达均较对照组显著升高, 其高峰值出现于6 h. 对照组未见bax的表达, 而LPS的应用后6, 24, 48 h的相对表达率为0.193±0.062、0.191±0.043、0.209±0.031.
结论: 亚致死剂量LPS可造成D-GalN致敏大鼠的急性肝损伤; 细胞凋亡是该急性损伤的重要病理形态学改变, 而凋亡的发生可能与LPS诱导bax的表达有关; 本模型是较理想的内毒素性急性肝损伤的实验动物模型.
引文著录: 刘亮明, 邓欢, 张吉翔, 罗杰. 内毒素性急性肝损伤实验动物模型的建立. 世界华人消化杂志 2006; 14(1): 12-18
Revised: October 27, 2005
Accepted: October 31, 2005
Published online: January 8, 2006
AIM: To study the lipopolysaccharide (LPS)-induced liver injury in D-galactosamine (D-GalN) sensiti-zed rats at a sub-lethal dose.
METHODS: Forty eight rats were randomly divided into three groups (16 for each). The rats in each group were further divided into model (n = 8) and control group (n = 8). The rats in the model group received intraperitoneal injections of LPS (50 μg/kg) and D-GalN (300 mg/kg) in 1 mL stroke-physiological saline solution (SPSS), while the rats in the control group were treated with SPSS only. The tissue and blood samples were collected at 6, 24, and 48 h, respectively. The contents of serum alanine aminotransferase (ALT), aspartate transaminase (AST) and total bilirubin (TBIL) were detected. The morphological changes were observed by hematoxylin and eosin (HE) staining. The apoptosis of liver cells was detected by TUNEL assay, and the expression of tumor necrosis factor-α (TNF-α), interleukin-1b (IL-b), and bax gene were detected by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: Blood biochemical indicators, such as ALT, AST, and TBIL, were significantly higher in the model rats than those in the controls at 6 h, which reached the peak at 24 h, and sustained high levels at 48 h. By naked eyes, sporadic, punctiform and lamellar hemorrhagic spots were observed on the surface of swelling and pale liver with tenacious texture in the model rats. Congestion, piecemeal necrosis and infiltration of inflammatory cells appeared at 6 h, and cellular vacuolar degeneration, engorgement, focal necrosis and neutrophil infiltration were observed at 24 h. At 48 h, vacuolar degeneration appeared in a majority of liver cells, and structural disorder of liver lobule and spot necrosis were observed. The apoptotic indexes of the liver cells at 24 and 48 were 20.6 ± 3.3% and 21.2 ± 5.7%, respectively (P > 0.05), whereas the apoptotic index was only 4.3 ± 1.2% at 6 h in the model rats. The percentage of apoptotic cells was 15.83% in the model rats, and 0.39% in controls (P < 0.001) at 24 h. In the model rats, the expression of TNF-α and IL-1βwere significantly up-regulated at all time points and reached the peak at 6 h. There was no expression of bax in the controls, but 6, 24, 48 h after LPS induction, the relative expression rates of bax were 0.193 ± 0.062, 0.191 ± 0.043, and 0.209 ± 0.031, respectively.
CONCLUSION: LPS can induce acute liver injury in D-GalN-sensitized rats at a sub-lethal dose. Apoptosis is the important morphological feature in this process, which may be associated with LPS-induced bax expression.
- Citation: Liu LM, Deng H, Zhang JX, Luo J. Establishment of lipopolysaccharide-induced acute liver injury in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 12-18
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/12.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.12
内毒素(endotoxin)是革兰氏阴性细菌细胞壁外层成分, 其主要化学物质并对人体产生毒性作用的成分是脂多糖(lipopolysaccharide, LPS). 休克、缺血-再灌注胃肠衰竭、创伤和严重烧伤等重症患者, 内毒素血症是很常见的. 肝硬化、急、慢性及重症肝炎等肝病患者, 由于胃肠屏障功能的降低和/或肝脏单核巨噬细胞系统特别是肝枯否细胞的损伤, 往往合并有肠源性内毒素血症. 韩德五[6]在1995年就已经提出了肝功能衰竭的内毒素机制, 认为内毒素血症特别是肠源性内毒素血症是肝功能衰竭发生的物质基础. 目前虽然累积了大量LPS致肝损伤的证据, 但临床上尚缺乏特殊的有效治疗手段. 一个重要的理由可能在于LPS肝损伤动物模型建立有困难, 因为啮齿类动物大多对LPS存在抵抗[24]. 既往采用大剂量LPS体内注射的方法, 因可造成包括肝脏在内的多脏器功能衰竭, 使肝损伤病理生理进程的深入研究存在一定困难, 而小剂量外源LPS的应用又往往难以达到理想的观察数据. 有研究[3]证实, D-半乳糖胺(D-galactosamine, D-GalN)的应用能大大增加实验鼠对LPS的敏感性, 使LPS的动物致死效应增加2 500倍以上. 我们在该研究的基础上, 采用小剂量LPS/D-GalN处理动物建立实验模型.
1.1.1 实验动物: 健康♂Wistar大鼠, 体质量200±10 g, 由南昌大学医学院动物科学部提供.
1.1.2 动物饲养: 依据文献[21,25], 实验前1 wk领取动物, 分笼饲养, 给予自由进食和饮水. 室温维持25 ℃, 并每隔12 h开灯照明.
1.1.3 试剂: LPS和D-GalN购自美国Sigma公司; DeadEndTM Colorimetric TUNEL System购自美国Promega公司.
1.2.1 动物处理方法: 48只大鼠随机分为三大组, 即6 h、24 h和48 h取材组, 每组各16只; 每个大组再分为两个小组, 即处理组和对照组, 各8只. 所有处理组大鼠均以LPS(50 μg/kg)+D-GalN(300 mg/kg), 用1 mL无菌生理盐水溶解后腹腔内注射, 对照组大鼠仅腹腔内注射1 mL生理盐水. 在相应时间点, 即6, 24和48 h采用麻醉处死动物, 从门静脉或下腔静脉采血查ALT、AST、BIL等; 迅速切取肝脏置预冷的PBS液中, 剪成小块(约50-100 mg)置液氮以备RT-PCR检测; 固定备送光镜和TUNEL分析; 制备肝细胞悬液送流式细胞检测.
1.2.2 TUNEL分析: 参照文献[26], 肝组织用40 g/L多聚甲醛固定后, 进行石蜡包埋、切片, 切片常规脱蜡、水化, 再用TUNEL检测试剂盒按说明书步骤进行. 最后常规DAB显色, 苏木素复染, 中性树胶封固. 计算凋亡指数并判定肝细胞凋亡程度: 细胞核呈棕褐色染色为阳性, 未染成棕褐色者为阴性.
1.2.3 RT-PCR: 参照文献[27], 肝组织(50-100 mg)总RNA提取用TRIzol试剂(Invitrogen, USA)按操作说明进行. 2 mg总RNA作为模板用于第一链cDNA的合成, 采用M-MLV RT kit(Promaga, USA)试剂盒进行. PCR引物设计利用Primer Premier5.0软件(PremierBiosoft, CA)设计完成. 引物序列及产物长度见表1. 反应条件为: TNF-α、IL-1β和b-actin: 95 ℃预变性5 min; 95 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸1 min, 共38个循环; 最后总延伸72 ℃ 6 min. bax和b-actin: 95 ℃ 5 min; 95 ℃ 45 s, 57 ℃ 45 s, 72 ℃ 1 min, 共38个循环; 最后72 ℃ 6 min.
| 基因 | 引物序列 | 产物长度 (bp) |
| TNF-α | 正义: 5'-CTGGGCAGCGTTTATTCT-3' | |
| 反义: 5'-TTGCTTCTTCCCTGTTCC-3' | 249 | |
| IL-1β | 正义: 5'-CCTTCTTTTCCTTCATCTTTG-3' | |
| 反义: 5'-ACCGCTTTTCCATCTTCTTCT-3' | 372 | |
| bax | 正义: 5'-GACACCTGAGCTGACCTTGG-3' | |
| 反义: 5'-GAGGAAGTCCAGTGTCCAGC-3' | 310 | |
| β-actin | 正义: 5'-ACACTGTGCCCATCTACGAGG-3' | |
| 反义: 5'-AGGGGCCGGACTCGTCATACT-3' | 621 |
1.2.4 流式细胞术: 制备细胞悬液, 按FITC-Annexin V Apoptosis Detection Kit操作, 对细胞进行Annexin V/PI双染, 通过双变量流式细胞仪检测细胞凋亡率.
统计学处理 实验数据以mean±SD表示, 组间比较用方差分析.
所有处理组动物血ALT、AST和TBIL在6 h内即呈现显著的升高, 24 h达到峰值, 48 h仍维持于高水平. 但在48 h, ALT的水平较24 h已有显著的降低(P<0.01)(表2).
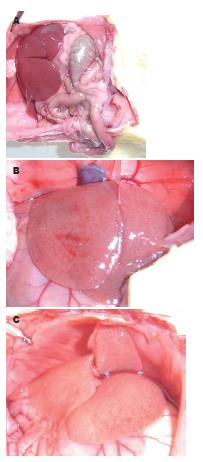
肉眼观察, 对照组肝脏形态正常, 被膜光整、色泽红润、质地柔软; 24 h和48 h处理组之肝脏则明显肿胀、失去正常红润光泽而略显苍白、表面见散在的点状及片状出血点、质地偏韧. 48 h处理组片状出血更少见, 而更显苍白(图1).
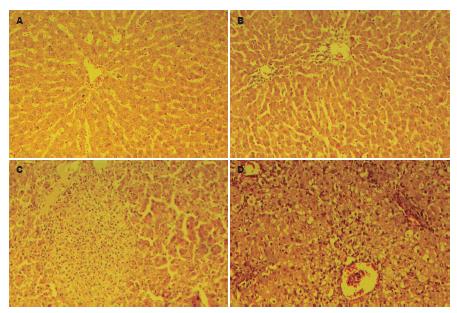
对照组肝组织, HE染色显示肝小叶结构完整, 无肝细胞变性坏死现象; 6 h处理组肝组织, 见少量充血, 碎片状坏死, 大量炎性细胞浸润; 24 h处理组切片, 肝组织结构尚存, 肝细胞肿胀, 部分细胞空泡变性, 并见大片灶状坏死, 其中可见多量中性粒细胞浸润; 48 h处理组切片, 肝组织小叶结构紊乱, 大部分肝细胞空泡状变性, 肝细胞肿胀, 体积增大, 肝细胞点状坏死, 间质有少量炎症细胞浸润(图2).
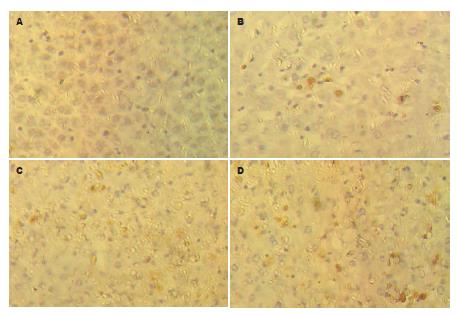
对每组的不同时间点观察2张切片, 每张切片分析5个视野, 每个视野计数100个细胞核, 计算凋亡细胞百分比的均数, 即为凋亡指数(apoptotic index, AI)[7]. 显微镜下, 凋亡的肝细胞多表现为细胞皱缩(cell shrinkage)、染色质浓集(chromatin condensation), 细胞核呈棕褐色着色, 凋亡小体也呈阳性着色. 对照组肝组织切片, 未见凋亡细胞; 6 h处理组, 肝组织内见少量凋亡细胞, AI为4.3±1.2%; 24 h和48 h处理组肝组织内则见较多的凋亡细胞, AI分别为20.6±3.3%、21.2±5.7%, 两者比较无统计学差异(P>0.05)(图3).
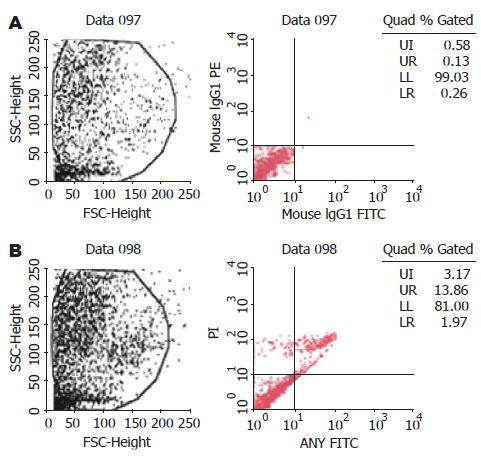
24 h处理组: 凋亡细胞百分数(包括早期和晚期凋亡细胞)为15.83%、坏死细胞百分数为3.17%, 存活细胞百分数为81%; 对照组: 凋亡细胞占0.39%、坏死细胞占0.58%、正常存活细胞占99.03%. 两组间存在显著差异(P<0.001).
内毒素主要是肠源性的. 肠道是体内巨大的细菌库, 其中定植着大量的革兰氏阴性细菌. 革兰氏阴性细菌死亡细胞壁崩解或活菌以发泡形式释放LPS, 因而肠道内积存有大量的LPS. 在正常情况下, 小量间歇进入门静脉的LPS, 被肝枯否细胞吞噬而清除. 病理情况下, 肠黏膜吸收的LPS显著增加和/或肝枯否细胞功能低下, 引起肝脏的损伤性反应. LPS对肝脏的毒性影响主要有二: (1)促进肝星状细胞(HSCs)分泌多种炎性细胞因子, 如TNF-α、IL-1β和IL-6等[8]. 这些炎性因子特别是TNF-α的作用可造成凋亡性肝细胞死亡及炎性细胞的浸润. 浸润的炎细胞可进一步造成肝细胞的损伤, 形成恶性循环; (2)LPS可直接或通过炎性因子的作用破坏血管内皮细胞的完整性, 造成微血管损伤及微血栓的形成, 引起肝内出血和肝细胞的坏死[5].
由于啮齿类动物对LPS的低反应性, 因此我们利用D-GalN致敏大鼠. 以往的研究证实[3], D-GalN的单独应用, 并不会造成动物死亡, 也不会影响肝细胞的功能, 对血清内炎性细胞因子水平也不产生影响. D-GalN的主要作用在于耗竭肝细胞内UTP储备而大大增强LPS的肝毒性. Mignon et al[4]研究发现, 动物经LPS/D-GalN处理后, 出现了典型暴发性肝衰竭的表现, 在10 h内100%动物死亡, 肝组织的病理学检查见死亡的肝细胞超过95%, 而其他脏器(心脏、脾脏和肺)的组织学检查则未见任何损伤表现, 这提示LPS/D-GalN诱导的肝细胞损伤具有器官特异性. 其他作者用LPS/D-GalN处理实验鼠后, 也引起了动物暴发性肝衰竭, 6 h内即可见大片肝细胞凋亡及微血管损伤后的出血坏死表现, 但动物大多在6-12 h内即死亡[5]. 这种极高的动物死亡率不利于肝损伤机制的探讨和药物治疗远期效应的研究. 目前认为一个理想的动物模型应该符合以下条件[13]: 与人类疾病特征相似, 病变有一定的发展过程, 形成率高, 死亡率低, 重复性好, 造模简便易行. 因此, 我们采用亚致死剂量的LPS/D-GalN处理动物.
本实验中, LPS在6 h内即造成了D-GalN致敏大鼠发生急性肝损伤、肝功能衰竭; 24 h进入疾病进程的高峰期, 如血生化指标ALT、AST和TBIL达峰值, 肝内渗出、出血和肝细胞的坏死、凋亡显著增多; 48 h, ALT开始明显降低(可能与肝细胞膜开始修复有关), 肝内出血减少, 渗出有所吸收, 但肝内空泡变性明显增多(可能由于肝内缺血缺氧影响了正常肝细胞的能量代谢, 肝细胞内水分增多的结果). 另外, 我们还证实, 损伤鼠肝组织内炎性细胞因子TNF-α和IL-1β的表达在损伤早期即显著增高并迅速达峰值(6 h内), 介导并启动了内毒素的肝损伤过程. 文献表明, LPS可激活Toll样受体4(Toll-like receptor-4, TLR4)[20]. 作为一个先天性免疫系统的传感器(sensor), TLR4的激活促进了单核巨噬细胞系统, 特别是肝枯否细胞对TNF-α等炎性细胞因子的大量分泌[21]. TNF-α是LPS诱导D-GalN致敏鼠肝损伤的关键性分子[14-16,28], 在LPS性急性肝损伤和其他炎性细胞因子的产生中起中心作用[17-19].
已知急性肝衰竭的发生是肝细胞的急性大量死亡不能为细胞增生所补偿的结果[30]. 我们发现, 损伤肝组织肝细胞死亡的主要形式为坏死和凋亡. 其他的研究证实急性肝衰竭患者肝细胞的死亡表现亦为凋亡和坏死[9], 并认为凋亡是其主要的病理改变. 对病毒性和内毒素等非病毒性损伤因子引起的肝损伤的研究也发现肝内呈现显著的细胞凋亡现象[11]. 因此细胞凋亡在急性损伤性肝组织中具有普遍性意义. 人体肝组织学检查[1]和动物实验[2]均证实了凋亡在急性肝损伤、肝衰竭的细胞死亡中起重要作用. 现在认为, 肝细胞凋亡是肝衰竭分子机制中最重要的事件[29]. 凋亡是肝细胞对各种损伤因子(包括内毒素)作用的第一个细胞反应[2], 而坏死则往往出现于细胞凋亡之后[10,31], 肝细胞的凋亡过程对随之出现的肝细胞坏死的形成起着至关重要的作用[10]. 所以对细胞凋亡机制的研究能够较深刻地揭示内毒素性急性肝损伤、肝衰竭的本质和规律. Bcl-2家族蛋白是细胞凋亡的重要调控因子[23], 但在急性肝损伤中的作用的研究却较少. 我们证实了LPS可显著地诱导细胞凋亡通路中的关键基因bax的表达. bax的高表达可启动细胞凋亡的线粒体通路[22], 并对内质网应激通路产生重要影响[12]. 但LPS通过何种方式诱导bax的表达, bax又在多大程度上对肝损伤、肝细胞凋亡产生影响, 还需要作进一步的研究. 研究的关键仍然需要建立可靠的动物模型.
总之, 亚致死剂量LPS/D-GalN的应用所建立的动物模型符合以下内毒素性急性肝损伤的诊断标准: (1)内毒素引起; (2)急性肝衰竭表现; (3)炎性细胞因子主要是TNF-α介导的肝损伤; (4)内毒素对肝内血管破坏所造成的肝内出血; (5)坏死和凋亡是主要的病理形态. 因而, 该模型为我们提供了一个与人类内毒素性急性肝损伤疾病进程与疾病状态相关的准确而可靠的平台.
内毒素血症和肝脏疾病之间存在着互为因果、相互影响的关系, 并可能形成恶性循环, 对患者的生命安全产生很大威胁. 所以, 打断该循环中的某个或某些链条, 阻止内毒素对肝脏的进一步损伤, 是急切需要我们解决的问题. 但是迄今为止, 临床上尚缺乏特殊有效的手段治疗内毒素引起的肝损伤. 抗生素的应用是无效的, LPS拮抗剂不仅价高, 而且并不能阻止肝脏病变的进一步发展. 为了更好地解答这些问题, 需要我们对内毒素引起肝损伤的机制、疾病状态和进程有更为深刻的认识. 建立适当的动物模型就是一个明智的选择.
细胞凋亡在急性肝损伤肝衰竭中的地位和作用机制及有效治疗方法的探讨.
1 Galanos C, Freudenberg MA, Reutter W. Galactosa-mine-induced sensitization to the lethal effects of en-dotoxin. Proc Natl Acad Sci USA 1979; 76: 5939-5943
2 Mignon A, Rouquet N, Fabre M, Martin S, Pages JC, Dhainaut JF, Kahn A, Briand P, Joulin V. LPS challenge in D-galactosa-mine-sensitized mice accounts for caspase-dependent fulminant hepatitis, not for septic shock. Am J Respir Crit Care Med 1999; 159: 1308-1315
3 Liu D, Li C, Chen Y, Burnett C, Liu XY, Downs S, Collins RD, Hawiger J. Nuclear import of proinflamma-tory transcription factors is required for massive liver apoptosis induced by bacterial lipopoly-saccharide. J Biol Chem 2004; 279: 48434-48442
1 亚致死剂量LPS/D-GalN的应用引起的动物急性肝衰竭, 是理想的内毒素性急性肝损伤动物模型.
2 细胞凋亡是该模型动物最主要的肝脏病理学改变.
3 肝细胞凋亡的机制可能与Bcl-2家族蛋白有关.
1 内毒素性急性肝损伤肝衰竭机制、治疗方法的研究.
2 其他TNF-α性肝衰竭作用机制及治疗的研究.
1 内毒素: 是革兰氏阴性细菌细胞壁外层上的特有结构, 是重要的外源性致热原, 其主要的化学成份和产生毒性的主要物质是脂多糖(LPS).
2 肠源性内毒素血症: 是指由肠道来源的内毒素血症. 其主要的发病机制为: 肠道内毒素生成和摄取增多(肠道细菌移位); 肝脏对内毒素的清除功能减退等.
3 急性肝衰竭: 是指肝细胞在短期内大量死亡, 造成肝衰竭, 并且黄疸出现8 wk内发生中度以上的肝昏迷.
文章具有一定新颖性和可读性, 达到国内先进水平.
电编: 张敏 编辑:潘伯荣 审读:张海宁
| 1. | Kasahara I, Saitoh K, Nakamura K. Apoptosis in acute hepatic failure: histopathological study of human liver tissue using the tunel method and immunohistochemistry. J Med Dent Sci. 2000;47:167-175. [PubMed] |
| 2. | Doggrell SA. Suramin: potential in acute liver fail--ure. Expert Opin Investig Drugs. 2004;13:1361-1363. [PubMed] |
| 3. | Galanos C, Freudenberg MA, Reutter W. Galactosa-mine-induced sensitization to the lethal effects of endotoxin. Proc Natl Acad Sci USA. 1979;76:5939-5943. [PubMed] |
| 4. | Mignon A, Rouquet N, Fabre M, Martin S, Pages JC, Dhainaut JF, Kahn A, Briand P, Joulin V. LPS challenge in D-galactosamine-sensitized mice accounts for caspase-dependent fulminant hepatitis, not for septic shock. Am J Respir Crit Care Med. 1999;159:1308-1315. [PubMed] |
| 5. | Liu D, Li C, Chen Y, Burnett C, Liu XY, Downs S, Collins RD, Hawiger J. Nuclear import of proin-flammatory transcription factors is required for massive liver apoptosis induced by bacterial lipopo-lysaccharide. J Biol Chem. 2004;279:48434-48442. [PubMed] |
| 7. | Kondo T, Suda T, Fukuyama H, Adachi M, Nagata S. Essential roles of the Fas ligand in the development of hepatitis. Nat Med. 1997;3:409-413. [PubMed] |
| 8. | Thirunavukkarasu C, Uemura T, Wang LF, Watkins SC, Gandhi CR. Normal rat hepatic stellate cells respond to endotoxin in LBP-independent manner to produce inhibitor(s) of DNA synthesis in hepato-cytes. J Cell Physiol. 2005;204:654-665. [PubMed] |
| 9. | Riordan SM, Williams R. Mechanisms of hepatocyte injury, multiorgan failure, and prognostic criteria in acute liver failure. Semin Liver Dis. 2003;23:203-215. [PubMed] |
| 10. | Kobayashi M, Tsujitani S, Kurisu Y, Kaibara N. Bcl-2 and Bax expression for hepatocellular apopto-sis in a murine endotoxin shock model. Hepatoga-stroenterology. 2002;49:1602-1606. [PubMed] |
| 11. | Jaeschke H, Gujral JS, Bajt ML. Apoptosis and necrosis in liver disease. Liver Int. 2004;24:85-89. [PubMed] |
| 12. | Mathai JP, Germain M, Shore GC. BH3-only BIK regulates BAX,BAK-dependent release of Ca2+ from endoplasmic reticulum stores and mitochon-drial apoptosis during stress-induced cell death. J Biol Chem. 2005;280:23829-23836. [PubMed] |
| 13. | 孙 敬方. 动物实验方法学. 第一版. 北京: 人民卫生出版社 2002; 462-463. |
| 14. | Morikawa , A , Sugiyama T, Kato Y, Koide N, Jiang GZ, Takahashi K, Tamada Y, Yokochi T. Apoptotic cell death in the response of D-galactosamine-sensitized mice to lipopolysaccharide as an experi-mental endotoxic shock model. Infect Immun. 1996;64:734-738. [PubMed] |
| 15. | Denlinger LC, Garis KA, Sommer JA, Guadarrama AG, Proctor RA, Bertics PJ. Nuclear translocation of NF-kappaB in lipopolysaccharide-treated macro-phages fails to correspond to endotoxicity: evidence suggesting a requirement for a gamma interferon-like signal. Infect Immun. 1998;66:1638-1647. [PubMed] |
| 16. | Morikawa A, Kato Y, Sugiyama T, Koide N, Chak-ravortty D, Yoshida T, Yokochi T. Role of nitric oxide in lipopolysaccharide-induced hepatic injury in D-galactosamine-sensitized mice as an experi-mental endotoxic shock model. Infect Immun. 1999;67:1018-1024. [PubMed] |
| 17. | Nowak M, Gaines GC, Rosenberg J, Minter R, Bahjat FR, Rectenwald J, MacKay SL, Edwards CK 3rd, Moldawer LL. LPS-induced liver injury in D-galactosamine-sensitized mice requires secreted TNF-alpha and the TNF-p55 receptor. Am J Physiol Regul Integr Comp Physiol. 2000;278:R1202-R1209. [PubMed] |
| 18. | Ksontini R, Colagiovanni DB, Josephs MD, Edwards CK 3rd, Tannahill CL, Solorzano CC, Norman J, Denham W, Clare-Salzler M, MacKay SL, Moldawer LL. Disparate roles for TNF-alpha and Fas ligand in concanavalin A-induced hepatitis. J Immunol. 1998;160:4082-4089. [PubMed] |
| 19. | Solorzano CC, Ksontini R, Pruitt JH, Auffenberg T, Tannahill C, Galardy RE, Schultz GP, MacKay SL, Copeland EM 3rd, Moldawer LL. A matrix metalloproteinase inhibitor prevents processing of tumor necrosis factor alpha (TNF alpha) and abrogates endotoxin-induced lethality. Shock. 1997;7:427-431. [PubMed] |
| 20. | Beutler B. Tlr4: central component of the sole mamm-alian LPS sensor. Curr Opin Immunol. 2000;12:20-26. [PubMed] |
| 21. | Lang CH, Silvis C, Deshpande N, Nystrom G, Frost RA. Endotoxin stimulates in vivo expression of inflammatory cytokines tumor necrosis factor alpha, interleukin-1beta, -6, and high-mobility-group protein-1 in skeletal muscle. Shock. 2003;19:538-546. [PubMed] |
| 22. | Haupt S, Berger M, Goldberg Z, Haupt Y. Apoptosis - the p53 network. J Cell Sci. 2003;116:4077-4085. [PubMed] |
| 23. | Willis S, Day CL, Hinds MG, Huang DC. The Bcl-2-regulated apoptotic pathway. J Cell Sci. 2003;116:4053-4056. [PubMed] |
| 24. | Yan Liu X, Robinson D, Veach RA, Liu D, Timmons S, Collins RD, Hawiger J. Peptide-directed suppre-ssion of a pro-inflammatory cytokine response. J Biol Chem. 2000;275:16774-16778. [PubMed] |
| 25. | Tiegs G, Barsig J, Matiba B, Uhlig S, Wendel A. Potentiation by granulocyte macrophage colony-stimulating factor of lipopolysaccharide toxicity in mice. J Clin Invest. 1994;93:2616-2622. [PubMed] |
| 26. | Gavrieli Y, Sherman Y, Ben-Sasson SA. Identifica-tion of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol. 1992;119:493-501. [PubMed] |
| 27. | Pan J, Xiang Q, Ball S. Use of a novel real-time quantitative reverse transcription-polymerase chain reaction method to study the effects of cytokines on cytochrome P450 mRNA expression in mouse liver. Drug Metab Dispos. 2000;28:709-713. [PubMed] |
| 28. | Kobayashi Y, Mori M, Naruto T, Kobayashi N, Sugai T, Imagawa T, Yokota S. Dynamic movement of cytochrome c from mitochondria into cytosol and peripheral circulation in massive hepatic cell injury. Pediatr Int. 2004;46:685-692. [PubMed] |
| 29. | Togo S, Kubota T, Matsuo K, Shimizu T, Momiyama N, Takeda K, Tanaka K, Endo I, Sekido H, Shimada H. Mechanism of liver failure after hepatectomy. Nippon Geka Gakkai Zasshi. 2004;105:658-663. [PubMed] |
| 30. | Thomson RK, Arthur MJ. Mechanisms of liver cell damage and repair. Eur J Gastroenterol Hepatol. 1999;11:949-955. [PubMed] |
| 31. | Wang YM, Feng GH, Huang F, Li Y, Zhao GZ. Tumor necrosis factor-alpha, caspase-3 expression and hepatocyte apoptosis in fulminanting hepatic failure. Zhonghua Neike Zazhi. 2003;42:566-570. [PubMed] |