修回日期: 2005-10-20
接受日期: 2005-10-24
在线出版日期: 2006-01-08
目的: 研究整合素β1及其配体固生蛋白Tenascin(TN)在肝细胞癌(HCC)中的表达, 探讨TN和整合素β1对HCC浸润转移的影响.
方法: 分别采用RT-PCR和免疫组织化学法检测42例HCC、10例肝硬化和7例正常肝组织内整合素β1和TN的表达, 观察其与HCC病理学特点之间的关系.
结果: 整合素β1在HCC中的阳性表达率显著高于非肝癌组织(χ2 = 6.33, P<0.05); 整合素β1在有包膜侵犯组、病理分级Ⅲ-Ⅳ组及有转移HCC中的表达水平明显高于无包膜侵犯组(u = 3.06, P<0.01)、病理分级Ⅰ-Ⅱ级组(u = 3.78, P<0.01)以及无转移组(u = 3.65, P<0.01); 病理分级Ⅲ-Ⅳ组、有包膜侵犯、有转移组的TN表达明显高于病理分级Ⅰ-Ⅱ级组(t = 2.467,P<0.05)、无包膜侵犯(t = 2.912, P<0.01)及无转移组(t = 2.742, P<0.01); 整合素β1阴性表达HCC中的TN表达水平明显低于整合素β1阳性和强阳性表达HCC中的TN(t = 2.351, P<0.05; t = 2.849, P<0.01).
结论: TN和整合素β1可能协同参与了HCC的浸润和转移, 检测其表达可做为判断HCC浸润转移的重要指标.
引文著录: 李兴睿, 郭悦青, 易继林. 整合素 β1 和固生蛋白 Tenascin 共表达与肝癌浸润转移的关系. 世界华人消化杂志 2006; 14(1): 100-103
Revised: October 20, 2005
Accepted: October 24, 2005
Published online: January 8, 2006
AIM: To explore the expression of Tenascin (TN) and integrinβ1 in hepatocellular carcinoma (HCC) and their effect on the invasion and metastasis of HCC.
METHODS: The expression of TN and integrinβ1 were detected in 42 HCC, 10 hepatic cirrhosis, and 7 normal liver tissues by reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemical method, respectively. The relations of TN and integrinβ1 expression with the pathological features of HCC were evaluated.
RESULTS: The positive expression of integrinβ1 in HCC tissues was significantly higher than that in non-HCC tissues (χ2 = 6.33, P < 0.05). The expression of integrinβ1 in HCC with invasion of tumor envelop(u = 3.06, P < 0.01), Edmondson grades Ⅲ-Ⅳ (u = 3.78, P < 0.01) and non-metastasis (u = 3.65, P < 0.01) was significantly higher than that in HCC with no tumor envelop invasion, Edmondson grades Ⅰ-Ⅱ, and tumor metastasis. The expression of TN in HCC with Edmondson grades Ⅲ-Ⅳ (t= 2.467, P < 0.05), invasion of tumor envelop (t = 2.912, P < 0.01), and metastasis (t = 2.742, P < 0.01) was significantly higher than that in HCC with Edmondson grades Ⅰ-Ⅱ, no tumor envelop invasion, and non-metastasis. The expression of TN in HCC with negative expression of integrinβ1 was significantly lower than that in HCC with positive and high positive expression of integrinβ1 (t = 2.351, P < 0.05; t = 2.849, P < 0.01).
CONCLUSION: TN and integrinβ1 may play a synergic role in the invasion and metastasis of HCC, and their expression can be used as important indexes in detecting the metastasis and invasion of HCC.
- Citation: Li XR, Guo YQ, Yi JL. Effect of integrin β1 and tenascin on invasion and metastasis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 100-103
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/100.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.100
近来研究发现, 肿瘤细胞表面整合素受体与细胞外基质(extracellular matrix, ECM)黏附所致的肿瘤细胞游离出或通过基底膜的过程, 是恶性肿瘤浸润生长和远处转移的始动步骤[1-3]. 固生蛋白Tenascin(TN)是ECM中一种具有独特六臂体结构的寡聚糖蛋白[4-7], 也是整合素的重要配体之一. 目前, 关于肝细胞癌(hepatocellular carcinoma, HCC)内TN和整合素的共表达情况尚未见报道, 我们通过分析TN和整合素β1在肝癌组织内的共表达情况及其与临床病理学征象之间的关系, 探讨两者在肝癌浸润转移中的作用.
所有病例均来自我院2001-01/2001-12期间住院手术患者. 肝癌患者42例, 其中男性30例, 女性12例, 平均年龄45.3岁(25-77岁), 均经手术后病理切片证实为肝细胞肝癌. 肝癌病理分级(Edmondson分级): Ⅰ-Ⅱ级20例, Ⅲ-Ⅳ级22例; 肿瘤直径≤5 cm者13例, >5 cm者29例, 均为单结节肝癌; 肿瘤包膜完整者18例, 有包膜侵犯者24例; 伴有转移者(包括肝外转移及门静脉癌栓)20例; 33例合并有肝硬化; 术前检查甲胎蛋白AFP阴性者(<400 mg/L)11例, 阳性者31例. 另外选取10例门脉高压症肝硬化患者及7例肝外伤患者肝脏标本作为对照组, 其中男性10例, 女性7例, 平均年龄46.7岁(35-58岁). 标本离体后, 剔除出血、坏死组织, 切取等量组织, 置于-70 ℃保存备用.
1.2.1 RT-PCR检测TN mRNA表达: 按TRIzol试剂盒(美国GIBCO/BRL公司)说明提取组织总RNA. 灭活DNA酶后, 取RNA 1 μg、Oligo(dT) 2 μL, DEPC水补足20 μL, 混匀后70 ℃变性5 min, 置冰上5 min, 加入10 mmol/L dNTP 1 μL、5×RT缓冲液4 μL、逆转录酶(AMV) 1 μL、RNasin 1 μL混匀后于37 ℃反应1 h, 95 ℃ 5 min, 灭活逆转录酶. 选取β-肌动蛋白(β-actin)为内参照物.
TN引物序列为: 上游5'-GAGATTTAGCCGTGTCTGAGGTTG-3'(4365-4389), 下游5'-AGGAGAGATTGAAGCTCTCG-3'(4665-4685)[8]. 逆转录产物5 μL加入反应管, 另加10×PCR缓冲液5 μL, 2.5 mmol/L dNTPs 2 μL, Taq酶2 U, 10 μmol/L的β-actin与TN引物各2 μL, 加水至50 μL. PCR扩增条件为: 95 ℃ 5 min, 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 60 s, 共35个循环, 最后72 ℃延伸7 min. 扩增产物放于含EB的20 g/L琼脂糖凝胶中进行电泳, 紫外光下观察结果并拍照. 采用英国UVP公司的凝胶成像分析系统, 分析各电泳条带吸光度A峰值下面积积分, 将TN/β-actin比值作为TN mRNA表达水平的相对参数.
1.2.2 免疫组织化学染色方法: 组织标本均由我院病理科行病理诊断证实, 并行Edmondson分级. 采用免疫组织化学SP染色法检测整合素β1的表达, 小鼠抗人整合素β1单克隆抗体(CD29 Ab-3)为美国Neomarkers公司产品. 操作步骤按试剂盒说明书进行.
1.2.3 整合素β1结果判定: 整合素β1阳性染色为细胞质内或细胞膜上棕黄色沉淀. 整合素β1表达结果按照半定量分级为: 无细胞着色为表达阴性(-); 10%-30%细胞呈阳性反应为表达弱阳性(+); 30%-60%细胞呈阳性反应为表达中度阳性(++); >60%细胞呈阳性反应为表达强阳性(+++).
统计学处理 采用秩和检验、χ2检验和t检验, 所有数据以均数±标准差(mean±SD)表示.
整合素β1在正常肝脏、肝硬化和肝癌组织中的表达具有明显异质性. 肝癌组织中整合素β1阳性表达率明显高于非肝癌组织(χ2 = 6.33, P<0.05). 在肝癌组织内, 整合素β1的表达明显增强, 细胞膜表面和细胞质内均可见整合素β1的表达(图1).
整合素β1的表达水平在有包膜侵犯组、病理分级Ⅲ-Ⅳ组及有转移组明显高于无包膜侵犯组、病理分级Ⅰ-Ⅱ级组和无转移组(表1), 但在不同肿瘤直径、不同AFP水平和是否合并肝硬化组间差异无统计学意义.
| 病理特征 | n | 半定量分级 | u值 | P值 | |||
| - | + | ++ | +++ | ||||
| 包膜侵犯 | |||||||
| 有 | 24 | 1 | 6 | 12 | 5 | 3.06 | P<0.01 |
| 无 | 18 | 6 | 8 | 3 | 1 | ||
| 病理分级 | |||||||
| III-IV | 20 | 1 | 2 | 12 | 5 | 3.78 | P<0.01 |
| I-II | 22 | 6 | 11 | 5 | 0 | ||
| 肿瘤转移 | |||||||
| 有 | 20 | 0 | 4 | 11 | 5 | 3.65 | P<0.01 |
| 无 | 22 | 7 | 9 | 6 | 0 | ||
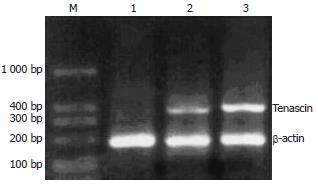
TN在不同肝脏组织内的表达具有明显异质性. RT-PCR检测发现, 肝癌组织内TN mRNA表达量明显高于肝硬化组织和正常肝组织(t = 2.693, P<0.01; t = 2.981, P<0.01)(表2, 图2).
依照肝癌的病理分级、有无包膜侵犯和转移的不同, TN mRNA表达量有显著差异(t = 2.467,P<0.05; t = 2.912, P<0.01; t = 2.742, P<0.01); 但TN的表达在不同肿瘤直径、不同AFP水平及是否合并肝硬化组间差异无统计学意义.
在肝癌组织内, 随着整合素β1表达强度升高, TN的表达也相应增高. 在整合素β1阴性的肝癌组织内, TN mRNA表达量为0.532±0.18, 明显低于整合素β1表达呈阳性(0.643±0.26)和强阳性(0.667±0.21)的肝癌组织(t = 2.351, P<0.05; t = 2.849, P<0.01).
肿瘤的浸润转移是一个复杂的过程, 也是临床上治疗肿瘤失败的主要原因之一. 恶性肿瘤细胞和ECM的黏附被认为是恶性肿瘤浸润转移的首要步骤, 其黏附是通过细胞膜表面的特异黏附分子介导的, 其中最重要的黏附分子为整合素家族[1]. 整合素是由α和β两个亚单位通过非共价键结合形成的异二聚体跨膜糖蛋白, 其功能在于与相应配体结合介导细胞与基底膜、细胞与细胞间的黏附, 并通过传递特定信号或诱导基因的表达来控制细胞的存在或凋亡[9]. TN是ECM中一种寡聚糖蛋白, 具有独特的六臂体结构, 其蛋白质序列中含有表皮生长因子(EGF)片段和Ⅲ型纤维连结蛋白片段[10,11], 也是整合素的重要配体之一. 研究表明, TN在乳腺癌、口腔癌等许多恶性肿瘤中都有高表达, 在体外能诱导内皮细胞增殖, 在体内可促进肿瘤细胞扩散, 加速肿瘤侵袭性生长[12-16]. 目前关于TN在肝癌中的表达及其与整合素的关系尚未见报道. 我们通过分析整合素β1和配体TN在肝癌组织内的共表达情况及其与临床病理学征象之间的关系, 探讨两者在肝癌浸润转移中的作用.
本研究结果显示, TN和整合素β1在肝癌组织中的表达明显高于正常肝组织及肝硬化组织. 结合肝癌各种病理指标分析的结果显示, 随着肿瘤恶性程度增高, TN和整合素β1表达也越强, 在低分化、有包膜侵犯及有转移的癌组织中, TN和整合素β1的表达明显高于中高度分化、无包膜侵犯和无转移者, 但两者的表达与肿瘤直径、AFP水平及肝硬化无关. 此外, 在肝癌组织内, 随着整合素β1的表达强度升高, TN的表达也相应增高. 在整合素β1阴性的肝癌组织内, TN表达的灰度值明显高于整合素β1表达呈阳性和强阳性的肝癌组织, 提示TN和整合素β1的表达具有相关性, 两者可能协同参与了肝癌的浸润和转移. 由于TN是整合素的重要配体, 我们推测, 肝癌细胞可能通过其表面的整合素位点, 识别并与配体TN结合, 使得肝癌细胞与ECM黏附, 从而释放基质金属酶等成分降解基质, 溶解ECM, 促使肿瘤细胞突破ECM向间质浸润, 最终造成肿瘤转移.
由于整合素和TN的表达与肝癌的分化程度、有无包膜侵犯及有无转移密切相关, 因此这两者可作为判断肝癌恶性程度和侵袭性的重要指标. 明确整合素和TN在肝癌浸润转移中的作用, 对于临床上治疗肝癌具有重要意义. 调节整合素的表达与功能, 改变肝癌细胞的黏附特性, 封闭ECM中TN的整合素结合位点, 可达到减少肝癌浸润和转移的目的. 因此, 干扰整合素和TN的结合有望成为肝癌治疗中的一个新方向.
整合素是细胞膜表面最重要的特异黏附分子, 介导了恶性肿瘤细胞和细胞外基质间的黏附, 后者被认为是恶性肿瘤浸润转移的首要步骤. 固生蛋白Tenascin是细胞外基质中一种重要组成部分, 也是整合素的主要配体之一. 关于TN在肝癌中的表达及其与整合素的关系尚未见报道.
整合素作为细胞膜表面最重要的特异黏附分子, 可和ECM中多种配体结合. 阐明整合素及其配体在肿瘤中的表达情况是目前肿瘤研究的热点之一, 干涉整合素与其配体的结合还有望成为未来抗肿瘤治疗的新方向.
本文结果显示,TN和整合素β1在肝癌组织中的表达明显高于正常肝组织及肝硬化组织, 随着肝癌恶性程度增高, TN和整合素β1表达也越强, 但两者的表达与肝癌直径、AFP水平及肝硬化无关. 此外, TN和整合素β1的表达具有相关性, 两者可能协同参与了肝癌的浸润和转移.
本文结果提示整合素和其配体TN协同参与了肝癌的浸润和转移, 为未来肝癌治疗提供了一个新方向. 调节整合素的表达与功能, 改变肝癌细胞的黏附特性, 封闭细胞外基质中TN的整合素结合位点, 干扰整合素和TN的结合, 可达到减少肝癌浸润和转移的目的.
本文具有一定创新性, 全篇文字流畅, 所得结论正确, 具有一定临床参考价值.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 1. | Prifti S, Zourab Y, Koumouridis A, Bohlmann M, Strowitzki T, Rabe T. Role of integrins in invasion of endometrial cancer cell lines. Gynecol Oncol. 2002;84:12-20. [PubMed] |
| 2. | Trikha M, Timar J, Zacharek A, Nemeth JA, Cai Y, Dome B, Somlai B, Raso E, Ladanyi A, Honn KV. Role for beta3 integrins in human melanoma growth and survival. Int J Cancer. 2002;101:156-167. [PubMed] |
| 3. | Charalabopoulos K, Mittari E, Karakosta A, Golias C, Batistatou A. Integrins adhesion molecules and some of their ligands in laryngeal cancer. Exp Oncol. 2005;27:86-90. [PubMed] |
| 4. | Adams M, Jones JL, Walker RA, Pringle JH, Bell SC. Changes in tenascin-C isoform expression in invasive and preinvasive breast disease. Cancer Res. 2002;62:3289-3297. [PubMed] |
| 5. | Pilch H, Schaffer U, Schlenger K, Lautz A, Tanner B, Hockel M, Knapstein PG. Expression of tenascin in human cervical cancer-association of tenascin expression with clinicopathological parameters. Gynecol Oncol. 1999;73:415-421. [PubMed] |
| 6. | Jang JH, Chung CP. Tenascin-C promotes cell survival by activation of Akt in human chondrosar-coma cell. Cancer Lett. 2005;229:101-105. [PubMed] |
| 7. | Leins A, Riva P, Lindstedt R, Davidoff MS, Mehraein P, Weis S. Expression of tenascin-C in various human brain tumors and its relevance for survival in patients with astrocytoma. Cancer. 2003;98:2430-2439. [PubMed] |
| 8. | Katenkamp K, Berndt A, Hindermann W, Wunderl-ich H, Haas KM, Borsi L, Zardi L, Kosmehl H. mRNA expression and protein distribution of the unspliced tenascin-C isoform in prostatic adenocar-cinoma. J Pathol. 2004;203:771-779. [PubMed] |
| 9. | Hood JD, Cheresh DA. Role of integrins in cell inva-sion and migration. Nat Rev Cancer. 2002;2:91-100. [PubMed] |
| 10. | Ghert MA, Jung ST, Qi W, Harrelson JM, Erickson HP, Block JA, Scully SP. The clinical significance of tenascin-C splice variant expression in chondrosar-coma. Oncology. 2001;61:306-314. [PubMed] |
| 11. | Ghert MA, Qi WN, Erickson HP, Block JA, Scully SP. Tenascin-C splice variant adhesive/anti-adhesive effects on chondrosarcoma cell attachment to fibro-nectin. Cell Struct Funct. 2001;26:179-187. [PubMed] |
| 12. | Atula T, Hedstrom J, Finne P, Leivo I, Markkanen-Leppanen M, Haglund C. Tenascin-C expression and its prognostic significance in oral and pharyng-eal squamous cell carcinoma. Anticancer Res. 2003;23:3051-3056. [PubMed] |
| 13. | Maschler S, Grunert S, Danielopol A, Beug H, Wirl G. Enhanced tenascin-C expression and matrix deposition during Ras/TGF-beta-induced progress-ion of mammary tumor cells. Oncogene. 2004;23:3622-3633. [PubMed] |
| 14. | Kalembeyi I, Inada H, Nishiura R, Imanaka-Yoshida K, Sakakura T, Yoshida T. Tenascin-C upregulates matrix metalloproteinase-9 in breast cancer cells: direct and synergistic effects with transforming growth factor beta1. Int J Cancer. 2003;105:53-60. [PubMed] |
| 15. | Gazzaniga P, Nofroni I, Gandini O, Silvestri I, Frati L, Agliano AM, Gradilone A. Tenascin C and epidermal growth factor receptor as markers of cir-culating tumoral cells in bladder and colon cancer. Oncol Rep. 2005;14:1199-1202. [PubMed] |
| 16. | Ishiwata T, Takahashi K, Shimanuki Y, Ohashi R, Cui R, Takahashi F, Shimizu K, Miura K, Fukuchi Y. Serum tenascin-C as a potential predictive marker of angiogenesis in non-small cell lung cancer. Anticancer Res. 2005;25:489-495. [PubMed] |