修回日期: 2004-10-06
接受日期: 2004-10-11
在线出版日期: 2005-05-01
目的: 探讨β-catenin 在早期胃癌中的表达与早期胃癌的多发性和单发性的关系.
方法: 用免疫组织化学方法检测59例早期胃癌患者胃癌组织中β-catenin的表达情况.
结果: 早期胃癌中存在β-catenin的异常表达, 多发组的阳性率为60.00%, 单发组的阳性率为13.79%, 均高于对照组. 多发组的阳性细胞百分率为(58.25±10.54)%, 单发组为(29.91±5.14)%, 两组比较差异有显著性(P<0.05).
结论: 在早期胃癌中存在β-catenin的异常表达, 与早期胃癌的多发性有关, β-catenin阳性的早期胃癌患者出现多发性胃癌的危险性高于β-catenin阴性者.
引文著录: 王轶淳, 孙明军, 傅炜昕, 傅宝玉. β-catenin 的表达与早期胃癌多发性的关系. 世界华人消化杂志 2005; 13(9): 1150-1153
Revised: October 6, 2004
Accepted: October 11, 2004
Published online: May 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1150-1153
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1150.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1150
β-catenin是细胞中的一种多功能蛋白质, 可以位于细胞膜、细胞质以及细胞核, 细胞膜上的β-catenin是细胞连接的重要组成部分, 细胞质中的β-catenin可以形成游离的蛋白池, 细胞核中的β-catenin则可以与转录因子Tcf/Lef家族构成复合物[1], 作为转录因子激活靶基因的转录. 大量研究表明, β-catenin与结肠癌、前列腺癌、黑色素瘤、肝癌等多种肿瘤的发生有关[2-5], 对其与早期胃癌的关系的研究, 尚未见报道. 在对早期胃癌患者行内镜下胃癌切除术(EMR)后发现, 有一些患者存在胃癌的多发性, 即在肿瘤切除后, 胃内再次有胃癌的发生, 而且与原来切除的肿瘤位置不同. 针对这种胃癌的多发者及单发者进行有关β-catenin的研究, 以期发现二者在β-catenin的表达方面的差异, 为有胃癌多发倾向的患者提供一个重点监控的依据.
内镜下切除的早期胃癌标本59例(为日本东北大学医学部附属医院病理室提供), 经苏木素-伊红染色证实癌组织限于黏膜层或者黏膜下层, 分为两组, 其中单发组29例, 为1995年行内镜下胃癌切除术后, 经5 a随访胃内无新的癌灶发生者, 其中男性21例, 女性8例, 年龄53-80(平均69.4)岁, 镜下分型: IIa型9例, IIc型14例, IIa+IIc型6例; 多发组30例, 为1995-2000年期间接受EMR治疗2次或2次以上者, 其中2次者为25例, 3次者为5例, 而且每次切除的癌灶部位均不同, 其中男性23例, 女性7例, 年龄51-82(平均69.6)岁, 镜下分型: I型1例次, IIa型24例次, IIc型18例次, IIa+IIc型22例次; 对照组10例, 为正常胃黏膜活检组织标本, 其中男性7例, 女性3例, 年龄54-80(平均66.5)岁.
40 g/L甲醛固定、石蜡包埋的、经EMR切除的早期胃癌组织及正常胃黏膜活检组织标本, 制备5 μm厚的连续切片, 采用苏木素-伊红染色, 光镜下观察胃癌浸润的深度及分化程度. 对连续切片的胃癌组织进行β-catenin的免疫组织化学染色, 采用SP法(β-catenin鼠抗人单克隆抗体购自Transduction Laboratories A BD Company, SP免疫组化试剂盒为DAKO公司产品), 在枸橼酸钠溶液中经120℃、5 min抗原修复, β-catenin的工作浓度为1: 200, 以已知阳性切片作为阳性对照, 阴性对照以PBS代替一抗. 结果判定: β-catenin免疫组织化学染色以细胞核中出现棕黄色颗粒且着色细胞数大于10%为阳性, 全片未见着色或着色细胞数小于10%为阴性. 由两位医师在共览显微镜下观察, 计数1 000个肿瘤细胞中细胞核β-catenin染色阳性的细胞数, 以百分比计算细胞核染色阳性率, 以mean±SD表示.
统计学处理 采用SPSS9.0统计软件进行方差分析.
58例为高分化型管状腺癌, 1例为中分化型管状腺癌, 其中51例的癌组织限于黏膜层, 单发组中有3例、多发组中有5例的胃癌浸润深度限于黏膜下层.
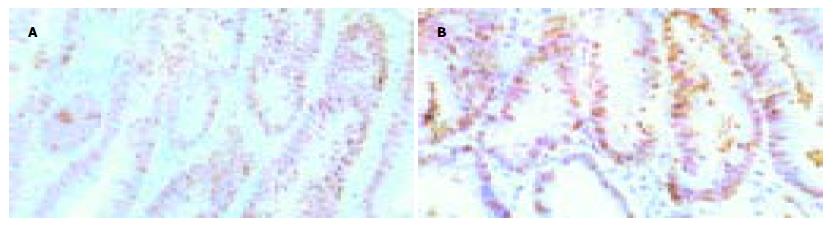
对照组的细胞膜有β-catenin的正常表达, 细胞质及细胞核无β-catenin的阳性表达. 胃癌组的胃癌区细胞膜无β-catenin的表达, 而细胞核中有β-catenin表达, 与正常细胞不同; 多发组中18例细胞核明显深染(图1A), 提示有β-catenin的阳性表达, 阳性率为60.00%, 4例未见细胞核染色, 仅见细胞质染色; 单发组中4例细胞核深染(图1B), 提示有β-catenin的阳性表达, 阳性率为13.79%, 1例未见细胞核染色, 可见细胞质染色. 两组比较差异有显著性(P<0.01).
对照组β-catenin阳性细胞百分率为0.00%; 在多发组有阳性表达的18例中β-catenin染色阳性细胞所占的比率为(58.25±10.54)%; 单发组有阳性表达的4例中, β-catenin染色阳性细胞所占的比率为(29.91±5.14)%, 两组比较差异有显著性(P<0.05).
β-catenin是一种多功能蛋白质, 具有细胞黏附和信号传导功能[1,6-7]. 细胞内绝大多数的β-catenin与E-cadherin相结合, 通过α-catenin与肌动蛋白细胞骨架相连, 参与细胞间的黏附和细胞运动. 当E-cadherin-catenin复合物中的任一结构发生变化时, 都会影响细胞间连接. 同时细胞中β-catenin的过度沉积可以促使细胞过度增生[8-9].β-catenin的生成与降解处于一种动态平衡状态, 细胞中的糖原合成酶激酶-3β(GSK-3β)可以使β-catenin的N端丝氨酸残基和苏氨酸残基磷酸化, 通过蛋白分解系统降解β-catenin, 使细胞中的β-catenin稳定在一个较低的水平. 当Wnt蛋白表达高时, 与细胞膜上的受体结合, 通过对adenomatous polyposis coli(APC)、GSK-3β等因素的抑制作用, 使细胞内单聚体的β-catenin增多, 与Tcf或者Lef结合, 进入细胞核, 而Tcf/Lef是DNA结合蛋白, 进入细胞核内后, 作为转录因子与相应的DNA结合, 促进靶基因(如C-myc、cyclinD1、MMP-7等)[10-13]的持续转录, 从而完成Wnt信号的传导. 另一方面, APC蛋白与β-catenin结合, 可以促进GSK-3β对β-catenin的磷酸化[14-15]. 而β-catenin基因本身的异常, 如β-catenin的外显子3的N端在调节β-catenin的机制中, 是一个非常重要的序列, 如果该序列缺失或者突变, 则出现β-catenin的降解障碍, 导致β-catenin的蓄积. 因此, APC的缺陷、β-catenin基因本身的突变以及Wnt途径中其他的变化, 均可以导致β-catenin的蓄积. 胃癌的发生发展是一个多因素多步骤的过程, 涉及多种癌基因、抑癌基因、端粒及端粒酶、细胞黏附因子等[16-21]. 有研究[22]表明, β-catenin的异常表达与预后不良有相关性. 胃癌组织中β-catenin在细胞膜表达的减弱与分化不良及存活时间短有关系[23]. 本研究表明, 在早期胃癌中存在β-catenin的异常表达. 与正常胃组织相比, 在胃癌细胞膜的表达缺失. 考虑该蛋白质表达的减弱或缺失, 可能导致α-catenin不能与cadherin相连接, 影响细胞间的正常连接, 从而使肿瘤细胞的黏附能力下降, 获得转移、侵袭的能力.
β-catenin的异常表达在肿瘤发展中的效应可能不同. Nhieu et al的研究[24]发现, 肝癌中β-catenin明显蓄积于细胞核, 与β-catenin基因的突变有相关性. 突变的β-catenin在细胞核的蓄积可能增加肿瘤复发的危险性, 预后不好. 对不同分期卵巢癌中β-catenin的表达与组织学分型以及疾病转归的关系的研究[25]发现, 细胞核表达β-catenin是预后良好的标志, 仅有细胞膜表达的, 预后不好. 有研究指出, Wnt信号传导通路与G蛋白通路等其他通路之间有交互作用[26], 可以形成复杂的网络, 提示β-catenin的异常表达在肿瘤发展过程中有多重效应[27-29]. 本研究结果表明, 正常胃组织中无β-catenin在细胞核的阳性表达, 而胃癌组织的细胞核中β-catenin呈阳性, 表达明显增强, 提示存在β-catenin的蓄积. 多发组β-catenin的阳性细胞所占的比率明显高于单发组, 两组比较差异有显著性, 提示β-catenin的异常表达与早期胃癌的多发性有关, β-catenin阳性的早期胃癌患者, 出现多发性胃癌的危险性高于β-catenin阴性者, 为加强对细胞核β-catenin表达异常的早期胃癌患者进行严格的定期随访提供了依据. 另外, β-catenin是Wnt通路中的关键环节, 其与上游及下游因子之间的关系非常复杂[30-33]. 本次实验中多发组有4例的两次胃癌切除标本β-catenin的表达不同, 一次为阳性, 另一次为阴性, 考虑可能是两次肿瘤的发生途径不同. 实验结果还显示, 多发组中有4 例、单发组中有1例存在β-catenin在细胞质中的表达, 而细胞核中呈阴性反应, 考虑在这些胃癌的发生过程中, 不是通过β-catenin的蓄积进而进入细胞核引起癌基因的激活, 而是存在其他的致癌途径.
我们未对是否存在β-catenin基因异常进行检测, β-catenin的蓄积是其基因本身的异常还是Wnt途径中其他因素异常所致, 目前尚不清楚, 有待进一步的研究.
编辑: 张海宁
| 1. | Park WS, Oh RR, Park JY, Lee SH, Shin MS, Kim YS, Kim SY, Lee HK, Kim PJ, Oh ST. Frequent somatic mutation of the β-catenin gene in intestinal-type gastric cancer. Cancer Res. 1999;59:4257-4260. [PubMed] |
| 2. | Morin PJ, Sparks AB, Korinek V, Barker N, Clevers H, Vogelstein B, Kinzler KW. Activation of β-catenin-Tcf signaling in colon cancer by mutations in β-catenin or APC. Science. 1997;275:1787-1790. [PubMed] |
| 3. | Voeller HJ, Truica CI, Gelmann EP. β-catenin mutations in human prostate cancer. Cancer Res. 1998;58:2520-2523. [PubMed] |
| 4. | Chan E, Gat U, McNiff JM, Fuchs E. A common human skin tumor is caused by activating mutations in β-catenin. Nat Genet. 1999;21:410-413. [PubMed] |
| 5. | Miyoshi Y, Iwao K, Nagasawa Y, Aihara T, Sasaki Y, Imaoka S, Murata M, Shimano T, Nakamura Y. Activation of the β-catenin gene in primary hepatocellular carcinomas by somatic alterations involving exon 3. Cancer Res. 1998;58:2524-2527. [PubMed] |
| 6. | Gumbiner BM. Signal transduction by β-catenin. Curr Opin Cell Biol. 1995;7:634-640. [PubMed] |
| 7. | Cui J, Zhou X, Liu Y, Tang Z, Romeih M. Wnt signaling in hepatocellular carcinoma: analysis of mutation and expression of beta-catenin, T-cell facter-4 and glycogen synthase kinease 3-beta genes. J Gastroenterol Hepatol. 2003;18:280-287. [PubMed] |
| 8. | Cui J, Zhou XD, Liu YK, Tang ZY, Zile MH. Abnormal beta-catenin gene expression with invasiveness of primary hepatocellular carcinoma in China. World J Gastroenterol. 2001;7:542-546. [PubMed] |
| 9. | Jiang Y, Zhou XD, Liu YK, Wu X, Huang XW. Association of hTcf-4 gene expression and mutation with clinicopathological characteristics of hepatocellular carcinoma. World J Gastroenterol. 2002;8:804-807. [PubMed] |
| 10. | He TC, Sparks AB, Rago C, Hermeking H, Zawel L, da Costa LT, Morin PJ, Vogelstein B, Kinzler KW. Identification of c-MYC as a target of the APC pathway. Science. 1998;281:1509-1512. [PubMed] |
| 11. | Tetsu O, McCormick F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature. 1999;398:422-426. [PubMed] |
| 12. | Brabletz T, Jung A, Dag S, Hlubek F, Kirchner T. Beta-catenin regulates the expression of the matrix metalloproteinase-7 in human colorectal cancer. Am J Pathol. 1999;155:1033-1038. [PubMed] |
| 13. | Monga SP, Monga HK, Tan X, Mule K, Pediaditakis P, Michalopoulos GK. Beta-catenin antisense studies in embryonic liver culture: role in proliferation, apoptosis, and lineage specification. Gastroenterology. 2003;124:202-216. [PubMed] |
| 14. | Orford K, Crockett C, Jensen JP, Weissman AM, Byers SW. Serine phosphorylation-regulated ubiquitination and degradation of β-catenin. J Biol Chem. 1997;272:24735-24738. [PubMed] |
| 15. | Papkoff J, Rubinfeld B, Schryver B, Polakis P. Wnt-1 regulates free pools of catenins and stabilizes APC-catenin complexes. Mol Cell Biol. 1996;16:2128-2134. [PubMed] |
| 16. | Li YL, He XM, Zheng HC, Wu DY, Yang XF, Xin Y, Fu BY. Expression of PTEN encoding product in malignant lesions of gastric mucosa and its significance. Shijie Huaren Xiaohua Zazhi. 2003;11:1294-1296. |
| 17. | Fang DC, Luo YH, Yang SM, Li XA, Ling XL, Fang L. Mutation analysis of APC gene in gastric cancer with microsatellite instabilly. World J Gastroenterol. 2002;8:787-791. [PubMed] |
| 18. | Song ZJ, Gong P, Wu YE. Relationship between the expression of iNOS, VEGF, tumor angiogenesis and gastric cancer. World J Gastroenterol. 2002;8:591-595. [PubMed] |
| 19. | Su JM, Gui L, Zhou YP, Zha XL. Expression of focal adhesion kinase and alpha5 and beta1 integrins in carcinomas and its clinical significance. World J Gastroenterol. 2002;8:613-618. [PubMed] |
| 20. | Liu DH, Zhang XY, Fan DM, Huang YX, Zhang JS, Huang WQ, Zhang YQ, Huang QS, Ma WY, Chai YB. Expression of vascular endothelial growth factor and its role in oncogenesis of human gastric carcinoma. World J Gastroenterol. 2001;7:500-505. [PubMed] |
| 21. | Fang DC, Yang SM, Zhou XD, Wang DX, Luo YH. Telomere erosion is independent of microsatellite instability but related to loss of heterozygosity in gastric cancer. World J Gastroenterol. 2001;7:522-536. [PubMed] |
| 22. | Jawhari A, Jordan S, Poole S, Browne P, Pignatelli M, Farthing MJ. Abnormal immunoreactivity of the E-cadherin-catenin complex in gastric carcinoma: relationship with patient survival. Gastroenterology. 1997;112:46-54. [PubMed] |
| 23. | Ramesh S, Nash J, McCulloch PG. Reduction in membranous expression of β-catenin and increased cytoplasmic E-cadherin expression predict poor survival in gastric cancer. Br J Cancer. 1999;81:1392-1397. [PubMed] |
| 24. | Nhieu JT, Renard CA, Wei Y, Cherqui D, Zafrani ES, Buendia MA. Nuclear accumulation of mutated β-catenin in hepatocellular carcinoma is associated with increased cell proliferation. Am J Pathol. 1999;155:703-710. [PubMed] |
| 25. | Gamallo C, Palacios J, Moreno G, Calvo de Mora J, Suarez A, Armas A. beta-catenin expression pattern in stage I and II ovarian carcinomas : relationship with beta-catenin gene mutations, clinicopathological features, and clinical outcome. Am J Pathol. 1999;155:527-536. [PubMed] |
| 26. | Gleason JE, Korswagen HC, Eisenmann DM. Activation of Wnt signaling bypasses the requirement for RTK/Ras signaling during C. elegans vulval induction. Genes Dev. 2002;16:1281-1290. [PubMed] |
| 27. | Tsukashita S, Kushima R, Bamba M, Nakamura E, Mukaisho K, Sugihara H, Hattori T. Beta-catenin expression in intramucosal neoplastic lesions of the stomach. Comparative analysis of adenoma/dysplasia, adenocarcinoma and signet-ring cell carcinoma. Oncology. 2003;64:251-258. [PubMed] |
| 28. | Li YJ, Ji XR. Relationship between expression of E-cadherin-catenin complex and clinicopathologic characteristics of pancreatic cancer. World J Gastroenterol. 2003;9:368-372. [PubMed] |
| 29. | Qiang YW, Endo Y, Rubin JS, Rudiloff S. Wnt signaling in B-cell neoplasia. Oncogene. 2003;22:1536-1545. [PubMed] |
| 30. | Ebert MP, Yu J, Hoffmann J, Rocco A, Rocken C, Kahmann S, Muller O, Korc M, Sung JJ, Malfertheiner P. Loss of beta-catenin expression in metastatic gastric cancer. J Clin Oncol. 2003;21:1708-1714. [PubMed] |
| 31. | Lowy AM, Fenoglio-Preiser C, Kim OJ, Kordich J, Gomez A, Knight J, James L, Groden J. Dysregulation of beta-catenin expression correlates with tumor differentiation in pancreatic duct adenocarcinoma. Ann Surg Oncol. 2003;10:284-290. [PubMed] |
| 32. | Miyoshi K, Hennighausen L. Beta-catenin: a transforming actor on many stages. Breast Cancer Res. 2003;5:63-68. [PubMed] |
| 33. | Su XK, Zhao XM, Li JQ, Cui XJ, Xie XH, Yang HY, Xu FB, Shi M. Role of β-catenin and cyclin D1 expression in intrahepatic dissemination of liver cancer. Shijie Huaren Xiaohua Zazhi. 2003;11:1362-1364. |