修回日期: 2005-03-28
接受日期: 2005-04-01
在线出版日期: 2005-05-01
目的: 研究胰腺癌组织PTCHmRNA的表达及其与胰腺癌分化程度、大小和侵润转移的关系.
方法: 收集28例手术切除的新鲜胰腺癌及癌旁胰腺组织, 利用RT-PCR方法分别检测癌组织和癌旁胰腺组织PTCHmRNA的表达情况.
结果: 28例胰腺癌组织中20例胰腺癌组织有PTCH mRNA表达(阳性率71.4%); 28例癌旁胰腺组织中无PTCHmRNA的表达; 胰腺癌组织和癌旁组织其PTCH mRNA阳性表达率差异有显著性(P<0.001); PTCH mRNA阳性表达率与肿瘤分化程度有关(P = 0.035), 与肿瘤的大小、淋巴及远处转移无关(P>0.05).
结论: PTCH mRNA在胰腺癌组织中有较高的阳性表达率, 检测其表达有助于胰腺癌的诊断, 并可作为判断胰腺癌恶性程度的重要指标.
引文著录: 陈志荣, 李兆申, 屠振兴, 高军, 龚燕芳, 金晶, 满晓华. 胰腺癌组织中PTCHmRNA的表达及其临床意义. 世界华人消化杂志 2005; 13(9): 1147-1150
Revised: March 28, 2005
Accepted: April 1, 2005
Published online: May 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1147-1150
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1147.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1147
胰腺癌是较常见而恶性程度高的消化系肿瘤, 近年来其发生率在国内外呈上升趋势. 胰腺癌的预后较差, 早期诊断困难. 最新研究认为Hedgehog信号通路与胰腺癌发生和发展密切相关. PTCH(patched)是hedgehog信号通路中的一个跨膜蛋白质受体. 国外对PTCH在胰腺癌的表达情况报道较少, 国内尚未有相关文献报道. 我们检测了胰腺癌组织中PTCH mRNA的表达情况, 并和癌旁组织的表达情况比较, 探讨其与胰腺癌临床病理指标的关系, 旨在为胰腺癌的临床诊断、治疗及预后提供依据.
1.1.1 标本: 人新鲜胰腺癌组织和人新鲜癌旁胰腺组织各28例均来自第二军医大学附属长海医院胰腺外科2004-02/2004-10手术病例, 其中男性17例, 女性11例, 年龄42-78岁, 平均55岁. 所有病例均经手术及病理学确诊, 均有完整的手术记录资料及临床资料.
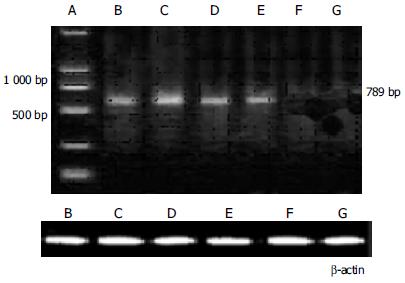
1.1.2 试剂及引物: 3S Trizol总RNA抽提纯化、RT-PCR试剂盒和所有引物购自上海生物工程公司. 采用Oligov 6.44软件设计并结合有关文献确定PTCH的引物. 上游: 5'-GAATTCGCTTCCCGTGCTTTTGTCTT-3'下游: 5'-GTCGACCTGCAGCTCAATGACTTC-3', 产物长度789 bp; 内参照β-actin: 上游: 5'-CCTAGCACCATGAAGATCAA-3'下游: 5'-AGCCATGCAAATGTCTCAT-3'产物长度250 bp.
采用RT-PCR法检测胰腺癌组织和癌旁胰腺组织PTCH mRNA的表达.
1.2.1 胰腺癌和癌旁组织总RNA抽提: 按照3S Trizol 总RNA抽提纯化试剂盒说明书进行. 取冻存的胰腺癌或癌旁胰腺组织50-100 mg在液氮中研成粉末加入Trizol 1 mL混匀振荡, 冰上置5 min, 4℃、12 000 g离心20 min, 取上清加550 μL氯仿4℃下12 000 g离心20 min, 取上清加350 μL异戊醇4℃下12 000 g离心20 min, 弃上清, 加700 mL/L乙醇1 mL, 4℃、12 000 g离心20 min, 弃上清, 加入500 μL RNW溶液12 000 g室温离心1 min. 弃上清, 加入500 μL RNW溶液12 000 g室温离心1 min, 弃上清, 1 000 r/min室温离心1 min小心取出柱子, 放到无菌RNase-free 1.5 mL离心管里, 在柱内膜的中央小心加入DEPC-H2O 50 μL, 50℃下放置2 min, 1 000 r/min室温离心1 min后收集管内的溶液即为RNA样品, 用紫外分光光度计测定细胞系总RNA纯度和含量.
1.2.2 RT-PCR: 按照RT-PCR试剂盒说明书进行, 采用一步反应法: 0.2 mL Eppendorf管每管加入10×反应缓冲液5 μL, Mgcl2(25 mmol/L)10 μL, dNTPs(10 mmol/L)5 μL, RNase抑制剂(4×107U/L)1 μL, AMV RTaseXL(5×107U/L)1 μL, AMV-Optimized Taq酶(5×107U/L)1 μL, 上、下游特异性引物各1 μL, 实验样品1 μL, RNaseFreeH2O 24 μL, 每管总反应体积50 μL. 反应条件为: 50℃ 60 min, 94℃ 2 min, 94℃ 40 s, 55℃ 1 min, 72℃ 1 min, 后三步反应进行30个循环, 结束前72℃ 10 min以充分延伸, 产物置4℃保存.
1.2.3 PCR产物电泳: 取PCR产物5 μL, 20 g/L琼脂糖凝胶电泳, 凝胶中加0.5 mg/L溴乙锭, 缓冲液为0.5×TBE, 5V/cm, 45 min. 在反射紫外灯下观察电泳条带, 用数码相机摄影并进行光密度扫描分析, 以β-actin为内参照, 结果以PCR产物/β-actin比值(T/N)表示.
统计学处理 各组结果以均数±标准差表示, 应用SPSS10.0统计软件进行χ2检验, 按n = 28, 计算确切概率P值.
所有胰腺癌和癌旁胰腺组织抽总RNA后经10 g/L琼脂糖凝胶电泳鉴定, 出现5S、18S、28S三条带, 总RNA抽提成功. 经RT-PCR检测, 28例胰腺癌组织中20例胰腺癌组织有PTCH mRNA表达(阳性率71.4%); 28例癌旁胰腺组织中无PTCH mRNA的表达; 胰腺癌组织和癌旁组织其PTCH mRNA阳性表达率差异有显著性(P<0.001)
mRNA表达的RT-PCR图, 见图1.
28例胰腺癌病例中, 胰头20例(71.4%), 胰体尾8例(28.6%). 肿瘤大小: ≤3 cm 13例, >3 cm 15例. 病理组织学分类: 浸润性导管癌26例(92.8%), 黏液性囊腺癌2例(7.2%). 结果显示, PTCH mRNA表达的阳性率在高分化胰腺癌组是40%, 在中、低分化胰腺癌组是83.33%. 胰腺癌组织中PTCH mRNA表达与胰腺癌的分化程度显著有关, 中至低分化胰腺癌组织PTCH mRNA表达阳性率明显高于高分化胰腺癌组织(P = 0.035), 而与病灶的大小、淋巴转移、远处转移无关(表1).
| 临床特征 | n | PTCHmRNA阳性 | PTCHmRNA(T/N) | P 肿瘤直径(cm) |
| ≤3 | 13 | 9 | 0.56± 0.15 | 1 |
| >3 | 15 | 11 | 0.49 ±0.20 | |
| 分化程度 | ||||
| 高分化 | 10 | 4 | 0.23±0.12 | 0.035 |
| 中低分化 | 18 | 15 | 0.76 ±0.23 | |
| 淋巴转移 | ||||
| 无 | 13 | 9 | 0.58±0.16 | 1 |
| 有 | 15 | 11 | 0.60±0.13 | |
| 远处转移 | ||||
| 无 | 23 | 17 | 0.52±0.14 | 0.606 |
| 有 | 5 | 3 | 0.55±0.12 |
近40 a来胰腺癌的发病率呈上升态势[1]. 胰腺癌发病以发达国家为主, 病死数约占所有癌症死亡人数的5%, 列癌肿死因的第5位, 仅次于肺癌、结直肠癌、乳腺癌和前列腺癌. 随着人口结构的改变和经济水平的发展, 发展中国家胰腺癌的发病率亦有所增长. 胰腺癌确诊后的中位生存期为3-6 mo, 5 a生存率仅为1%-4%, 死亡率几乎与发病率同步上升[2]. 最新研究[3-4]认为hedgehog信号通路与胰腺癌发生和发展密切相关. 在胚胎发育时期, Hedgehog(HH)信号转导通路对许多发育过程是必须的. HH分泌蛋白家族成员以浓度依赖方式控制细胞的增殖、分化和组织模式的形成[5]. 虽然在胚胎形成后, Hedgehog信号转导通路的活性消失, 最近有报道显示HH通路的活化可导致胰腺癌. HH信号途径最早是在对果蝇的早期胚胎形成相关基因的筛选中被鉴定[6]. 由HH配体、2个跨膜蛋白质受体PTCH(patched)和Smo(smoothened)组成的受体复合物, 以及下游的转录因子Gli蛋白(Gli1, Gli2, Gli3)等组成. HH配体; HH最早在果蝇中被鉴定为体节极性基因, 果蝇中只有一种HH. 在哺乳动物中存在三种HH成员: Shh(sonic hedgehog)、Ihh(Indian hedgehog)和Dhh(desert hedgehog), 三种HH均编码分泌蛋白[5]. 在发育组织和成体组织中, 不同HH的表达存在复杂的调控关系, 三种HH蛋白可以相互替代, 但是他们都有自己独特的功能. 信号蛋白Shh具有自身催化裂解功能, 在肢体、体节和神经管的形成中起作用; Ihh专门参与软骨细胞的发育; Dhh在精细胞的发育中起重要作用. 受体复合物: PTCH为Shh的受体, 属于跨膜蛋白, 在哺乳动物存在两种PTCH家族成员, 即PTCH1和PTCH2, 他们均能结合所有Hh蛋白(Shh、Ihh和Dhh). Smo属于G蛋白偶联的受体, 是一种跨膜蛋白[7-8]. 虽然对配体-受体信号转导的精确细节仍不明了, 目前模型推测在没有HH配体信号刺激下, PTCH抑制Smo的活性. 当HH与PTCH结合后, 解除了PTCH对Smo的抑制[9], 释放的Smo进入胞内, 引发细胞内信号下传, 激活下游转录因子Gli家族, 调节多种靶基因的表达. HH信号途径在胚胎发育过程中作用被广泛研究[5], 但他在成体组织中的作用研究甚少. 越来越多的证据显示在某些成体组织仍存在HH活性. 成体组织中HH活性的失调可能与肿瘤的形成有关[7]. 有证据证明由HH信号途径激活而诱导产生的肿瘤存在HH信号途径中激活因子的变异. 已经确认在基底细胞癌(BCC)、乳腺癌和成神经管细胞瘤存在Shh的活化[7]. 最近的研究表明增强的HH信号通路还能引起其他器官包括肺、胃肠道和胰腺的肿瘤[3-4]. Berman et al[4]报道: 在来源于食管、胃、胆道、胰腺和结肠肿瘤的38个细胞系中有37个细胞系检测到Shh和Ihh的mRNA表达. Hh的靶基因PTCH和Gli作为Hh通路活性的指标, 在6个食管癌细胞系中有4个细胞系4/6), 在6个胃癌细胞系中有4个细胞系(4/6), 在6个胰腺癌细胞系中有5个细胞系(5/6), 在9个胆管癌细胞系中有4个细胞系(4/9)存在PTCH和Gli的共同表达, 但在11个结肠癌细胞系中无1个细胞系检测到PTCH的表达. 为在体内研究Hh信号通路的活性, 用新鲜切下的胃和胰腺肿瘤为材料, RT-PCR检测PTCHmRNA的表达水平, 发现在胰腺肿瘤组织中, 其PTCHmRNA的表达水平是正常胰腺组织的448倍, 在胃肿瘤组织中, 其PTCHmRNA的表达水平是正常胃组织的129倍. 在成人胰腺组织, 虽然Ptch1的表达水平低于通过免疫组化能够检测到的水平, 但Hh信号通路活化参与胰腺癌的进展, 从胰腺上皮内肿瘤(PanIN)到胰腺癌, Hh信号转导成员的表达是逐渐增强的[3]. 在转基因鼠上, 由与胰腺和十二指肠相似框基因1(Pdx1)启动子控制的Shh的异位表达, 导致了胰腺出现PanIN病变的形成[3]. PanIN病变以胰腺腺管细胞形态学改变、黏液积聚、乳头状增生、细胞核肿大和极性消失为特点. 此外, 在这些转基因鼠上, 还发现了Erbb2的过度表达和原癌基因Kras的突变[3], Erbb2的过度表达和原癌基因Kras的突变以前被认为与胰腺癌相关. 进一步通过免疫组化对Hh信号通路的活性进行检测, 发现在正常胰腺组织中无PTCH和Smo的表达, 但在转基因鼠和人胰腺癌组织中均有过度表达. 最近的研究发现, Hh信号通路的失调不仅引起肿瘤的产生而且对肿瘤的发展和维持是非常重要的, 因为转化的细胞继续依赖Hh的活性而生长. 对26个原发或转移性胰腺癌的细胞系进行Hh信号通路的活性检测, 发现全部的细胞系均有2个或多个Hh途径成员的表达, 包括PTCH1、Smo、HIP和GLI1[3].
本研究结果显示, 28例胰腺癌组织中20例胰腺癌组织有PTCH mRNA表达(阳性率71.4%); 28例胰腺癌旁组织无PTCH mRNA的表达; 胰腺癌组织和癌旁组织其PTCHmRNA阳性表达率差异有显著性(P<0.001); 说明大约70%左右胰腺癌组织中存在hedgehog信号通路成员PTCH mRNA的表达, 也即存在hedgehog信号通路的活化, 而胰腺癌旁组织无hedgehog信号通路成员PTCH mRNA的表达, 也说明了在胰腺癌旁组织hedgehog信号通路是关闭的. PTCH mRNA阳性表达率与肿瘤分化程度有关(P = 0.035), 与肿瘤的大小、淋巴及远处转移无关(P>0.05). 说明在有hedgehog信号通路活化参与发生的胰腺癌较无hedgehog信号通路参与发生的胰腺癌其恶性程度高、分化增殖快. 由于hedgehog信号通路活化参与胰腺癌发生的确切机制还不清楚, 比如, 在有的胰腺癌组织中检测到Smo mRNA的表达, 而没有检测到PTCH mRNA的表达, 有的胰腺癌组织中同时检测到Smo mRNA和PTCH mRNA的表达, 还有的胰腺癌组织中只检测到PTCH mRNA的表达. 有关PTCH表达于肿瘤生物学行为的关系以及PTCH作用机制有待进一步的临床观察和深入研究.
编辑: 张海宁
| 1. | Rosenberg L. Pancreatic cancer: a review of emerging therapies. Drugs. 2000;59:1071-1089. [PubMed] |
| 2. | RegineWF , JohnWJ , Mohiuddin M. Current and emerging treatments for pancreatic cancer. Drugs Aging. 1997;11:285-295. [PubMed] |
| 3. | Thayer SP, di Magliano MP, Heiser PW, Nielsen CM, Roberts DJ, Lauwers GY, Qi YP, Gysin S, Fernandez-del Castillo C, Yajnik V. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis. Nature. 2003;425:851-856. [PubMed] |
| 4. | Berman DM, Karhadkar SS, Maitra A. Wide spread requirement for Hedgehog ligand stimulation in growth of digestive tract tumour. Nature. 2003;425:846-851. |
| 5. | Ingham PW, McMahon AP. Hedgehog signaling in animal evelopment: paradigms and principles. Genes Dev. 2001;15:30593087. [PubMed] |
| 6. | Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature. 1980;287:795801. [PubMed] |
| 7. | Ruiz i Altaba A, Sanchez P, Dahmane N. Gli and hedgehog in cancer: tumours, embryos and stem cells. Nature Rev Cancer. 2002;2:361372. [PubMed] |
| 8. | Murone M, Luoh SM, Stone D. Gli regulation by the opposing activities of fused and suppressor of fused. Nature Cell Biol. 2000;2:310312. [PubMed] |