修回日期: 2005-03-01
接受日期: 2005-03-10
在线出版日期: 2005-05-01
目的: 研究腹水脱落细胞及腹膜活检标本中肝素酶的表达, 探讨肝素酶用于鉴别良、恶性腹水的可行性.
方法: 采用逆转录-聚合酶链反应(RT-PCR)法检测47例腹水脱落细胞中肝素酶mRNA的表达, 同时利用免疫组织化学法检测肝素酶蛋白在36例腹膜活检标本中的表达, 与相关的临床资料进行分析.
结果: 肝素酶mRNA在良、恶性腹水脱落细胞中的表达无明显差异(P>0.05). 在腹膜活检标本中, 肝素酶蛋白不仅存在于腹膜癌细胞中, 在结核性腹膜炎上皮样细胞、郎格罕巨细胞、淋巴细胞中及异位的子宫内膜细胞及其间质细胞中均有表达; 免疫组织化学法检测腹膜组织中, 良、恶性腹水组之间的肝素酶阳性率亦无显著性差异(P>0.05).
结论: 肝素酶在良性腹水中的高表达可能与腹水脱落细胞中的炎性细胞增高有关. 腹水脱落细胞中肝素酶mRNA的表达不能用于良恶性腹水的鉴别.
引文著录: 蔡永国, 房殿春, 杨仕明, 罗元辉, 陈陵, 王东旭. 肝素酶表达鉴别良、恶性腹水无价值. 世界华人消化杂志 2005; 13(9): 1111-1114
Revised: March 1, 2005
Accepted: March 10, 2005
Published online: May 1, 2005
AIM: To investigate the expression of human heparanase in the peritoneal membrane autopsy specimen and the exfoliative cells of ascites, and to assess its value in the differential diagnosis of malignant and benign ascites.
METHODS: Expression of heparanase mRNA in ascites was detected by RT-PCR in forty-seven patients. Heparanase protein expression in 37 biopsies of peritoneum was detected by immunohistochemistry.
RESULTS: There was no difference in the expression of heparanase mRNA between benign and malignant ascites (P>0.05). Heparanase protein was expressed not only in tumor cells, but also in activated lymphocytes, epithelioid cells, and Langhans giant cells in tuberculosis peritonitis, as well as the heterotopic endometrium and interstitial cells in endometriosis. In those 36 cases detected by immunohistochemistry, no significant difference was found between benign and malignant ascites (P>0.05).
CONCLUSION: High expression of heparanase mRNA in some benign ascites may be due to the increase of inflammatoty cells in the peritoneum. Expression of heparanase mRNA in sedimentation of ascites is not a good predictive marker for the differential diagnosis of benign and malignant ascites.
- Citation: Cai YG, Fang DC, Yang SM, Luo YH, Chen L, Wang DX. Expression of heparanase mRNA is not a good predictive marker in differential diagnosis of ascites. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1111-1114
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1111.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1111
肝素酶是近年来发现的能够降解基底膜及细胞外基质的关键酶, 具有促进肿瘤细胞向周围组织的间隙侵袭, 能促进多种类型肿瘤的浸润与转移. 我们以往的研究表明, 肝素酶在胃癌组织中高表达, 能够促进胃癌血管的生成, 促进胃癌的浸润与转移, 是胃癌患者预后不良的一个指标, 但在邻近的正常组织中仅有较低的表达[1]. 在腹水脱落细胞中肝素酶是否表达, 能否用于鉴别腹水的性质尚未见报道, 我们采用RT-PCR法检测肝素酶在腹水脱落细胞中的表达, 探讨肝素酶在良、恶性腹水鉴别诊断中的意义.
2003-6/2003-12腹水患者47例, 男13例, 女34例. 年龄17-77(51±14)岁. 其中36例患者经腹腔镜检查并病理组织学确诊. 良性腹水20例, 其中肝硬化腹水7例, 结核性腹膜炎9例, 心源性腹水2例, 肾病性腹水1例, 子宫内膜异位症1例. 恶性腹水27例, 其中转移性腺癌25例, 腹膜间皮瘤1例, 其他1例. 取腹水20-50 mL, 离心取腹水脱落细胞, 放入经二乙基焦碳酸酯(DEPC)处理过的Ep管内, 置-70℃低温冰箱保存备用. 腹膜活检标本36例用40 g/L甲醇固定后, 常规石蜡包埋切片. TriPure分离试剂(美国Roche公司); RT-PCR试剂盒(美国Promega公司); 肝素酶引物及GAPDH引物(上海生物工程公司); PCR Marker(DGL-2000, 北京鼎国公司). 紫外分光光度计(DU-6400型, 美国Bio-Rad公司), PCR扩增仪(2400型, 美国PE公司). XF-90型暗箱式紫外透射仪(美国Sigma公司), 凝胶成像仪(美国Bio-Rad公司).
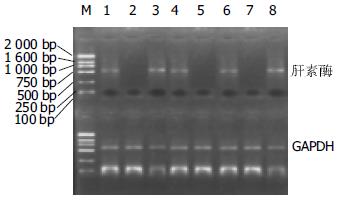
1.2.1 腹水细胞总RNA定量及肝素酶mRNA的RT-PCR检测: 腹水20-50 mL经1 000 r/min离心15 min, 弃上清, 收集离心后的沉淀, 采用TriPure抽提mRNA. 操作方法按试剂说明进行. 将提取的总RNA用DEPC处理过的去离子水重悬RNA颗粒, 紫外分光光度计下进行核酸定量. RT-PCR检测腹水脱落细胞中肝素酶mRNA的表达采用一步法. 肝素酶引物上游序列为: 5'TTC GAT CCC AAG AAG GAA TCA AC3'; 下游序列为: 5'GTA GTG ATG CCA TGT AAC TGA ATC3'. 以GAPDH为内参照, 其上游引物序列为: 5'CCA CCC ATG GCA AAT TCC ATG GCA 3'; 下游引物序列为: 5'TCT AGA CGG CAG GTC AGG TCC AC3'. RT-PCR的操作步骤参照试剂盒说明进行. 扩增体积为25 μL. 反应条件参照文献并加以优化: 48℃逆转录45 min, 94℃变性2 min, 53℃退火1 min, 68℃延伸2 min, 40个循环; 68℃ 最终延伸7 min. 反应产物加入溴酚蓝溶液5 μL, 取8 μL在15 g/L琼脂糖凝胶上电泳, 紫外灯下观察结果. 剩余反应物储存于-20℃. 观察并照相.
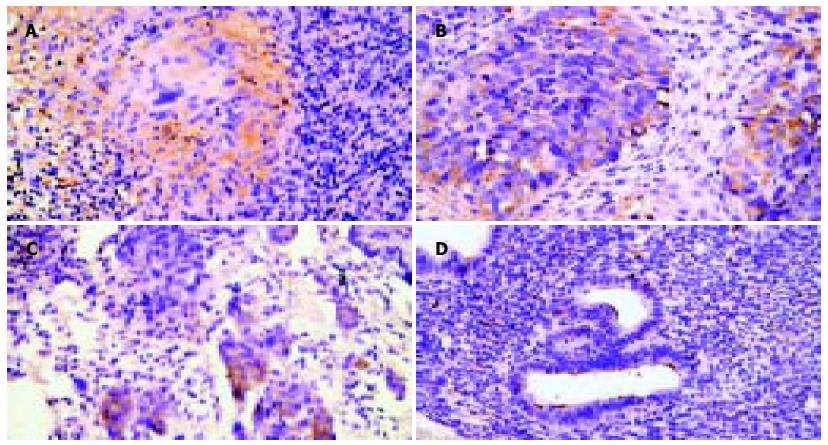
1.2.2 腹膜组织肝素酶免疫组化染色: 采用链霉菌素-生物素免疫组织化学染色(SP)法. 组织标本采用常规石蜡包埋, 制成4 μm厚切片; 二甲苯脱蜡、梯度酒精水化、微波抗原修复; 30 mL/L H2O2去除内源性过氧化物酶; 50 mL/L羊血清封闭非特异性抗原; 加入一抗为兔抗人肝素酶pAb, 1: 50稀释, 4℃过夜; 加入二抗为生物素化羊抗兔mAb, 1: 200稀释, 室温30 min; 加入辣根过氧化物酶标记的链霉亲合素(1: 150稀释); DAB反应显色; 苏木素复染, 中性树胶封片. 以PBS代替一抗为阴性对照, 以已知肝素酶阳性的胃癌标本为阳性对照. 阳性染色的肿瘤细胞小于30%同类病变细胞为阴性, 大于30%为阳性, 其中30%-50%为(+), 50%-80%为(++), >80%为(+++).
统计学处理 采用SPSS 10.0 for windows软件进行χ2检验.
肝素酶阳性病例经RT-PCR扩增后呈538 bp的条带, GAPDH扩增后为598 bp的条带.47患者中有36例肝素酶mRNA阳性表达, 总阳性率为76.6%. 良性腹水共20例, 其中肝素酶阳性者15例(75%), 良性腹水中, 肝硬化7例, 其中肝素酶阳性者5例, 均为肝炎后肝硬化, 另2 例阴性者均为酒精性肝硬化, 结核性腹炎9例, 其中8例阳性, 心源性腹水2例, 其中1例为阳性, 肾病性腹水1例, 为阴性. 子宫内膜异位症1例为阳性. 恶性腹水27例中有21例阳性(78%). 经统计学分析良性腹水与恶性腹水肝素酶的表达率不具有统计学差异(75% vs 78%, P>0.05, 表1, 图1).
| 腹水类型 | n | 肝素酶 | |
| (+) | (-) | ||
| 良性: 结核性腹膜炎 | 9 | 8 | 1 |
| 肝硬化 | 7 | 5 | 2 |
| 心源性腹水 | 2 | 1 | 1 |
| 肾性腹水 | 1 | 0 | 1 |
| 子宫内膜异位症 | 1 | 1 | 0 |
| 恶性: 转移性腺癌 | 25 | 19 | 6 |
| 腹膜间皮瘤 | 1 | 1 | 0 |
| 其他 | 1 | 1 | 0 |
肝素酶蛋白位于相应细胞的胞质中, 呈棕黄色, 细颗粒状着色. 在转移性腹膜腺癌的癌细胞、腹膜间皮瘤细胞、异位子宫内膜细胞及其间质细胞, 结核性腹膜炎的上皮样细胞、郎罕巨细胞、淋巴细胞尤其位于结核结节附近处染色明显增强. 腹腔镜腹膜活检标本36例的病例中, 腹膜癌19例(包括1例腹膜间皮瘤), 肝素酶阳性18例, 阳性率为94.7%, 腹膜良性病变17例(其中腹膜结核16例, 子宫内腹异位症1例), 肝素酶阳性14例(包括1例子宫内膜异位症), 阳性率为76.5%, 二者相比无显著差异(P>0.05).
腹水是一种临床常见症状, 病因众多[2], 很多恶性腹水的原发病灶常不明确, 腹水脱落细胞学检查常阴性, 临床对于良、恶性腹水的鉴别诊断有时较为困难, 经常需要联合多项腹水化验指标进行综合分析与判断[3-6]. 研究可用于腹水鉴别诊断的新指标具有非常重要的临床意义. 利用RT-PCR这一敏感的检测技术检测腹水脱落细胞中某些肿瘤相关基因可以提高恶性腹水的诊断率[7]. 肝素酶基因是近年来发现的新的肿瘤相关基因, 其产物是参与细胞外基质及基底膜降解而促进癌细胞在人体内转移扩散的关键酶[8-9]. 研究发现肝素酶在人类多种肿瘤组织中均有表达, 能促进肿瘤的浸润与转移, 与肿瘤患者的不良预后相关[10-15]. 我们发现肝素酶在胃癌组织中的阳性率为74.5%, 而在癌旁组织中仅为19.1%[1]. 肝素酶在人肿瘤细胞高表达而在相应的正常组织中低表达为肝素酶有可能用于良、恶性腹水的鉴别提供了理论依据. 但亦有研究发现在人的炎细胞、免疫活性细胞以及NK细胞中均有肝素酶的表达, 在活化状态下的表达量可能会更高[8], 因此, 肝素酶能否作为良、恶性腹水的鉴别指标有进一步研究的价值.
我们采用RT-PCR技术检测了腹水脱落细胞中肝素酶的表达, 发现恶性腹水脱落细胞中肝素酶的表达率为78%, 提示肝素酶阳性可能与恶性肿瘤的转移有关, 但另一方面, 我们亦发现在良性腹水中肝素酶表达率为75%, 二者相比无显著差异(P>0.05). 我们进一步采用免疫组织化学法对36例腹膜活检标本中肝素酶蛋白的表达进行了检测, 发现肝素酶蛋白不仅表达于腹膜转移癌或者腹膜间皮瘤中, 而且在异位的生长的子宫内膜细胞及其间质细胞、结核结节附近的淋巴细胞及上皮样细胞、郎罕氏巨细胞中, 亦发现有肝素酶蛋白的表达, 统计学显示肝素酶在腹膜结核与腹膜癌之间的表达率不具有差异性(P>0.05). 在子宫内膜及异位子宫内膜中均有肝素酶的表达, 多认为是一种子宫内膜的功能性变化, 亦有作者认为在子宫内膜异位症时有可能增加异位内膜的血管生成能力及转移能力[16-18]. 本组20例良性腹水中, 肝素酶mRNA阳性为15例, 这些肝素酶阳性的良性腹水, 除1例子宫内膜异位症患者外, 其腹水常规检查都为渗出液(包括肝硬化者多合并有自发性腹膜炎), 腹水中白细胞计数都超过0.5×109/L, 因此, 这些患者腹水中肝素酶mRNA和蛋白质的表达增高可能与其中的炎细胞增高并活化有关. 综上所述, 肝素酶在良、恶性腹水中均有较高的表达. 炎性细胞在良性腹水中积聚及活化可能是良性腹水中肝素酶mRNA高表达的原因. 检测腹水脱落细胞中肝素酶mRNA的表达对于鉴别良、恶性腹水没有应用价值.
编辑: 张海宁 电编: 潘伯荣
| 1. | Cai YG, Fang DC, Yang SM, Luo YH, Yang MH, Wang DX. Increased expression of heparanase mRNA is correlated with metastasis of gastric carcinoma and is probably correlated with c-met protein. Zhonghua Yixue Zazhi. 2004;84:974-978. [PubMed] |
| 2. | Bar-Meir S, Lerner E, Conn HO. Analysis of ascitic fluid in cirrhosis. Dig Dis Sci. 1979;24:136-144. [PubMed] |
| 3. | Piura B, Rabinovich A, Leron E, Yanai-Inbar I, Mazor M. Peritoneal tuberculosis-an uncommon disease that may deceive the gynecologist. Eur J Obstet Gynecol Reprod Biol. 2003;110:230-234. [PubMed] |
| 4. | Adam RA, Adam YG. Malignant ascites: past, present, and future. J Am Coll Surg. 2004;198:999-1011. [PubMed] |
| 5. | Torresini RJ, Prolla JC, Diehl AR, Morais EK, Jobim LF. Combined carcinoembryonic antigen and cytopathologic examination in ascites. Acta Cytol. 2000;44:778-782. [PubMed] |
| 6. | Gulyas M, Kaposi AD, Elek G, Szollar LG, Hjerpe A. Value of carcinoembryonic antigen (CEA) and cholesterol assays of ascitic fluid in cases of inconclusive cytology. J Clin Pathol. 2001;54:831-835. [PubMed] |
| 7. | Perez R, Zhang PJ. Detection of EWS-WTT fusion mRNA in ascites of a patient with desmoplastic small round cell tumor by RT-PCR. Hum Pathol. 1999;30:239-242. [PubMed] |
| 8. | Vlodavsky I, Elkin M, Pappo O, Aingorn H, Atzmon R, Ishai Michaeli R, Aviv A, Pecker I, Friedmann Y. Mamalian heparanase as mediator of tumor metastasis and angiogenesis. Isr Med Assoc J. 2000;2:37-45. [PubMed] |
| 9. | Zcharia E, Metzger S, Chajek Shaul T, Friedmann Y, Pappo O, Aviv A, Elkin M, Pecker I, Peretz T, Vlodavsky I. Molecular properties and involvement of heparanase in cancer progression and mammary gland morphogenesis. J Mamm Gland Biol Neop. 2001;6:311-322. [PubMed] |
| 10. | Maxhimer JB, Quiros RM, Stewart R, Dowlatshahi K, Gattuso P, Fan M, Prinz RA, Xu X. Heparanase-1 expression is associated with the metastatic potential of breast cancer. Surgery. 2002;132:326-333. [PubMed] |
| 11. | El-Assal ON, Yamanoi A, Ono T, Kohno H, Nagasue N. The clinicopathological significance of heparanase and basic fibroblast growth factor expressions in hepatocellular carcinoma. Clin Cancer Res. 2001;7:1299-1305. [PubMed] |
| 12. | Munenori T, Yoshio N, Takaomi O, Hirokazu U, Yasuhiro S, Futoshi U, Toshiyoshi F, Mehmet G, Hitoshi N, Motowo N. Heparanase expression correlates with invasion and poor prognosis in gastric cancers. Lab Invest. 2003;83:613-622. [PubMed] |
| 13. | Koliopanos A, Friess H, Kleeff J, Shi X, Liao Q, Pecker I, Vlodavsky I, Zimmermann A, Buchler MW. Heparanase expression in primary and metastatic pancreatic cancer. Cancer Res. 2001;61:4655-4659. [PubMed] |
| 14. | Gohji K, Okamoto M, Kitazawa S, Toyoshima M, Dong J, Katsuoka Y, Nakajima M. Heparanase protein and gene expression in bladder cancer. J Urol. 2001;166:1286-1290. [PubMed] |
| 15. | Ginath S, Menczer J, Friedmann Y, Aingorn H, Aviv A, Tajima K, Dantes A, Glezerman M, Vlodavsky I, Amsterdam A. Expression of heparanase, Mdm2, and erbB2 in ovarian cancer. Int J Oncol. 2001;18:1133-1144. [PubMed] |
| 16. | Xu X, Ding J, Dmowski WP. Heparanase-1 gene expression and regulation in the endometrium from women with and without endometriosis during different phases of the cycle. Fert Steri. 2004;82:S76. |
| 17. | Ding J, Xu X, Shen J, Braun DP, Rana N, Dmowski WP. Heparanase-1 expression in endometrium during menstrual cycle in healthy control women and in women with endometriosis. Fert Steri. 2002;78:S88. |
| 18. | Zong LL, Ma L, Wang XN, Zhang JH, He YL. Expression of heparanase gene in eutopic and ectopic endometrium of women with endometriosis. Zhonghua Fuchanke Zazhi. 2004;39:24-26. [PubMed] |