修回日期: 2005-02-28
接受日期: 2005-03-03
在线出版日期: 2005-04-15
目的: 在急性分离的胆管括约肌(sphincter of Oddi, SO)细胞上, 观察高胆固醇血症对SO细胞内钙振荡的影响变化及其机制.
方法: 新西兰雌兔24只随机分成两组: 对照组和高胆固醇血症模型组各12 只, 以fluo-4/AM荧光指示剂负载急性分离的SO细胞, 应用激光共聚焦扫描显微镜检测细胞钙振荡的变化.
结果: 高胆固醇血症组兔的SO细胞钙荧光强度振荡的幅度为6.11±3.1, 正常组兔为3.61±0.94. 当加入硝苯地平及EDTA后试验组钙荧光强度振荡幅度减小到2.24±0.72, 下降了64%. 当加入thapsigargin后, 模型组钙荧光强度振荡幅度减小到3.8±1.9, 下降了38%.
结论: 高胆固醇兔L-型电压依赖钙通道异常开放通过CICR途径所致SO细胞[Ca2+]I代谢紊乱是钙振荡物理学特征改变的分子生物学基础.
引文著录: 马克军, 魏经国, 王亚蓉, 张孝勇, 王春梅, 黄晓峰, 陈丹. 高胆固醇兔胆管括约肌细胞钙代谢与钙振荡变化关系. 世界华人消化杂志 2005; 13(8): 971-974
Revised: February 28, 2005
Accepted: March 3, 2005
Published online: April 15, 2005
AIM: To investigate the effect of hypercholesterolemia on calcium oscillation of acutely separated rabbit Oddi's sphincter muscle cells and to explore its mechanisms.
METHODS: Twenty-four New Zealand female rabbits were divided randomly into control group and HC group (12 rabbits each). Sphincter of Oddi's muscle cells were acutely isolated and cultured. The cells were loaded with Fluo-3/AM, and the changes in calcium oscillation were measured by laser scanning confocal microscopy.
RESULTS: Compared with the control group, the amplitude of the Ca2+ oscillation fluorescence intensity was significantly increased in the experimental group (6.11±3.1 vs 3.61±0.94, P<0.05). When treated with nifedipine and EDTA, Ca2+ oscillation amplitude in hypercholesterolemic group was decreased by 64% to 2.24±0.72. When treated with thapsigargin, it was decreased by 38% to 3.8±1.9.
CONCLUSION: Calcium metabolic disturbance in Oddi's sphincter muscle cells of hypercholesterolemic rabbits may be caused by the malfunctioned CICR pathway of L-type voltage-dependent calcium channels.
- Citation: Ma KJ, Wei JG, Wang YR, Zhang XY, Wang CM, Huang XF, Chen D. Relationship between calcium metabolism and calcium oscillation of Oddi's sphincter in hypercholesterolemic rabbits. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 971-974
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/971.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.971
Oddi括约肌(sphincter of Oddi, SO)的动力异常在胆系疾病的发生中起着重要的作用[1-8].高胆固醇(cholesterol, Ch)血症下SO动力受损[9], 表现为收缩幅度下降, 舒张不良, 呈痉挛样改变[10-11], 即 SO功能紊乱(sphincter of Oddi dysfunction, SOD)[12-14]. 进一步研究发现高Ch血症兔SO细胞[Ca2+]i呈超载状态. 这表明细胞内钙离子代谢紊乱与SOD有密切关系. 已知细胞[Ca2+]i浓度变化是钙振荡产生的物质基础, 但是有关细胞[Ca2+]I超载状态下钙振荡的物理学特征有无变化未见报道. 我们运用激光扫描共聚焦显微镜(laser scanning confocal microscopy, LSCM)观测细胞内钙振荡的变化, 探讨高Ch血症所致兔SO细胞内[Ca2+]I过载时 SO细胞内钙信号变化特征及其发生机制.
纯种新西兰雌兔24只, 2-3 mo, 体质量2.0-2.5 kg, 第四军医大学实验动物中心提供, 随机分为2组, 每组12只. 对照组给予标准饲料; 实验组给予标准饲料+Ch. Ch(上海化学试剂公司, 分析纯99.8%)每日1 g, 每周喂6 d, 停喂1 d, 共8 wk.高Ch血症模型判定标准[人类疾病的动物模型 1982: 120-129]: 兔血清总Ch浓度<3.0 mmol/L正常, >10 mmol/L达到高Ch血症标准. 实验开始前将血清总Ch >3.0 mmol/L兔剔除.2 g/LⅠ型胶原酶消化液: Ⅰ型胶原酶用200 ml/L小牛血清RPMI1640培养液溶解, pH 7.2, 过滤除菌. 小牛血清、RPMI1640、胶原酶Ⅰ型、硝苯吡啶(nifedipine Nif)、EGTA(美国Sigma 公司). Thapsigargin(Tha)、Fluo-3/AM(美国Molecular Probe). NaCl、KCl、NaHCO33、MgCl2、NaH2PO4、葡萄糖二甲基亚砜(DMSO)分析纯(西安化学试剂厂). LSCM为美国BioRad MRC-1024. 电子天平ACA-100 型(美国Denver 公司); 解剖显微镜PM-6型(日本Olympus 公司).
1.2.1 SO细胞培养及鉴定: 耳缘静脉注入空气约10 mL处死, 无菌分离SO段, 切除乳头部及近段, 刮除浆膜及结缔组织, 纵形切开SO段, 刮去黏膜组织, 培养液冲洗2次. 剪成约1-2 mm3左右小块, 移入无菌容器, 加入3-5倍1 g/LⅠ型胶原酶溶液, 37℃消化约10 h, 见组织块变小至几乎看不见, 原澄清液变混悬液, 获得大量梭形平滑肌细胞(smooth muscle cell, SMC)后终止消化. 常规法用200 mL/L小牛血清RPMI1640培养液, 制成细胞悬液. 将消化细胞接种在无菌盖玻片(18 mm×18 mm)上, 置于50 mL/L CO2 孵箱内约24 h, 待细胞黏附后取出. PBS液冲洗5 min, 950 mL/L的酒精固定30 min, 再用PBS 冲洗5 min, 晾干, 留做免疫组化染色.α-actin染色, 用Elivision 二步法免疫组化试剂盒.
1.2.2 激光扫描共聚焦显微镜观察: 将丹麦产50 mm塑料细胞培养平皿正中打一直径10 mm圆形孔洞, 用22 mm2盖玻片从外部封严, 消毒, 制备测试平皿. 将细胞悬液按常规方法接种到平皿盖玻片上, 置50 mL/L CO2恒温孵箱, 37℃静置培养1-2 d, 待SO细胞黏附. 用二甲基亚砜(DMSO)溶解fluo-3/AM, 浓度885 μmol/L, D-Hanks液稀释至fluo-3/AM终浓度为8.5 μmol/L, 制备fluo-3/AM负载液. 将细胞培养液弃去, PBS液冲洗10 min, 在平皿中央孔内加入fluo-3/AM负载液约70 μL, 37℃孵箱负载30 min, PBS液漂洗10 min. 应用Compaq Pentium 90计算机, 围绕单个SMC行X、Y轴扫描, 测量胞内fluo-3/AM荧光强度, 同时在细胞外作背景钙测量. 图像采集物镜镜头为Plan Neoflur 40×油浸镜头, 数值孔径(Numerical Aperture)1.2, 采样速率12帧/min, 像素矩阵512×512, 激发波长506 nm, 发射荧光波长526 nm. 每个标本随机选取8个细胞, 连续观察10 min, 记录细胞内钙离子浓度动态变化.
统计学处理 数据以mean±SD表示, 进行t检验, P<0.05为差异显著.
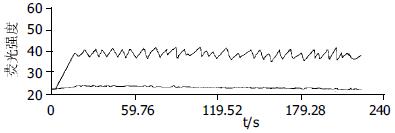
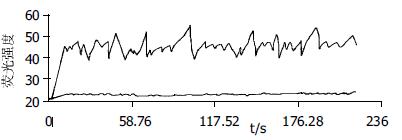
对照组共测量12只动物96个细胞, 正常兔SO细胞存在小幅度钙振荡, 细胞基础钙荧光强度为36.4±6.2. 细胞钙荧光强度振荡幅度为3.61±0.94, 频率为6次/min±2次/min(图1).高胆固醇血症组兔SO细胞测量12只动物, 每只动物随机测量8个细胞. 细胞基础钙荧光强度为44.3±2.05. 在测量的96个细胞中, 75个细胞钙振荡发生了改变, 占总数的78%. 与正常组相比较, 表现为钙荧光强度振荡的幅度增大, 为6.11±3.1, 波形表现为尖峰型(P<0.05), 振幅大小不均, 频率为9次/min±2.1次/min(图2). 另外21个细胞钙振荡没有变化, 占总数的22%, 表现与正常细胞的钙振荡波形相仿.
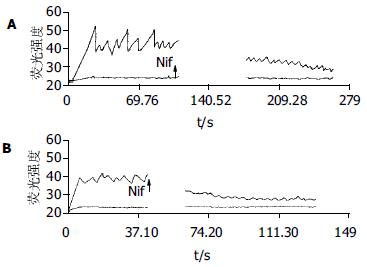
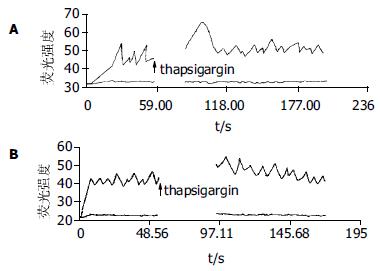
对实验组钙振荡发生改变的细胞以2 mmol/L EGTA螯合细胞外液的钙, 并加入硝苯地平(10-5 mol/L)后高耸的钙振荡的幅度变小, 由6.11±3.1降低到2.24±0.72, 下降了64%. 基础钙荧光强度降到35以下.频率由9次/min±2.1次/min下降到6次/min±1.3次/min(图3A). 对照组同样以2 mmol/L EGTA螯合细胞外液的钙, 并加入硝苯地平(10-5 mol/L), 发现基础钙荧光强度降到30以下, 钙振荡波近乎消失(图3B). 试验组未加入EDTA仅加入thapsigargin(10-7mol/L)作用细胞, 耗竭细胞内钙库, 细胞[Ca2+]I基础水平升高, 钙振荡幅度下降到3.8±1.9, 下降了38%(图4A). 对照组同样仅加入thapsigargin(10-7 mol/L)作用细胞后, 亦表现为基础钙浓度的升高. 但是钙振荡的幅度为3.56±0.74, 与加药前相比未见明显变化(P<0.05, 图4B).
对照组未加任何干扰因素时, SO细胞的[Ca2+]I荧光强度为36.4±6.2. 细胞钙荧光强度振荡幅度为3.61±0.94, 频率为6次/min±2次/min(图1)当基础钙荧光强度降到30以下, 钙振荡波近乎消失(图3B); 试验组未加干扰因素时, 基础钙荧光强度为44.3±2.05, 振荡的幅度6.11±3.1, 频率为9次/min±2.1次/min(图2), 当基础钙荧光强度降到35以下, 钙振荡的幅度降低到2.24±0.72(图3A). 钙振荡的物理特征与SO细胞[Ca2+]I浓度变化呈正相关(γ = 0.847), 当细胞[Ca2+]I荧光强度在40以上时, 钙振荡的物理学特征发生明显异常(图2).
平滑肌的收缩和舒张有赖于平滑肌细胞内[Ca2+]i的升高和降低, 当肌质中[Ca2+]i增加, 激活CaM, Ca2· CaM继而与肌球蛋白轻链激酶结合为二元体而使其活化, 平滑肌细胞收缩. 当[Ca2+]i浓度的下降后, CaM失活, 平滑肌细胞舒张. 可见平滑肌组织运动相互协调一致、舒缩有序的功能的调节有赖于钙信号的传递. 钙振荡(calcium oscillation)作为细胞内钙信号的一种表现方式[15-17], 是指细胞内[Ca2+]i变化呈周期性波动性升降. 以编码形式反映细胞内[Ca2+]i变化的钙振荡, 可以在细胞间传播[18]. 已经证实平滑肌钙振荡与平滑肌的周期性舒缩密切相关[19], 是胃肠道平滑肌产生有节律的活动的重要的调节信使[20]. 同样血管平滑肌钙振荡也影响血管舒张和收缩, 调节血流和阻力[21]. 上述研究提示细胞钙振荡是调节平滑肌运动功能重要的信号转导机制之一. 本实验证实, 兔SO细胞也存在有钙振荡现象, 钙振荡的物理学特征与细胞[Ca2+]i基础浓度有关. 无论对照组还是试验组钙振荡的波幅都随SO细胞[Ca2+]i浓度的变化而变化, 且其波动幅度与细胞[Ca2+]i浓度正相关. 伴随SO细胞[Ca2+]i浓度的下降, 试验组钙振荡波幅不仅降低, 而且振荡频率也减慢. 正常组SO细胞的[Ca2+]i浓度在荧光强度35左右时, 钙振荡波幅呈周期样变化, 表现为在较为恒定的[Ca2+]i基础上产生规律波动的曲线. 而试验组细胞[Ca2+]i基础钙荧光强度大于40, 其钙振荡则呈现为不规律的高大波幅的波形. 值得注意的是试验组SO细胞[Ca2+]i 基础水平升高, 钙振荡的幅度比正常组的幅度增大, 波形大小不一. 鉴于钙振荡是以编码形式传递细胞钙信号的主要形式, 本组试验结果似提示, 试验组SO细胞内钙振荡所传递的细胞功能的调节信息必然也是紊乱且不规则. 试验组SO细胞内钙振荡波幅的极不规律性与SO功能紊乱的压力曲线十分相似[10]. 以上变化显然与高胆固醇血症兔SO细胞[Ca2+]i基础水平异常增高密切相关, SO细胞内钙基础水平升高, 钙振荡的幅度增大, 这可能是SO细胞处于易激惹状态的基础[22]. 但是随着细胞[Ca2+]I 超载状态的改善, 钙振荡物理特征可恢复正常, 因此从钙信号调控角度分析似乎提示高CH兔SOD是一种可逆性的功能性疾病.
正常细胞钙离子代谢主要通过胞膜L-型电压依赖型钙通道完成, 细胞膜处于去极化状态L-型钙通道则开放, 细胞外Ca2+内流, 并由此通过"钙诱导的钙释放"途径使肌浆网内的Ca2+进入胞质, 细胞[Ca2+]i浓度迅即升高. 当细胞[Ca2+]i上升到一定的阈值, 细胞质膜Kca通道激活, 细胞内[K+]i外流致膜电位处于超极化状态, L-型钙通道失活而关闭, 细胞内钙离子被钙泵泵出胞外和泵入钙库内, 细胞[Ca2+]i浓度下降, 进而产生钙振荡. 但不同组织的平滑肌细胞钙振荡的发生机制并不尽相同. Nakayama et al[20]研究发现, 胃肠道平滑肌的钙振荡是由细胞内钙释放和外钙内流共同作用产生的, Kannan et al[23]发现气管平滑肌细胞的乙酰胆碱诱发的钙振荡中内质网通过RyR通道释放钙起关键作用. Satoh et al[24]研究发现钙振荡的幅度在于L型钙通道的活性, 通过钙内流增加调节钙振荡. 本研究显示, 当正常组细胞外液内的钙离子去除后, 同时应用钙通道阻断剂, 随着细胞内钙浓度的下降钙振荡消失; 当正常组细胞外液中仅加入thapsigargin, 阻断内质网钙泵, 耗竭钙库, 细胞内基础钙浓度升高, 钙振荡幅度没有明显变化. 当试验组细胞外液中的钙离子去除后, 同时应用钙通道阻断剂, 结果显示高胆固醇血症兔SO细胞的钙振荡的幅度随着基础钙浓度的下降而降低了64%. 当细胞外液中仅加入thapsigargin, 阻断内质网钙泵, 耗竭钙库后, 钙振荡的幅度也有减低, 仅为38%. 由此可知, 高胆固醇血症使细胞膜上Kca通道的功能发生异常改变[25-27], 经L-型Ca2+通道Ca2+内流增加, 使细胞钙代谢失衡, 通过CICR途径过度激发细胞内钙库钙释放, 破坏[Ca2+]i稳态[28-29], 致使SO细胞钙振荡物理特征发生变化, 成为导致SOD的发生的钙信号调节失衡的分子生物学基础.
编辑: 张海宁 电编: 潘伯荣
| 1. | Wei JG, Du F, Wang YC, Wang W. An experimental study of hypercholesterolemia-induced disorder of Oddi's sphincter. Chin J Pathophysiol. 2000;16:446-450. |
| 3. | Sari R, Palvolgyi A, Rakonczay Z Jr, Takacs T, Lonovics J, Czako L, Szilvassy Z, Hegyi P. Ethanol inhibits the motility of rabbit sphincter of Oddi in vitro. World J Gastroenterol. 2004;10:3470-3474. [PubMed] |
| 4. | Li GC, Yuan CH, Cheng Y, Liu YF. Oddi sphincter function after canine auto-pancreas transplantation with bladder drainage. World J Gastroenterol. 2003;9:2849-2852. [PubMed] |
| 6. | Lai KH. Sphincter of Oddi and acute pancreatitis: a new treatment option. J Pancreas (online). 2002;3:83-85. [PubMed] |
| 7. | Lai KH, Lo GH, Cheng JS, Fu MT, Wang EM, Chan HH, Wang YY, Hsu PI, Lin CK. Effect of somatostatin on the sphincter of Oddi in patients with acute non-biliary pancreatitis. Gut. 2001;49:843-846. [PubMed] |
| 8. | Velosy B, Madacsy L, Szepes A, Pavics L, Csernay L, Lonovics J. The effects of somatostatin and octreotide on the human sphincter of Oddi. Eur J Gastroenterol Hepatol. 1999;11:897-901. [PubMed] |
| 9. | Wang XJ, Wei JG, Wang CM, Wang YC, Wu QZ, Xu JK, Yang XX. Effect of cholesterol liposomes on calcium mobilization in muscle cells from the rabbit sphincter of Oddi. World J Gastroenterol. 2002;8:144-149. [PubMed] |
| 11. | Fleischhacker E, Esenabhalu VE, Holzmann S, Skrabal F, Koidl B, Kostner GM, Graier WF. In human hypercholes-terolemia increased reactivity of vascular smooth muscle cells is due to altered subcellular Ca(2+) distribution. Atherosclerosis. 2000;149:33-42. [PubMed] |
| 12. | Wei JG, Wang YC, Du F, Yu HJ. Dynamic and ultrastructural study of sphincter of Oddi in early-stage cholelithiasis in rabbits with hypercholesterolemia. World J Gastroenterol. 2000;6:102-106. [PubMed] |
| 13. | Menees S, Elta GH. Sphincter of oddi dysfunction. Curr Treat Options Gastroenterol. 2005;8:109-115. [PubMed] |
| 14. | Zou D, Xu G, Sun Z, Li Z, Yin N. Endoscopic manometry in the diagnosis of sphincter of oddi dysfunction. China Natl J New Gastroenterol. 1996;2:145-146. |
| 15. | Weissberg PL, Little PJ, Bobik A. Spontaneous oscillations in cytoplasmic calcium concentration in vascular smooth muscle. Am J Physiol. 1989;256:C951-C957. [PubMed] |
| 16. | Lee CH, Poburko D, Kuo KH, Seow CY, van Breemen C. Ca2+ oscillations, gradients, and homeostasis in vascular smooth muscle. Am J Physiol Heart Circ Physiol. 2002;282:H1571-H1583. [PubMed] |
| 17. | Savineau JP, Marthan R. Cytosolic calcium oscillations in smooth muscle cells. News Physiol Sci. 2000;15:50-55. [PubMed] |
| 18. | Wilde DW, Massey KD, Walker GK, Vollmer A, Grekin RJ. High-fat diet elevates blood pressure and cerebrovascular muscle Ca2+ current. Hypertension. 2000;35:832-837. [PubMed] |
| 19. | Himpens B, Matthijs G, Somlyo AV, Butler TM, Somlyo AP. Cytoplasmic free calcium, myosin light chain phosphorylation, and force in phasic and tonic smooth muscle. J Gen Physiol. 1988;92:713-729. [PubMed] |
| 20. | Nakayama S, Ohya S, Imaizumi Y. Investigation into gastrointestinal pacemaker mechanism using cultured cell cluster preparation. Nippon Yakurigaku Zasshi. 2004;123:149-154. [PubMed] |
| 21. | Oishi H, Schuster A, Lamboley M, Stergiopulos N, Meister JJ, Beny JL. Role of membrane potential in vasomotion of isolated pressurized rat arteries. Life Sci. 2002;71:2239-2248. [PubMed] |
| 22. | 张 孝勇, 魏 经国, 马 进, 王 莎, 马 孝武, 马 克军, 王 亚蓉. 高胆固醇血症兔Oddi括约肌张力的变化机制. 世界华人消化杂志. 2004;12:1114-1118. [DOI] |
| 23. | Kannan MS, Prakash YS, Brenner T, Mickelson JR, Sieck GC. Role of ryanodine receptor channels in Ca2+ oscillations of porcine tracheal smooth muscle. Am J Physiol. 1997;272:L659-664. [PubMed] |
| 24. | Satoh M, Takayanagi I, Koike K. Characteristics of Ca2+ oscillations in ileal longitudinal muscle cells of guinea pig. Jpn J Pharmacol. 2000;82:317-325. [PubMed] |
| 25. | Amberg GC, Santana LF. Downregulation of the BK channel betal subunit in genetic hypertension. Circ Res. 2003;93:965-971. [PubMed] |
| 26. | Wang YW, Ding JP, Xia XM, Lingle CJ. Consequences of the stoichiometry of slo1 and auxiliary b subunits on functional properties of large-conductance Ca2+-activated K+ channels. J Neurosci. 2002;22:1550-1561. [PubMed] |
| 27. | Clarke AL, Petrou S, Walsh JV Jr, Singer JJ. Modulation of BK (Ca) channel activity by fatty acids: structural requiments and mechanism of action. Am J Physiol Cell Physiol. 2002;283:C1441-1453. [PubMed] |
| 28. | Babiychuk EB, Smith RD, Burdyga T, Babiychuk VS, Wray S, Draeger A. Membrane cholesterol regulates smooth muscle phasic contraction. J Membr Biol. 2004;198:95-101. [PubMed] |
| 29. | Tulenko TN, Sumner AE, Chen M, Huang Y, Laury-Kleintop L, Ferdinand FD. The smooth muscle cell membrane during atherogenesis: a potential target for amlodipine in atheroprotection. Am Heart J. 2001;141:S1-11. [PubMed] |