修回日期: 2005-03-01
接受日期: 2005-03-10
在线出版日期: 2005-04-15
目的: 探讨慢性丙型肝炎患者外周血单个核细胞(PBMCs)干扰素-α/β受体(IFNAR2)mRNA的表达, 及其与干扰素(IFN)抗病毒疗效的关系.
方法: 密度梯度离心法分离26例慢性丙型肝炎患者PBMCs, RT-PCR法扩增IFNAR2 mRNA, 计算其表达水平.
结果: 慢性丙型肝炎患者PBMCs IFNAR2 mRNA表达显著高于健康对照者; 其表达与血清病毒载量、病毒基因型及PBMCs HCV-RNA无关; 干扰素治疗完全应答组PBMCs IFNAR2 mRNA表达显著高于部分应答及无应答组.
结论: PBMCs IFNAR2 mRNA表达与干扰素疗效相关, 可作为一个独立因素, 用于预测慢性丙型肝炎患者干扰素疗效.
引文著录: 刘宁, 李颖, 刘沛. 慢性丙型肝炎患者外周血单个核细胞IFNAR2 mRNA的表达. 世界华人消化杂志 2005; 13(8): 1023-1026
Revised: March 1, 2005
Accepted: March 10, 2005
Published online: April 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 1023-1026
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/1023.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.1023
干扰素(IFN)是目前用于慢性丙型肝炎抗病毒治疗的首选药物, 能抑制病毒复制, 降低血清ALT水平, 减轻肝组织炎症及纤维化程度[1-2]. 但IFN治疗慢性丙型肝炎的有效率仅为30%-50%, 且有一定副作用. 因此, 临床上选择能预测IFN疗效的指标极为重要. 已有报道HCV感染者肝组织内有Ⅰ型干扰素受体的表达, 且其表达水平与干扰素疗效呈正相关[3-6]. 同时, 慢性丙型肝炎患者肝组织与外周血单个核细胞(PBMCs)中IFNAR2 mRNA的表达情况呈正相关[7]. 我们应用RT-PCR方法检测了26例慢性丙型肝炎患者PBMCs IFNAR2 mRNA的表达, 进一步分析了IFNAR2 mRNA表达与干扰素疗效的关系.
26例慢性丙型肝炎患者, 年龄11-60岁(平均43.5), 男20例, 女6例. 治疗前丙氨酸转氨酶(ALT)为正常值的1.5倍以上, 血清抗-HCV阳性, HCV RNA阳性, 无同性恋者、静脉药瘾者, 无甲、乙、丁、戊型肝炎病毒及HIV感染标志者、无抗核抗体阳性者, 排除近3 mo应用糖皮质激素、干扰素等影响免疫功能药物者. 诊断符合2000-09中华医学会传染病与寄生虫学分会、肝病学分会联合修订的病毒性肝炎防治方案[8]. 另取15名无肝炎病毒感染的健康志愿者做正常对照. 所有患者接受IFNβ-1 a治疗, 用法为44 mg隔日皮下注射, 疗程为24 wk. 治疗结束时血清ALT正常, HCV RNA阴性者为完全应答(CR); 血清ALT正常, 而HCV RNA阳性者为部分应答(PR); 血清ALT未降至正常, HCV-RNA阳性者为无应答(NR). Trizol RNA提取试剂(美国Gibcobrl公司); AMV Reverse Transcriptase(美国Promega公司); Taq DNA聚合酶、RNA酶抑制剂、PCR应用试剂及丙肝病毒PCR检测试剂盒(华美生物工程公司).
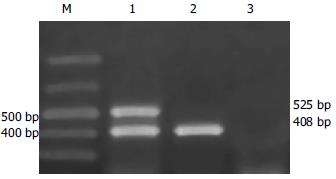
1.2.1 引物: 引物设计参照文献[9], 序列如下: IFNAR2 mRNA: 上游引物: 5'-GCTTTTGAGCCAGAATGCCT -3'(nt329-348); 下游引物: 5'-CCCTCTGACTGTTCTTCAATG-3'(nt833-853). 产物预测长度525 bp; G3PDH mRNA: 上游引物: 5'-ATTCAAGGCACCGTCAAGG -3'(nt166-185); 下游引物: 5'-GGGCCATCGATAGTCTTCTG-3'(nt554-573). 产物预测长度408 bp.
1.2.2 PBMCs I FNAR2 mRNA检测: 采4 mL肝素抗凝血, 密度梯度离心法分离PBMCs, -70℃保存. Trizol RNA提取试剂提取总RNA, -30℃保存备用. RT-PCR方法检测IFNAR2 mRNA表达, 以G3PDH mRNA表达作为内参照.30 μL反应体系包括: 10×Buffer 3 μL(500 mmol/L KCl、100 mmol/L Tris-HCl(pH 9.0)、1.0% Triton X-100、15 mmol/L MgCl2), 各0.2 μmol/L 3-磷酸脱氧核苷(dNTP), AMV Reverse Transcriptase 3 U, Taq DNA聚合酶 2 U, RNA酶抑制剂20 U, 上、下游引物各1 μL(20 pmol/l), RNA模板3 μL. 反应条件: 37℃逆转录30 min, 94℃预变性5 min, 94℃变性45 s, 56℃退火45 s, 72℃延伸60 s, 35个循环, 72℃末延伸7 min. 将PCR扩增产物置于20 g/L琼脂糖凝胶电泳, 结果置于凝胶成像分析系统上分析.408 bp条带为G3PDH mRNA扩增产物, 525 bp条带为IFNAR2 mRNA扩增产物. IFNAR2 mRNA表达水平 = IFNAR2 mRNA光强度值/各自G3PDH mRNA光强度值.
1.2.3 PBMCs H CV-RNA检测: 总RNA同时进行HCR-RNA的检测. 检测方法按照丙肝病毒PCR检测试剂盒说明书中的操作步骤进行.
1.2.4 HCV-RNA定量及HCV基因分型检测: 采患者治疗前血清100 μL, 分别用于HCV RNA定量及HCV基因分型的检测. HCV RNA定量应用Bayer HCV kits; HCV基因分型应用Bayer Lipa assay.
统计学处理 应用SPSS软件. 应用2检验、方差分析、Pearson相关分析和多因素Logistic回归分析进行统计分析.
IFNAR2 mRNA结果(图1)26例慢性丙型肝炎患者中, PBMCs IFNAR2 mRNA阳性者25例(96.2%); 15例对照组中PBMCs IFNAR2 mRNA阳性者5例(33.3%), 丙型肝炎组阳性率显著高于对照组.26例患者中男性、女性PBMCs IFNAR2 mRNA表达值分别为0.7 979±0.3 763、0.8 575±0.2 405, 无显著性差异.
HCV RNA 26例慢性丙型肝炎患者中PBMCs HCV RNA阳性者21例, 阴性者5例, IFNAR2 mRNA表达值分别为0.784 804±0.2 934、0.8 572±0.2 142, 无显著性差异.
血清HCV-RNA载量取自然对数, 与PBMCs IFNAR2 mRNA表达值进行相关性分析, 结果是二者间无显著相关性(r = 0.133, P = 0.637). 根据对干扰素疗效的不同影响, 将慢性丙型肝炎患者分为1型基因型组14例与非1型基因型组12例, 其IFNAR2 mRNA表达值分别为0.8 049±0.1 999、0.7 799±0.1 896, 无显著性差异.
治疗结束时完全应答(CR)者10例, PBMCs IFNAR2 mRNA表达值为1.0 624±0.1 633; 部分应答(PR)者7例, 表达值为0.7 977±0.1 549; 非应答(NR)者9例, 表达值为0.6 055±0.2 581. 完全应答组PBMCs IFNAR2 mRNA表达值显著高于部分应答组和非应答组(P<0.05), 而部分应答组和非应答组表达值无显著性差异(P = 0.069).
HCV RNA及PBMCs IFNAR2 mRNA表达值4项因素与IFN疗效间进行Logistic回归分析, 结果显示PBMCs IFNAR2 mRNA表达值对疗效影响较大, 可视为一个独立预测因素.
干扰素受体可分为Ⅰ型受体和Ⅱ型受体.Ⅰ型受体包括IFN-α、IFN-β和IFN-ω受体; Ⅱ型受体是指IFN-γ受体. 临床上常用IFN-α和IFN-β治疗慢性丙型肝炎, Ⅰ型干扰素受体是IFN-α和IFN-β共用受体[10], 至少由两个亚单位组成, IFNAR1(IFN-α受体)和IFNAR2(IFN-α/β受体), 其结构和机能已经很明确了[11-12]. 就IFNAR1和/或IFNAR2 mRNA在肝脏中的表达情况, 很多学者进行了临床试验研究, 结果显示IFNAR1和/或IFNAR2 mRNA的表达与患者临床表现及病毒基因分型无关, 而与IFN治疗疗效相关. 但人们对肝组织外干扰素受体的表达还知之甚少, 哪些细胞或组织中干扰素受体的表达与肝组织一致, 可以代替肝活检用以推测肝组织内干扰素受体的表达情况呢?PBMCs首先引起了人们的注意, 因为PBMCs是丙型肝炎病毒肝外增殖的重要部位. 已有研究表明慢性丙型肝炎患者肝组织与PBMCs IFNAR2 mRNA的表达情况正相关, 我们进一步证实了PBMCs IFNAR2 mRNA表达与IFN疗效的关系.
本组26例慢性丙型肝炎患者PBMCs IFNAR2 mRNA的表达水平明显高于正常人. Yatsuhashi et al[13]在同时检测急性甲型肝炎、慢性乙型肝炎及非病毒性肝病(脂肪肝)患者肝组织内IFNAR2 mRNA表达时, 发现肝炎病毒感染均能上调IFNAR2基因在肝组织内的表达, 这种上调可以解释为机体对病毒感染的一种反应, 参与机体清除病毒的免疫应答: 机体通过上调IFNAR2 mRNA的表达来提高与内源性或外源性IFN的结合, 从而加强对病毒的清除. PBMCs是丙型肝炎病毒肝外复制的一个重要场所, 故推测HCV感染也能够上调IFNAR2 mRNA在PBMCs内的表达, 与我们的研究结果一致. PBMCs中IFNAR2 mRNA表达增加的机制尚不十分清楚, 可能与某些细胞因子有关. 慢性肝炎患者血清中IFN-γ水平上升[14], 有报告IFN-γ能够调节IFN受体的表达[15]. 本组PBMCs HCV-RNA定性"+"及"-"者, IFNAR2 mRNA表达值无显著性差异, 提示IFNAR2 mRNA的表达与PBMCs HCV-RNA无关, 其表达情况可能不依赖于PBMCs中是否有HCV的持续感染, 而受宿主自身的免疫状况的影响, 这与IFN抗病毒作用机制一致.
IFN分子本身并不具备抗病毒功能, 必须与细胞表面相应受体相结合, 并经过一系列细胞内信号传导, 最终产生抗病毒蛋白而发挥作用, 故与特异性受体相结合是IFN发挥抗病毒作用的第一步[16-17]. IFN发挥生物学效应与其靶细胞上特异性受体的水平有关. 我们检测了26例慢性丙型肝炎患者PBMCs IFNAR2 mRNA表达与IFN抗病毒疗效间的关系, 结果显示完全应答组表达值显著高于部分应答组和非应答组. 这说明IFN抗病毒疗效与PBMCs IFNAR2表达水平密切相关, IFN疗效差-不应答或不能完全应答, 可能与其受体表达不足有关, 进一步推测PBMCs IFNAR2 mRNA表达情况是影响IFN疗效的宿主方面因素. 丙型肝炎病毒基因型[18]及治疗前血清HCV RNA载量[19]是目前公认的影响IFN应答的病毒因素, 而PBMCs中HCV-RNA也被认为是IFN疗效的预测因子[20]. 本实验中, PBMCs IFNAR2 mRNA表达与治疗前血清病毒载量、病毒基因型及PBMCs HCV-RNA无关, 故可作为一个独立因素用于预测IFN的疗效. Logistic回归分析进一步证明了这一结论.
编辑: 张海宁
| 1. | Davis GL, Balart LA, Schiff ER, Lindsay K, Bodenheimer HC Jr, Perrillo RP, Carey W, Jacobson IM, Payne J, Dienstag JL. Treatment of chronic hepatitis C with recombinant interferon alfa. A multicenter randomized, controlled trial. Hepatitis Interventional Therapy Group. N Engl J Med. 1989;321:1501-1506. [PubMed] |
| 2. | Di Bisceglie AM, Martin P, Kassianides C, Lisker-Melman M, Murray L, Waggoner J, Goodman Z, Banks SM, Hoofnagle JH. Recombinant interferon alpha therapy for chronic hepatitis C: a randomized double-blind, placebo-controlled trial. N Engl J Med. 1989;321:1506-1510. [PubMed] |
| 3. | Fukuda R, Ishimura N, Kushiyama Y, Moriyama N, Ishihara S, Nagasawa S, Miyake T, Niigaki M, Satoh S, Sakai S. Effectiveness of interferon-alpha therapy in chronic hepatitis C is associated with the amount of interferon-alpha receptor mRNA in the liver. J Hepatol. 1997;26:455-461. [PubMed] |
| 4. | Mathai J, Shimoda K, Banner BF, Mori M, Bonkovsky HL, Barnard GF. IFN-a receptor mRNA expression in a United States sample with predominantly genotype 1a/I chronic hepatitis C liver biopsies correlates with response to IFN therapy. J Interferon Cytokine Res. 1999;19:1011-1018. [PubMed] |
| 5. | Mizukoshi E, Kaneko S, Yanagi M, Ohno H, Kaji K, Terasaki S, Shimoda A, Matsushita E, Kobayashi K. Expression of interferon alpha/beta receptor in the liver of chronic hepatitis C patients. J Med Virol. 1998;56:217-223. [PubMed] |
| 6. | Ishimura N, Fukuda R, Fumoto S. Relationship between the intrahepatic expression of interferon-a receptor mRNA and the histological progress of hepatitis C virus-associated chronic liver diseases. J Gastroenterol Hepatol. 1996;11:712-717. [PubMed] |
| 7. | Yamaguchi Y, Hino K, Fujiwara D, Ren F, Katoh Y, Satoh Y, Okita K. Expression of type 1 interferon receptor in liver and peripheral blood mononuclear cells in chronic hepatitis C patients. Dig Dis Sci. 2002;47:1611-1617. [PubMed] |
| 9. | Morita K, Tananka K, Saito S, Kitamura T, Kondo M, Sakaguchi T, Morimoto M, Sekihara H. Expression of interferon receptor genes (IFNAR1 and IFNAR2 mRNA) in the liver may predict outcome after interferon thetapy in patients with chronic genotype 2a or 2b hepatitis C virus infection. J Clin Gastroenterol. 1998;26:135-140. [PubMed] |
| 10. | Pestka S. The interferon receptor. Semin Oncol. 1997;24:s9-18. [PubMed] |
| 11. | Uze G, Lutfalla G, Gresser I. Genetic transfer of a functional human interferon alpha receptor into mouse cells: cloning and expression of its cDNA. Cell. 1990;60:225-234. [PubMed] |
| 12. | Novic D, Cohen B, Rubinstein M. The human interferon a/b receptor: characterization and molecular cloning. Cell. 1994;77:391-400. [PubMed] |
| 13. | Yatsuhashi H, Fujino T, Matsumoto T, Inoue O, Koga M, Yano M. Immunohistochemical analysis of hepatic interferon alphs-beta receptor level: relationship between receptor expression and response to interferon therapy in patients with chronic hepatitis C. J Hepatology. 1999;30:995-1003. [PubMed] |
| 14. | Chu CM, Sheen IS, Yeh CT, Hsieh SY, Tsai SL, Liaw YF. Serum levels of interferon-alpha and -gamma in acute and chronic hepatitis B virus infection. Dig Dis Sci. 1995;40:2107-2112. [PubMed] |
| 15. | Cacciarelli TV, Martinez OM, Gish RG, Villanueva JC, Krams SM. Immunoregulatory cytokines in chronic hepatitis C virus infection: Pre- and posttreatment with interferon alfa. Hepatology. 1996;24:6-9. [PubMed] |
| 16. | Cohen B, Novick D, Barak S, Rubinstein M. Ligand-Induced association of type I interferon receptor components. Mol Cell Biol. 1995;15:4208-4214. [PubMed] |
| 17. | Domanski P, Witte M, Kellum M, Rubinstien M, Hackett R, Pitha P, Colamonici OR. Cloning and expression of a long form of the β subunit of the interferonα/β receptor that is required for signaling. J Biol Chem. 1995;270:21606-21611. [PubMed] |
| 18. | Tsubota A, Chayama K, Ikeda K, Yasuji A, Koida I, Saitoh S, Hashimoto M, Iwasaki S, Kobayashi M, Hiromitsu K. Factors predictive of response to interferon-alpha therapy in hepatitis C virus infection. Hepatology. 1994;19:1088-1094. [PubMed] |