修回日期: 2005-02-28
接受日期: 2005-04-01
在线出版日期: 2005-04-15
目的: 研究人干扰素-α对人肝癌细胞系BEL-7402细胞增殖及侵袭的抑制作用.
方法: 常规培养的BEL-7402细胞加入人干扰素-α(1×106U/L)共同孵育24 h后, 以MTT法检测干扰素-α对肿瘤细胞增殖的影响; Boyden小室法检测肝癌细胞侵袭能力的变化; 明胶酶谱法检测肝癌细胞基质金属蛋白酶的变化. 免疫组化法检测肿瘤细胞增殖核抗原的表达; TUNEL法检测肿瘤细胞的凋亡.
结果: 人干扰素-α可以明显抑制体外BEL-7402细胞的增殖(抑制率为20.2%); 干扰素-α作用后在Boyden 小室穿膜的肿瘤细胞数明显减少(抑制率为23.9%); 肝癌细胞基质金属蛋白酶的分泌没有明显变化. 干扰素-α组肿瘤细胞增殖核抗原的表达明显下降, 凋亡细胞数明显增加.
结论: 低剂量的干扰素-α可以直接抑制肝癌细胞株BEL-7402的增殖, 对BEL-7402细胞的侵袭有明显的抑制作用; 可以抑制肿瘤细胞增殖核抗原的表达并诱导细胞凋亡.
引文著录: 乔世峰, 王季堃. 干扰素-α对人肝癌细胞增殖及侵袭的抑制作用. 世界华人消化杂志 2005; 13(8): 1021-1023
Revised: February 28, 2005
Accepted: April 1, 2005
Published online: April 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 1021-1023
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/1021.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.1021
干扰素(interferon, IFN)是一类具有抗病毒、抗增殖及免疫调节作用的细胞因子. 根据IFN产生的来源、理化性质及结构的不同分为I、II型干扰素. I型干扰素包括干扰素-α、α和ω, 他们共用相同的细胞表面受体, I型干扰素之间分子的同源性很高, 但抗原性完全不同. 自干扰素被发现以来, 大量的临床研究表明, 干扰素对抗病毒性疾病和恶性肿瘤以及增强机体免疫调节能力有明显效果, 作为一种肿瘤的治疗佐剂国内外已有相关报道[1-2]. 肝细胞癌是一种严重威胁人类健康的恶性肿瘤, 而干扰素-α对实验性大鼠肝癌及临床在肝细胞癌根治性切除术后的转移复发有抑制作用[3-4], 但干扰素抗肿瘤的机制还不十分清楚. 我们利用人肝癌细胞株BEL-7402研究干扰素-α对肝癌细胞的增殖及侵袭的影响, 并初步探讨了其抗肿瘤的机制, 为干扰素-α对于肝癌的临床治疗应用提供理论和实验依据.
人肝癌细胞株BEL-7402购自北京大学肿瘤研究所; 干扰素-α2β购自北京远策药业有限责任公司; Boyden小室及人工基膜(Matrigel)由北京大学医学部细胞学系提供; 细胞增殖核抗原(PCNA)免疫组化试剂盒购自北京中山生物技术有限公司; TUNEL凋亡检测试剂盒(美国Promega公司).
1.2.1 细胞培养及处理: BEL-7402细胞经消化后计数, 以1.5×108/L接种96孔板, 每孔200 μL, 50 mL/L小牛血清的RPMI-1640培养基, 实验组加入IFN-α 106U/L, 对照组加入相同体积的PBS, 50 mL/L CO2、37℃孵箱中培养24 h.
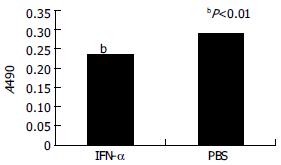
1.2.2 MTT法检测BEL-7402细胞的增殖: 培养细胞加入MTT(5 g/L)50 μL/孔, 继续孵育4 h, 加入DMSO 100 μL/孔, 轻摇10 min后检测波长490 nm的吸光度, 每组设3复孔. 细胞增殖的抑制率按照以下公式计算: (1-IFN-α培养孔细胞上清的 A490/对照组培养孔细胞上清的A490)×100%
1.2.3 Boyden小室检测细胞侵袭实验: 参照Albini et al[5]的体外侵袭实验方法. 每张膜随机选取5个高倍视野, 计数穿过聚碳酸酯膜的细胞数, 每组细胞设3个复孔. 穿膜的肿瘤细胞数目多少作为评价肿瘤细胞迁徙、浸润能力强弱的指标.
1.2.4 明胶酶谱分析(zymography)正常传代培养的细胞: 以无血清培养液培养24 h后细胞计数并收集培养液, 离心取上清, PBS透析按细胞数调整体积后进行SDS-PAGE电泳, 其中分离胶含0.1%明胶, 将蛋白样品与2×zymography上样缓冲液(0.16 mol/L Tris-HCl(pH 6.8), 20 mL/L SDS, 80 mL/L甘油, 0.3 g/L溴酚蓝)等量混合后上样, 10 mA恒流电泳. 电泳结束后, 将胶置于2.5% Triton X-100液中室温摇动1 h, 将胶取出浸于酶孵育液(50 mmol/L Tris-HCl(pH 7.8), 150 mmol/L NaCl, 5 mmol/L CaCl2)中, 37℃摇18 h. 再将胶置于考马斯亮蓝染色液中摇动染色3 h; 脱色液I(300 mL/L甲醇, 100 mL/L冰乙酸)脱色至蓝色背景下的透明条带显出. 将胶浸泡于脱色液II(40 g/L甲醇, 50 mL/L冰乙酸)中, 拍照记录.
1.2.5 免疫细胞化学法检测BEL-7402细胞: 免疫细胞化学法检测BEL-7402细胞PCNA的表达参照文献[6]进行.
1.2.6 TUNEL法检测肿瘤组织细胞的凋亡: 具体实验步骤按说明书进行. 光镜下(×400)观察结果. 所见细胞核有棕黄色颗粒者为阳性细胞, 每个样品至少计数100个细胞中的阳性细胞数, 重复计数3次, 取平均值.
统计学处理 所有数值均以均数北曜疾(mean±SD)表示, 组间差异比较采用t检验. P<0.05为具有显著性差异, P<0.01为具有极显著性差异.
细胞增殖IFN-α组与PBS组比较BEL-7402细胞的增长明显受到抑制(P<0.01), 细胞生长的抑制率为20.2%(图1).
小室检测的细胞体外侵袭的结果表明, 作用24 h后IFN-α组BEL-7402细胞穿过Matrigel发生侵袭的细胞数分别为每高倍视野101.2±5.8个, PBS组为131.8±9.5个, 抑制率为23.9%, 二者比较有显著性差异(P<0.01, 图2).
经IFN-α作用后, BEL-7402细胞分泌的MMPs种类和数量都没有变化.
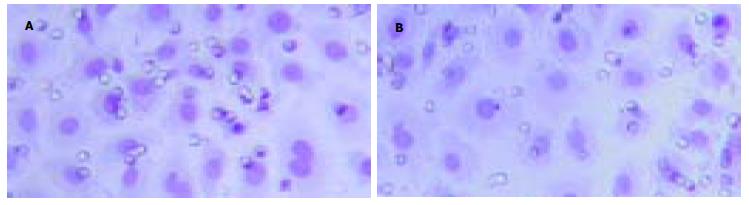
人肝癌细胞系BEL-7402细胞与PCNA单抗染色后, 阳性细胞染色为棕色, 染色部位在细胞核; 同一反应条件下IFN-α组PCNA染色与对照组比较显色明显减弱.
细胞核呈棕褐色着染者即为凋亡细胞, IFN-α组每100个细胞中阳性细胞数为19.53±3.18个, 对照组阳性细胞数为11.36±0.55, IFN-α组与对照组比较凋亡细胞明显增多(P<0.01).
IFN-α是一种糖蛋白, 属于I型干扰素, 具有抗病毒、抗肿瘤及免疫调节等多种生物学功能, 许多体内和体外试验都充分证明, IFN不仅可以抑制肿瘤病毒诱发的肿瘤的生长, 而且可以抑制移植性肿瘤和由化学致癌物诱发的肿瘤的生长, 已经被广泛应用在多种领域及多种疾病的治疗中[7]. 但IFN的抗肿瘤机制尚不十分清楚.
肝细胞肝癌是我国常见恶性肿瘤之一, 死亡率较高. 手术切除仍是首选的治疗方案, 但常有复发的危险. 有报道在肝细胞癌切除术后应用IFN-α治疗可以降低肝细胞癌的复发[4], 我们利用肝癌细胞系BEL-7402进行实验, 以不同剂量(105-107 U/L)的IFN-α2β进行增殖的抑制作用筛选, 发现低剂量IFN-α2β(5×105U/mL)既有抗肝癌细胞增殖的效果, IFN-α对BEL-7402细胞的增殖有明显的抑制作用, 也证明了IFN-α对肿瘤细胞可能有直接的抑制作用.
转移是引起癌症死亡的主要原因, 在研究IFN对肿瘤细胞转移作用的细胞侵袭实验中我们利用了Boyden chambers的实验模型, 结果发现IFN-α作用后BEL-7402细胞的侵袭能力明显受到抑制, 穿膜细胞数明显减少, 说明IFN-α可以抑制细胞对Matrigel胶的侵袭. 在转移的过程中, 肿瘤细胞的侵袭依赖于细胞的迁移和细胞外基质蛋白的水解. 基质金属蛋白酶(MMPs)是一种存在于人类许多组织并发挥重要功能的金属蛋白酶, 是降解细胞外基质的主要酶类, 为Zn2+依赖性内切酶, 参与了肿瘤转移过程中的多个步骤[8]. 通过明胶酶谱法检测MMPs的分泌发现, IFN-α作用的BEL-7402细胞培养上清中分泌MMPs的质和量都没有发生变化, 分析IFN-α在体外不能阻止BEL-7402细胞MMPs的分泌, IFN-α对细胞侵袭的抑制作用可能是通过其他渠道实现的.
增殖细胞核抗原(PCNA)是一种无种属和组织特异性的、广泛存在于增殖活跃细胞中的细胞周期蛋白[9]. 作为DNA聚合酶δ的辅助蛋白, PCNA直接参与DNA合成. 在细胞周期G1晚期开始增加, S期达高峰, G2期明显下降, 凡进入增殖周期的细胞均为阳性, 而处在G0/G1期细胞则基本不表达, 他可作为细胞增埴的一个指标[10], 肿瘤组织中PCNA阳性细胞数可反映肿瘤组织增殖的速度[11]. 我们的实验中IFN-α组BEL-7402细胞PCNA的表达明显低于对照组, 表明IFN-α可以影响BEL-7402细胞PCNA的表达, 其机制可能与肿瘤生长的抑制相关. 细胞凋亡(apoptosis)与肿瘤的关系仍是目前研究的热点. 我们应用TUNEL法检测发现, IFN-α可以明显使BEL-7402细胞凋亡的阳性细胞数量增加, 诱导肝癌细胞的凋亡. 细胞凋亡对肿瘤起着负调控作用[12], 肿瘤的发生发展不仅是由于细胞增殖速率升高, 而且与细胞死亡速率下降有关, 细胞凋亡对评估肿瘤预后有一定意义.
总之, IFN-α作为一种细胞因子, 他既可用于全身治疗, 也可用于局部治疗. 他的作用机制是非常复杂的, 而他的抗肿瘤作用是我们不能忽视的. 目前将各种干扰素、干扰素与其他抗肿瘤药物以及干扰素与其他抗癌疗法联合应用的联合疗法是目前的发展趋势.
编辑: 张海宁
| 1. | Kirkwood JM, Ibrahim JG, Sondak VK, Richards J, Flaherty LE, Ernstoff MS, Smith TJ, Rao U, Steele M, Blum RH. High-and low-dose interferon-alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol. 2000;18:2444-58. [PubMed] |
| 2. | Wakabayashi T, Hatano N, Kajita Y, Yoshida T, Mizuno M, Taniguchi K, Ohno T, Nagasaka T, Yoshida J. Initial and maintenance combination treatment with interferon-beta, MCNU (Ranimustine), and radiotherapy for patients with previously untreated malignant glioma. J Neurooncol. 2000;49:57-62. [PubMed] |
| 3. | 王 鲁, 汤 钊猷, 薛 琼, 孙 惠川, 陈 军, 高 冬梅, 赵 燕, 陈 洁, 孙 瑞霞, 刘 银坤. α干扰素对肝癌切除术后转移复发干预作用的实验研究. 中华肝脏病杂志. 2001;9:154-156. |
| 4. | Lin SM, Lin CJ, Hsu CW, Tai DI, Sheen IS, Lin DY, Liaw YF. Prospective randomized controlled study of interferon-alpha in preventing hepatocellular carcinoma recurrence after medical ablation therapy for primary tumors. Cancer. 2004;100:376-382. [PubMed] |
| 5. | Albini A, Iwamoto Y, Kleinman HK, Martin GR, Aaronson SA, Kozlowski JM, McEwan RN. A rapid in vitro assay for quantitating the invasive potential of tumor cells. Cancer Res. 1987;47:3239-3245. [PubMed] |
| 8. | Sternlicht MD, Werb Z. How matrix metalloproternases regulate cell behavior. Annu Rev Cell Dev Biol. 2001;17:463-516. [PubMed] |
| 9. | Pizem J, Marolt VF, Luzar B, Cor A. Proliferative and apoptotic activity in hepatocellular carcinoma and surrounding non neoplastic liver tissue. Pflugers Arch. 2001;442:R174-176. [PubMed] |
| 10. | Kim YH, Lee JH, Chun H, Nam SJ, Lee WY, Song SY, Kwon OJ, Hyun JG, Sung IK, Son HJ. Apopotsis and its correlation with proliferative activity in rectal cancer. J Surg Oncol. 2002;79:236-242. [PubMed] |
| 11. | Sever-Chroneos Z, Angus SP, Fribourg AF, Wan H, Todorov I, Knudsen KE, Knudsen ES. Retinoblastoma tumor suppressor protein signals through inhibition of cyclin-dependent kinase 2 activity to disrupt PCNA function in S phase. Mol Cell Biol. 2001;21:4032-4045. [PubMed] |
| 12. | Matturri L, Colombo B, Lavezzi AM. Evidence for apoptosis in non-small cell lung carcinoma. Relationship with cell kinetics and prognosis. Anal Quant Cytol Histol. 1999;21:240-244. [PubMed] |