修回日期: 2004-12-01
接受日期: 2004-12-08
在线出版日期: 2005-04-15
越来越多的研究证明, 无论从分子生物学特征、基因多态性方面还是从病理生理、免疫反应机制方面来说, ICAM-1高表达是白细胞与内皮细胞黏附力增强的主要分子基础, 他与炎性肠病的炎症过程相关并在其中起着重要的促进作用, 抗ICAM-1抗体能有效地抑制白细胞与上皮细胞的黏附而减轻炎症程度.
引文著录: 马锋振, 马洪升. 炎症性肠病炎症过程中ICAM-1的表达及作用. 世界华人消化杂志 2005; 13(8): 1014-1016
Revised: December 1, 2004
Accepted: December 8, 2004
Published online: April 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 1014-1016
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/1014.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.1014
细胞黏附分子是指由细胞合成并组装于细胞表面或分泌至细胞外基质间的可促进细胞与细胞或细胞与细胞外基质间黏附的一类糖蛋白, 其中内皮细胞黏附分子-1(intercellular adhesion molecule-1, ICAM-1)属于免疫球蛋白超家族(immunoglobulin superfamily, IGSF), 他在炎性肠病(inflammatory bowel disease, IBD)发病中的作用近年来受到关注. 本文就此作一综述.
细胞黏附分子分布于细胞表面或细胞外基质中, 参与细胞的信号传导与活化、细胞的伸展和移动、细胞的生长及分化、肿瘤转移、创伤愈合等一系列重要生理和病理过程. ICAM-1是一种糖蛋白, 含有5个Ig样区, 他广泛分部于各种上皮细胞、血管内皮细胞、网状细胞、成纤维细胞、单核/巨噬细胞和淋巴细胞中. ICAM-1在各种细胞的表达程度不同. 正常时ICAM-1呈现较低的表达, 而在细胞因子如白介素-1(IL-1)、肿瘤坏死因子(TNF)的作用下表达增强.
ICAM-1是一种具有多种生物功能的跨膜糖蛋白, 能介导细胞黏附、趋化、淋巴细胞归巢等, 参与炎症和免疫反应, 在机体的生理和病理过程中发挥作用. 他通常以配体和受体相结合的方式发挥作用. ICAM-1可结合淋巴细胞功能相关抗原-1(lymphocyte function-associated antigen-1, LFA-1)、巨噬细胞分子-1(macrophage-1, Mac-1)、纤维蛋白原和CD43. 其中LFA-1是主要受体, Mac-1与ICAM-1的亲和力较低, 且在激活的白细胞表面只有约10%的Mac-1可介导ICAM-1黏附.
人类ICAM-1基因是位于19p13.2-p13.3上的单拷贝基因, 全长约15.5 kb, 含7个外显子和6个内含子. 目前发现的该基因两个多态性位点, 分别位于241(G/R)密码子和469(K/E)密码子.469密码子多态性发生在ICAM-1基因的第6外显子处, 有KK、KE、EE三种基因型和K、E两个等位基因, 基因产物与结合LFA-1有关.241密码子多态性有GG、GR、RR三种基因型, 位于ICAM-1细胞外Ig样结构3区的第4外显子区, 此区778位核苷酸的G-A置换, 使241位氨基酸由甘氨酸变为精氨酸, 即Gly241Arg. 此位点位于配体结合区, 因此影响ICAM-1与配体Mac-1相互作用, 并由此影响炎症反应的强度和持续时间[1-2]. 目前研究已证实ICAM-1基因多态性与多种炎症性疾病的易感性相关.
到目前为止, 很多研究结果表明ICAM-1基因的多态性与IBD有关. Matsuzawa et al[3]在对日本的IBD患者的研究中发现K469等位基因频率及携带率明显增加, K469携带率在正常对照组为73.8%, 而在克罗恩病(CD)患者达89%(OR2.67 95%CI为1.24-6.15), 在溃疡性结肠炎(UC)患者达88%(OR2.45 95%CI为1.27-4.86). Low et al[4]对一组英国高加索地区IBD人群研究发现在CD患者中仅3例有R241纯合子, 在UC中没有出现R241, 在对照组4人有R241. G241R等位基因频率在CD、UC和对照组无明显差别. K469纯合子在CD中[91/137(39.9%)]较对照组[84/202(29.4%)OR=1.60(1.09 to 2.35)]显著升高. E469在CD患者中[32/196(14.0%)]要显著低于对照组[70/216(24.5%)OR = 0.5(0.31 to 0.82)], 但要注意E469等位基因频率在CD伴有瘘管的患者中是增加的. 对于UC来说, G241R等位基因频率升高更常见于表现为远端肠炎的患者.
白细胞的过度激活是炎性肠病病理过程中的一个重要环节, 而白细胞停滞并浸润式的血管外渗依赖于炎症部位白细胞和内皮细胞膜表面的黏附分子的表达与功能. ICAM-1作为免疫调节因子, 通过受配体相互作用, 介导白细胞不同亚群间的接触和黏附, 调节白细胞的功能活性和免疫反应. 中性粒细胞的吞噬作用、T淋巴细胞的识别抗原及活化、靶细胞的杀伤、T淋巴细胞对B淋巴细胞的激活及诱导分化、抗体形成等过程均与之有关[5]. ICAM-1与中性粒细胞上的LFA-1结合可引起其黏附渗出, 而ICAM-1功能缺陷可导致中性粒细胞黏附渗出障碍, 有利于减轻炎症反应. ICAM-1表达增强, 可使流动的白细胞固着, 为接受外来的抗原刺激提供足够的时间和机会, 使抗原提供的信息通过ICAM-1及其配体得以传递, 同时亦增加了ICAM-1受配体亲和力[6]. 在ICAM-1作用下, 中性粒细胞与内皮细胞牢固黏附, 在他们的界面形成了一个相对稳定的保护性微环境, 使血浆中的抑制物不能进入这个微环境, 而只有黏附于界面的中性粒细胞大量释放的自由基、蛋白溶酶、磷脂酶A2、白三烯类物质及血小板活化因子等能与内皮细胞反应, 直接损伤内皮或导致内皮功能障碍.
3.1.1 ICAM-1与免疫调节异常: IBD患者肠上皮细胞可表达有功能的细胞因子受体, 如IL-2受体γ链, 可与IL-15反应, 分泌IL-17, 激活肠黏膜固有层的单核细胞, 产生趋化因子、集落刺激因子(CSF)、TNF-α等, 细胞间黏附分子表达增加. IBD肠道间质组织中成纤维细胞表达大量的表面活化抗原, 可调节白细胞的黏附功能, 结合免疫细胞, 延长T细胞的存活寿命. 对IBD患者微循环研究发现, 肠腔内皮细胞的损伤可导致凝血系统激活, 增强与白细胞的黏附, 促进炎症反应[7].
正常肠组织ICAM-1通常低水平表达于血管内皮细胞、肠黏膜固有层和淋巴结中的单核巨噬细胞. 在IBD肠组织中, ICAM-1表达和分布明显增加, 且与组织的炎症程度密切相关[8]. LFA-1+和VAL-4+单核细胞和Mac-1+粒细胞在IBD肠组织中也大量增加. 促炎性细胞因子激活后毛细静脉内皮导致血管定址素上调与白细胞(淋巴细胞、多形核[PMN]细胞)和单核细胞通过一系列位于内皮与补充细胞之间的反应, 向固有层补充. 已活化的白细胞与单核细胞的输入导致炎性递质的产生. 这些炎性递质促进了炎性反应并造成组织损伤. 已有研究报道了与肠上皮完整性相关的激活过程[9].
细胞黏附分子(CAMs)由免疫细胞、内皮细胞表达, 而内皮细胞释放的黏附分子在肠黏膜局部发挥作用. 循环CAMs又包括可溶性细胞间CAMs(sICAM-1, CD54)和血管CAMs(sVCAM-1, CD44)等[10]. sICAM-1与ICAM-1相比, 缺少跨膜区和胞质段, 其总体结构与膜型ICAM-1的胞外段相似. sICAM-1保留了ICAM-1的生物学特性, 能与ICAM-1竞争性结合白细胞表面的LFA-1及Mac-1, 从而抑制了ICAM-1/LFA-1依赖性的非MHC限制性淋巴细胞的杀伤作用. IBD患者炎性肠黏膜中sICAM-1增多, 且与血液中sICAM-1浓度相关[11]. 但因CAMs量在IBD与正常对照组, 溃疡性结肠炎和克罗恩病, IBD活动及缓解期之间均有很大重叠, 且测量方法较复杂, 故CAMs作为IBD活动性的分子标志物的应用受限[12].
3.1.2 ICAM-1与炎症和组织损伤: 免疫反应增强、效应细胞活化及细胞因子分泌增加的结果, 最终导致炎症、组织损伤和纤维化, 并且炎症在循环免疫细胞和各种细胞因子的相互作用下进一步发展. IL-1β、TNF-α可增强黏附分子及其配体在内皮细胞和免疫细胞中的表达.
一般认为, 在炎性肠病发病中有以下过程: 起初, 选择素介导白细胞与内皮细胞间的微弱黏附. 在组织损伤后数分钟内, 内皮细胞P和E-选择素与白细胞相应配体结合, 使血管内快速流动的白细胞运动减慢. 然后, 白细胞与内皮细胞之间稳定黏附. 由于白细胞沿内皮做滚动运动, 可诱导内皮细胞上其他黏附分子的表达, 如CD31和CD44等. 他们与白细胞相应受体结合, 从而使白细胞与内皮细胞互为配体-受体的其他黏附分子相互结合, 如LFA-1/ICAM-1、LFA-2/ICAM-2、Mac-1/ICAM-1、VLA-4/VCAM-1等. 这样导致白细胞与内皮细胞的稳定黏附, 致使特定的细胞亚群定位于此处. 最后, 由免疫球蛋白超家族成员血小板内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1, PECAM-1)介导白细胞穿过内皮向炎症部位移行[8].
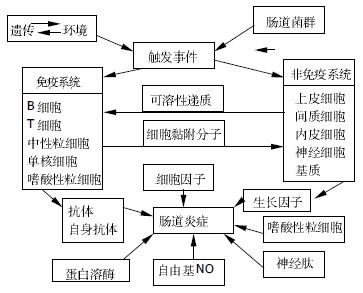
当然, IBD的发病机制为一系列诱导、持续和加重过程的组合引起非特异性炎症反应和免疫调节紊乱, 最终经共同途经而导致组织损伤. 其发病的病理生理机制如下图1所示[7].
ICAM-1在UC的黏膜和外周血循环中表达增加, 且与组织炎症程度密切相关. 有学者发现ICAM-1单抗对实验性UC具有治疗作用[13]. 研究中发现UC模型组大鼠脾脏和结肠组织ICAM-1mRNA表达上升, 与正常组和其他治疗组之间存在一定的差异, 提示其在UC的发病机制中可能起重要作用. 经治疗后ICAM-1mRNA表达明显下调, 表明治疗可能通过减少由黏附分子所介导的炎症细胞的浸润, 从而达到改善UC局部组织炎症损伤的目的[14]. 有报道[15]在DSS模型组大鼠的远端结肠中, ICAM-l表达位于血管内皮细胞和巨噬细胞, 毛细血管和小静脉的阳性率比小动脉高, 最多见于黏膜和黏膜下层; 结肠黏膜糜烂、浅溃疡及其附近阳性率较高, 从距肛门口3 cm以上起, 阳性率随炎症病变的减轻而逐渐减低; 黏膜层隐窝上皮细胞染色阴性, 淋巴细胞染色阴性. 观察到正常对照组大鼠远端结肠中仅少数血管内皮细胞ICAM-l表达阳性. 与对照组比较, DSS模型组大鼠结肠黏膜的ICAM-l表达显著增高. ICAM-l在白细胞的跨内皮迁移和免疫细胞激活方面发挥重要作用, 可介导DSS诱导的结肠炎的炎性损伤. Bendjelloul et al[16]报道, 在ICAM-l基因缺陷的实验性结肠炎小鼠中, 结肠黏膜ICAM-l表达呈阴性或弱阳性, 而野生型小鼠的ICAM-l表达阳性率很高. 内皮细胞ICAM-l表达下调后, 与白细胞的相互作用减弱, 从而使炎症活动性减低[17]. 用抗ICAM-l单克隆抗体预防性治疗可减轻DSS诱导的结肠炎模型的症状[18].
近年来对基因调控的深入研究证实, 肿瘤的发生是由众多基因参与的信号传导过程, 其中细胞黏附分子介导的细胞间相互作用对于肿瘤的形成和转移至关重要. 恶性肿瘤细胞表达不同的黏附分子, 黏附机制的失调在肿瘤的发生和转移中起重要的作用[19]. UC的恶变可能与此机制有关.黏附分子的主要作用是促进异源细胞间的相互黏附, 使得不同细胞间的相互效应得以实现, 形成肿瘤浸润和转移[20].
另外, UC活动期受累组织细胞中sVCAM-1水平明显增高, 缓解期其水平降低, 但仍高于正常人[21]. 正常组织中和外周血淋巴细胞中sVCAM-1含量接近, 但UC伴重度不典型增生者的组织中sVCAM-1含量明显高于血液中含量, 提示UC的恶变可能与此有关.
朗罕氏细胞向Th1细胞提呈抗原需要黏附分子, 向Th2细胞提呈抗原无需黏附分子参与. 目前认为克罗恩患者的发生与Th1细胞介导的局部炎症免疫应答反应有关, UC与Th2细胞有关.
抗ICAM-1抗体能有效地抑制白细胞与上皮细胞的黏附, 从而减轻炎症程度. Wong et al对乙酸诱发的IBD小鼠给予抗ICAM-1抗体.7 d后, 小鼠肠上皮组织破坏程度减轻, 白细胞浸润减少, 远端结肠与全身体重之比下降, 髓过氧化物酶活性降低2倍, 超氧化物减少将近85%. 抗ICAM-1抗体可用于治疗炎症、变态反应、移植排斥等疾病, 其抗炎机理主要为阻止抗原呈递和T细胞活化, 阻断淋巴细胞和中性粒细胞的内迁.
总之, 白细胞和内皮细胞之间的黏附作用所导致的组织损伤是细菌和细胞因子等引发的炎性肠病的共同通路之一, 而ICAM-1高表达是白细胞与内皮细胞黏附力增强的主要分子基础. 阻断IBD发病机制中的黏附过程, 减缓疾病的发生、发展, 已经成为临床预防和治疗的一个有效手段.
编辑: 张海宁
| 3. | Matsuzawa J, Sugimura K, Matsuda Y, Takazoe M, Ishizuka K, Mochizuki T, Seki S S, Yoneyama O, Bannnai H, Suzuki K. Association between K469E allele of intercellular adhesion molecule 1 gene and inflammatory bowel disease in a Japanese population. Gut. 2003;52:75-78. [PubMed] |
| 4. | Low JH, Williams FA, Yang XS, Cullen S, Colley J, Ling KL, Armuzzi A, Ahmad T, Neville MJ, Dechairo BM. Inflammatory bowel disease is linked to 19p13 and associated with ICAM-1. Inflamm Bowel Dis. 2004;10:173-181. [PubMed] |
| 5. | Gemmell E, Walsh LJ, Savage NW, Seymour GJ. Adhesion molecule expression in chronic inflammatory periodontal disease tissue. J Periodontal Res. 1994;29:46-53. [PubMed] |
| 8. | 费 保莹, 邓 长生, 朱 尤庆. 细胞黏附分子与炎症性肠病. 国外医学 消化系疾病分册. 1999;19:15-17. |
| 9. | Blumbetg RS, Strober W. 炎性肠病研究的展望. 美国医学会杂志: 中文版. 2002;21:72. |
| 11. | Sans M, Panes J, Ardite E, Elizalde JI, Arce Y, Elena M, Palacin A, Fernandez-Checa JC, Anderson DC, Lobb R. VCAM-1 and ICAM-1 mediate leukocyte-endothelial cell adhesion in rat experimental colitis. Gastroenterology. 1999;116:874-883. [PubMed] |
| 13. | Hamamoto N, Maemura K, Hirata I, . Murano M, Sasaki S, Katsu K. Inhibition of dextran sulphate sodium-induced colitis in mice by intracolonically administered antibodies against adhesion molecules. Clin Exp Immunol. 1999;117:462-468. |
| 16. | Bendjelloul F, Rossmann P, Maly P, Mandys V, Jirkovska M, Prokesova L, Tlaskalova-Hogenova H. Detection of ICAM-1-deficient and wild-type mice: an immunohistochemical study. Histochem J. 2000;32:703-709. [PubMed] |
| 17. | Bendjelloul F, Maly P, Mandys V, Jirkovska M, Prokesova L, Tuckova L, Tlaskalova-Hogenova H. Intercellular adhesion molecule-1 (ICAM-1) deficiency protects mice against severe forms of experimentally induced colitis. Clin Exp Immunol. 2000;119:57-63. [PubMed] |
| 18. | Taniguchi T, Tsukada H, Nakamura H, Kodama M, Fukuda K, Saito T, Miyasaka M, Seino Y. Effects of the anti-ICAM-1 monoclonal antibody on dextran sodium sulphate-induced colitis in rats. J Gastroenterol Hepatol. 1998;13:945-949. [PubMed] |
| 20. | Duenne AA, Werner JA. Functional anatomy of lymphatic vessels under the aspect of tumor invasion. Recent Results Cancer Res. 2000;157:82-89. [PubMed] |
| 21. | Hogaboam CM, Snider DP, Collins SM. Activation of T lymphocytes by syngeneic murine intestinal smooth muscle cells. Gastroenterology. 1996;110:1456-1466. [PubMed] |