修回日期: 2005-03-01
接受日期: 2005-03-10
在线出版日期: 2005-04-01
目的: 探讨清胰解毒方对急性出血坏死性胰腺炎(AHNP)大鼠的治疗作用及可能机制.
方法: 34只SD大鼠随机分为AHNP模型组(AHNP, n = 17)和AHNP+清胰解毒方疗组(QJF, n = 17). 模型制备采用胆胰管逆行注射牛磺胆酸钠. 造模前12 h和造模后每隔12 h, AHNP组给予生理盐水, QJF组给予相应中药10 mL/kg体重灌胃. 造模后4 d留取血清, 测定淀粉酶(Amy)和C-反应蛋白(CRP)活性. 取胰腺组织、肠组织作病理切片, 进行组织损伤严重程度评分. 通过ELISA法检测炎症递质肿瘤坏死因子(TNF)-α、白介素(IL)-6表达的变化.
结果: QJF组大鼠血清Amy的表达(36 724±257.88 nk/L)明显低于AHNP组(37 340.8±283.39 nk/L)(P<0.05); QJF组CRP活性(2±1.7 mg/L)显著低于AHNP组(3.56±2.7 mg/L)(P<0.05); QJF组炎症递质IL-6的表达(19.22±2.24 mg/L)显著低于AHNP组(23.20±1.82 mg/L)和TNF-α的表达(11.57±5.85 mg/L)显著低于AHNP组(21.42±10.1 mg/L)(P<0.05); 病理组织学评分结果显示, QJF组胰腺组织坏死和炎性细胞浸润程度比AHNP组显著减轻(P<0.05), 胰腺组织水肿和出血程度两组无明显差异(P>0.05); QJF组小肠和结肠组织的损伤比AHNP组显著减轻(P<0.05).
结论: QJF组可显著降低实验性大鼠胰腺损伤的严重程度, 其可能机制与保护肠道屏障、减少细菌移位、下调炎症递质表达、阻断内毒素信号通路等有关.
引文著录: 梁珂, 彭炜, 舒志军, 缪皑池, 陆磊, 周丽霞. 清胰解毒方对急性出血坏死性胰腺炎大鼠的治疗作用. 世界华人消化杂志 2005; 13(7): 916-918
Revised: March 1, 2005
Accepted: March 10, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 916-918
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/916.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.916
现代医学治疗急性出血坏死性胰腺炎(acute hemorrhage necrotizing pancreatitis, AHNP)尚无特效药物, 常用的生长抑素和抑制胰酶分泌的药物尚不理想. 各种外科手术的选择性高, 适应证少, 术后能否降低死亡率存在疑问[1]. 目前重症胰腺炎的死亡率为40%, 其治疗是困扰医学界的一大难题[2-3]. 中医药具有多靶点作用、系统性综合治疗的优势. 我们按AHNP分期论治, 将进展期的病机辨证为湿阻毒壅, 拟定利湿解毒、通腑泻热的清胰解毒方. 本实验从该组中药降低胰腺组织的水肿、腺泡坏死、炎性细胞浸润, 减少肠道细菌移位, 降低肠源性内毒素的产生和吸收, 阻断炎症因子诱发的级联反应出发, 以期进一步阐明清胰解毒方对AHNP的作用机制.
1.1.1 动物: 健康清洁级SD大鼠34只, ♂, 体重180±20 g, 购自中科院上海斯莱克实验动物有限公司.
1.1.2 药物: 牛磺胆酸钠(sodium taurocholate)购自美国Sigma公司, 戊巴比妥钠(pentobarbital sodium)购自美国Sigma公司, 批号20030709. 中药清胰解毒方: 益母草30 g, 水牛角片30 g, 生大黄15 g, 芒硝12 g, 柴胡10 g, 黄芩10 g, 甘草10 g. 制成浓度为1 kg/L, 灭菌处理后瓶装于冰箱中存放. 配方颗粒由江苏江阴天江药业有限公司提供, 批号0309147.
1.1.3 试剂和仪器: TNF-α, IL-6试剂盒购自美国Biosouce公司; 推注泵(Syringe Pump, PSK01): 日本NIKKISO 公司. 超低温冰箱(-40℃): 日本SANYO电器株式会社. 自动化学分析仪(Auto Dry Chemitry Analyzer, SP-4410): 日本第一科学株式会社; Orion Diagnostica(TurboxTM): 芬兰Orion公司; 低速离心机: 常州国华电器有限公司; Wellscan MK2型酶标仪: 热电集团上海雷勃公司; 隔水式电热恒温培养箱(PYX-DHS-40×50): 上海市跃进医疗器械厂.
1.2.1 AHNP模型的建立: 实验前于本院脉研所实验动物中心饲养2 wk, 常规饲料及饮水, 昼夜交替12 h, 饲养环境为清洁级. 造模前动物禁食12 h, 不禁水. 腹壁正中切口入腹, 显露出十二指肠, 找到胆胰管十二指肠乳头开口, 用4号半静脉注射针逆行插入胆胰管, 同时在胆管出肝门处用小动脉夹夹闭, 使用可调式静脉推注泵以12 mL/h持续匀速输入3%的牛磺胆酸钠(1 mL/kg), 注完后维持压力5-10 min. 术后, 后肢皮下注射生理盐水5 mL/只.
1.2.2 分组及给药方法: 将34只大鼠随机分为2组: 模型组(AHNP组)和清胰解毒方治疗组(QJF组). 术前12 h和术后每隔12 h, 分别给予清胰解毒方中药和生理盐水灌胃一次2 mL/只. 术后两组动物均禁水12 h, 禁食36 h. 造模后第4 d取标本检测.
1.2.3 淀粉酶和C-反应蛋白的测定: 采用自动分析法, 取血离心后, 将血清放置于检测孔中, 加入淀粉酶干试条, 测定血清淀粉酶的活性. 将20 μL血清加入0.5 mL空白试剂和20 μL血清加入0.5 mL测定试剂, 放置于室温30 min, 用特定蛋白仪TurboxTM检测C-反应蛋白的数值.
1.2.4 IL-6的测定: 配置标准品溶液2 000, 1 000, 500, 250, 125, 62.5, 31.2, 0 ng/L; 建立空白对照孔和质控孔, 每孔加入缓冲液50 μL(空白孔除外); 在微孔反应板上标记8个孔, 每孔加入一种浓度的标准溶液100 μL; 标记标本测定孔, 每孔加入50 μL的稀释缓冲液, 再加入待测标本50 μL, 质控孔直接加入100 μL, 振荡混匀; 封板, 置37℃恒温箱中孵育2 h后洗板; 每孔加入孵育缓冲液100 μL(空白孔除外), 封板, 室温静置1 h后洗板; 每孔加入100 μL的streptavid-HRP(空白孔除外), 封板, 室温静置30 min后洗板; 每孔加入100 μL的Stabilized Chromogen, 封板, 室温静置30 min后每孔加入100 μL的终止液, 混匀; 取波长450 nm, 用酶标仪读数.
1.2.5 TNF-α的测定: 配置标准品溶液2 000, 1 000, 500, 250, 125, 62.5, 31.2, 0 ng/L; 建立空白对照孔和质控孔, 在微孔反应板上标记8个孔, 每孔加入一种浓度的标准溶液100 μL; 标记标本测定孔, 每孔加入50 μL的稀释缓冲液, 再加入待测标本50 μL, 质控孔直接加入100 μL; 振荡混匀, 每孔加入50 μL anti-TNF-α, 振荡混匀(空白孔除外); 封板, 室温静置90 min后洗板; 每孔加入100 μL的streptavid-HRP(空白孔除外), 封板, 室温静置45 min后洗板; 每孔加入100 μL的Stabilized Chromogen, 封板, 室温静置30 min后每孔加入100 μL的终止液, 混匀; 取波长450 nm, 用酶标仪读数.
1.2.6 胰腺组织、肠组织病理学评分: 取胰腺组织置于中性甲醛溶液固定, 常规脱水、包埋、切片、HE染色, 由专一病理医师观察切片. 胰腺组织半定量积分(表2)参照Schmidt et al[4]评分方法. 肠黏膜的病理变化(表3)按Chiu et al[5]评分方法(表1)进行.
| 分数 | 标准 | |
| 1 | 0级 | 正常肠绒毛 |
| 2 | 一级 | 绒毛顶端黏膜下出现奸细, 毛细血管充血 |
| 3 | 二级 | 黏膜下间隙扩大, 肠黏膜与黏膜下层分离 |
| 4 | 三级 | 黏膜与黏膜下层分离延伸到肠绒毛两侧 |
| 5 | 四级 | 绒毛变钝, 固有层及其血管暴露, 炎性细胞浸润 |
| 6 | 五级 | 固有层消化崩解, 出血或形成溃疡 |
| 组别 | n | 水肿 | 腺泡坏死 | 出血 | 炎症细胞浸润 |
| AHNP组 | 11 | 1.45±0.24 | 2.08±0.31 | 0.33±0.25 | 1.89±0.26 |
| QJF组 | 11 | 1.23±0.27 | 1.52±0.35 | 0.32±0.22 | 1.33±0.27 |
| 分数 | 1 | 2 | 3 | 4 | 5 | 6 | |
| AHNP组 | 小肠 | 0 | 3 | 4 | 2 | 2 | 0 |
| (n = 11) | 结肠 | 0 | 2 | 3 | 3 | 2 | 1 |
| QJF组 | 小肠 | 0 | 4 | 4 | 2 | 1 | 0 |
| (n = 11) | 结肠 | 0 | 3 | 4 | 4 | 1 | 0 |
统计学处理 所有数据以mean±SD表示. 应用SPSS11.0统计软件组间数值采用方差分析, 配对数据采用t检验, P<0.05为差异有显著意义.
造模后4 d内, 模型组和治疗组均死亡6只, 死亡率无差别. 第4 d剩余动物AHNP组血清Amy为37 340.8±283.39 nk/L, QJF组为36 724±257.88 nk/L, QJF治疗组血清Amy显著低于AHNP组(P<0.05). AHNP组CRP活性为3.56±2.7 mg/L, QJF组为2±1.7 mg/L, QJF组CRP活性显著低于AHNP组(P<0.05).
第4 d测得AHNP组血清IL-6的含量为23.20±1.8 mg/L, QJF治疗组为19.22±2.2 mg/L, QJF组血清IL-6的含量显著低于AHNP组(P<0.05). AHNP组TNF-α含量为21.42±10.1 mg/L, QJF治疗组为11.57±5.85 mg/L, QJF组血清TNF-α含量显著低于AHNP组(P<0.05).
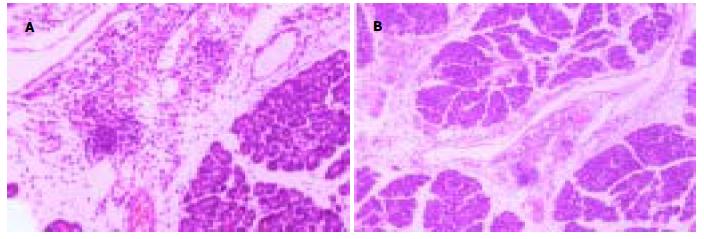
AHNP组大鼠胰腺组织间质明显水肿, 导致小叶间隔, 小叶内部甚至腺泡间隔增宽, 血管扩张充血, 并见出血区域, 胰腺组织呈广泛凝固性坏死, 呈灶性、小叶分布, 可见多个大片坏死区域, 夹杂大片出血灶. 胰腺间质中见大量单核和中性粒细胞浸润, 夹杂残存的胰腺组织(图1A). QJF组胰腺组织坏死和炎性细胞浸润程度较AHNP组显著减轻(P<0.05, 图1B), 但胰腺组织水肿和出血程度两组相比无明显差异(P>0.05)(表2). AHNP组可见肠黏膜上皮坏死脱落, 固有层裸露、充血或出血, 大量炎性细胞浸润, 偶见黏膜下血栓形成. QJF组肠黏膜损伤程度较AHNP组显著减轻(P<0.05)(表3).
中医药治疗重症急性胰腺炎有着悠久的历史, 既往多从腑气不通, "不通则痛"论治, 把通腑泻下作为本病最主要的治疗原则[6-8]. 但在临床应用时存在两方面的问题, 一方面难以耐受持续应用; 另一方面由于其病机为湿阻毒壅, 且湿性黏滞, 易阻遏气机, 因此湿邪不去, 通下常难收效. 我们结合临床经验认为, 湿邪为AHNP的基本病机, 毒邪为其病情演变的必然. 肝胆疏泄不利, 湿邪内阻, 久则蕴而为毒, 损害各脏腑组织造成本病的发生. 因此我们以"祛邪为先, 利湿为要"为指导, 以利湿解毒、通腑泻热为基本治则, 拟定清胰解毒方.
清胰解毒方的作用主要表现在两个方面: 一是益母草和水牛角具有清热解毒、利水消肿的作用, 既可减轻胰腺、肠等组织的炎性损伤, 同时对水瘀互阻所致的渗液及腹水有较好的治疗作用. 现代药理学研究还认为, 益母草的主要成分为益母草碱和水苏碱, 具有溶栓、抗凝、抑制血小板聚集、改善微循环、抗氧自由基、减少细胞内钙超载等作用; 另一方面通腑泻下类药物在重症急性胰腺炎的早期总体治疗中的能够增加肝、肠血液组织灌流, 抑制内毒素移位和细菌移位, 维护肠道的功能[9-10]. 同时, 还可通过降低血中内毒素水平, 抑制TNF-α的表达[11], 减轻缺血再灌注损害, 提高肠内容slgA和肠黏膜组织蛋白含量[12], 预防多系统器官衰竭(MSOF)在重症急性胰腺炎早期的发生.
现代研究认为AHNP的发生是由于组织的坏死、损伤、内毒素血症等原因造成循环中TNF-α, IL-1β和脂多糖(LPS)水平升高, 进一步刺激IL-6, IL-8等的产生, 造成第一次高细胞因子血症, 通过级联反应, 造成全身炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS)[13]. 因此, TNF-α在一定程度上可以反映重症急性胰腺炎的严重程度[14]. 实验显示, 清胰解毒方通过利湿、泻下、解毒等作用, 可以荡涤胃肠道的宿垢、致病菌和毒素, 减少肠道细菌移位, 降低TNF-α、IL-6的表达, 阻断炎症的级联反应, 提高机体的免疫功能, 改善胰腺组织及相关脏器的损伤. 总之, AHNP是一个多因素性、累及多环节的疾病, "个体化治疗"、"综合性治疗"是提高其疗效和预后的发展方向[15]. 中药清胰解毒方在临床和动物实验中显示出较好的疗效, 对于其作用靶点和具体有效成分有待于进一步深入研究.
编辑: 张海宁
| 1. | Niederau C. Prognosis of acute pancreatitis. In: Beger HG. Bhler M, Malfertheiner (eds) P. Standards in pancreatic surgery. Springer Berlin Heidelberg New York. 1993;1:76-91. |
| 3. | Manes G, Rabitti PG, Menchise A, Riccio E, Balzano A, Uomo G. Prophylaxis with meropenem of septic complications in acute pancreatitis: a randomized, controlled trial versus imipenem. Pancreas. 2003;27:79-83. [PubMed] |
| 4. | Schmidt J, Lewandrowsi K, Warshaw AL, Compton CC, Rattner DW. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol. 1992;12:41-45. [PubMed] |
| 5. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states.i. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] |
| 8. | 韩 恩昆, 吴 咸中. 大承气汤和活血清胰汤对重症急性胰腺炎肺损伤治疗的实验研究. 中国中西医结合外科杂志. 2004;10:90-92. |
| 9. | 闻 庆平, 陈 海龙, 关 凤林. 清胰汤对大鼠重症急性胰腺炎时急性肺损伤治疗作用的观察. 中国中西医结合外科杂志. 2003;9:302-306. |
| 11. | 杨 文修, 刘 曼, 王 辉, 余 奕, 董 志勇, 吴 咸中. 大承气汤对内毒素刺激巨噬细胞分泌肿瘤坏死因子的抑制作用. 中国中西医结合外科杂志. 2001;7:390-392. |
| 12. | 解 基良, 张 志尧, 吴 咸中. MODS时肠道细菌移位及承气方剂对其影响的病理形态学观察. 中国中西医结合外科杂志. 2000;6:189-191. |