修回日期: 2005-01-01
接受日期: 2005-01-08
在线出版日期: 2005-04-01
目的: 探讨二甲基亚硝胺(Dimethylnitrosamine, DMN)诱发大鼠肝硬化过程中Ⅳ型胶原、Ⅳ型胶原酶(MMP-2)活性及基质金属蛋白酶抑制物-2(TIMP-2)表达的动态变化.
方法: 采用DMN诱发大鼠肝硬化模型, 设 2 d, 1, 2, 3, 4, 5, 6, 8, 12, 24 wk共10个观察点, 分别用生化方法测定其肝组织羟脯氨酸(hydroxyproline, Hyp)含量、血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)活性和白蛋白(albumin, ALB)含量, Envision两步法(免疫组化)测定肝组织Ⅳ型胶原和TIMP-2表达, 酶图法测定肝组织MMP-2活性.
结果: 模型大鼠肝组织Hyp、Ⅳ型胶原含量, 血清ALT活性显著高于正常组, ALB含量显著低于正常组.2 d时MMP-2活性显著高于正常组, 然后在正常范围内波动. 正常组和8 wk以前各组模型大鼠TIMP-2表达微弱, 12 wk表达明确, 24 wk表达增强.
结论: DMN诱发Wistar大鼠肝硬化模型形成前后MMP-2功能主要通过蛋白分泌量和活化量调节而实现, 此期肝窦基底膜Ⅳ型胶原含量主要通过MMP-2活性调节, 和蛋白分泌及TIMP-2表达关系不大. 在肝硬化恢复期TIMP-2调节的重要性逐渐上升, 故TIMP-2表达量是肝硬化时肝窦毛细血管化能否恢复的关键因素之一.
引文著录: 徐光福, 张凤朝. DMN诱发大鼠肝硬化模型MMP-2活性的动态变化. 世界华人消化杂志 2005; 13(7): 902-905
Revised: January 1, 2005
Accepted: January 8, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 902-905
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/902.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.902
肝窦毛细血管化是肝纤维化和肝硬化过程中首发和重要的病理改变, 肝硬化形成后其存在非常稳定, 肝硬化病情能否好转与肝窦毛细血管化是否逆转关系密切, 肝窦毛细血管化的主要形态学标志是基底膜增厚和内皮细胞筛孔减少和/或消失, 而作为肝窦基底膜主要成分之一的Ⅳ胶原的含量不仅昭示着肝窦毛细血管化的进程, 而且受到MMP-2活性和其抑制物TIMP-2含量的影响. 因此探讨肝硬化如何好转的机制无法绕开这些问题, 本实验拟对此作一系统的观察.
Wistar雄性大鼠, SPF级, 体重140-150 g, 购自中科院上海实验动物中心. 二甲基亚硝胺(dimethylni-trosamine, DMN)购自瑞典威灵公司. 小鼠抗人IV型胶原蛋白(Col IV)单克隆抗体, Oncogene公司产品. Envision 4004B(mouse)二抗、Envision 4001B(mouse, 二抗)为丹麦DAKO公司产品, 购自上海中达试剂公司. DAB试剂购自华美公司.鼠抗人TIMP-2 (Ab-1)单克隆抗体(一抗)为复旦大学医学院病理教研室免疫组化研究室张秀荣老师馈赠, 为CALBIOCHEM公司产品(pH值7.4, 浓度为2 mg/L). 丙烯酰胺和N, N-亚甲双丙烯酰胺, 分析纯, 加拿大BBI公司产品. N, N, N, N-四甲基乙二胺, MW116.21, 分析纯, 二硫苏糖醇, Brij-35Concentrate, MW 1 199.57, 明胶, 美国Amresco公司产品. 曲拉通X-100, 美国Sigma公司产品. 分子量Marker, 上海有机化学所产品. 蛋白浓度测定用试剂合(双缩脲法), 上海生物制品研究所产品.
1.2.1 肝硬化模型制作: 将(5 mL/L)DMN溶液按2 mL/kg体重剂量予大鼠腹腔注射, 连续注射3 d, 共4 wk, 第1 wk用2/3量, 以后用全量. 共设10个观察点, 分别为2 d, 1, 2, 3, 4, 5, 6, 8, 12, 24 wk. 每个观察点设正常对照3只, 模型6只. 至各观察点后, 乙醚麻醉下开腹, 经下腔静脉采血, 然后在肝左叶取1.0 cm×0.8 cm×0.3 cm大小肝组织, 常规固定. 所采血液4℃静置3 h, 3 000 r/min离心30 min分离血清, -70℃保存备用.
1.2.2 观察指标与方法: (1)肝组织病理学观察及肝纤维化程度半定量: 肝组织石蜡包埋, 切片厚度为5 μm, HE染色及胶原染色(丽春红染色法), 光镜观察肝脏病理学改变, 并参照文献[1]对肝纤维化程度半定量. (2)肝组织Ⅳ型胶原含量测定, 采用Envision两步法[2]并作图像分析进行半定量. (3)肝组织Hyp含量测定, 按照Jamall方法测定[3]. (4)血清ALT活性测定, 采用赖氏(Rriman-Frankle)法. (5)血清ALB含量测定, 采用溴甲酚绿(BGG)法. (6)肝组织MMP-2活性测定, 参照文献[4-6]使用酶图法, 酶活力单位比活 = A/(g/L). (7)肝组织TIMP-2含量测定, 采用Envision两步法.
统计学处理 全部资料采用SPSS 10.0软件进行方差分析.
造模大鼠第2 d肝组织可见大片细胞坏死及内出血, 肝细胞肿胀, 仅在部分标本见到汇管区少许纤维增生. 自第1-4 wk, 胶原增生逐渐加重, 以第4, 5 wk为最重, 绝大多数形成较厚的纤维隔, 自第4 wk造模结束后肝纤维化逐渐减轻, 但未见自行消退, 24 wk时仍有较厚的不完全纤维隔. 肝纤维化半定量结果与病理变化相一致.
肝组织含Hyp含量自3-24 wk均较正常组明显增加. 血清ALB含量模型组均较正常组降低, 但第4 wk与正常组无统计学差异; 12 wk与24 wk则与正常组无差异. 血清ALT活性均高于正常组, 但2 d、1 wk及24 wk与正常组相比无显著性差异(表1).
| 组别 | n | Hyp(mg/g) | ALB(g/L) | ALT(nkat/L) |
| 正常组 | 6 | 62±21 | 437±85 | 466±283 |
| 2 d | 6 | 100±22 | 397±199 | 1 066±966 |
| 1 wk | 6 | 158±50 | 183±148a | 483±200 |
| 2 wk | 6 | 128±63 | 250±153a | 1 100±333a |
| 3 wk | 6 | 276±122 | 279±61a | 1 867±450a |
| 4 wk | 6 | 223±37a | 346±138 | 2 983±600a |
| 5 wk | 6 | 167±67a | 262±176a | 2 733±766a |
| 6 wk | 6 | 187±59a | 213±71a | 2 633±500a |
| 8 wk | 6 | 187±73a | 182±88a | 2 217±316a |
| 12 wk | 6 | 236±139a | 353±124 | 1 800±533a |
| 24 wk | 6 | 202±36a | 294±152 | 766±41 |
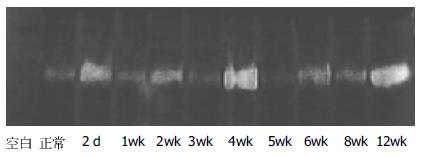
正常肝窦区域含有一定数量IV型胶原, 1 wk时明显低于正常. 此后大致与纤维化的发展相对应, 12 wk时仍然显著高于正常, 但24 wk时已经接近正常. 造模第2 d组MMP-2活性显著高于正常, 此后在正常范围内有所波动(表2, 图1).
所有正常大鼠仅见个别肝窦有TIMP-2微弱表达, 第1-8 wk造模大鼠有部分在肝窦与间隔部位微弱表达TIMP-2, 其他则见不到表达. 所有造模大鼠第12 wk肝窦部位TIMP-2表达增多, 第24 wk表达明显增强, 但间隔仍然少而不稳定.
肝窦毛细血管化过程中一个重要的调节机制是MMP-2/TIMP-2系统, 主要与肝窦基底膜Ⅳ型胶原含量有关, 是其主要调节因素, 在早期可能通过影响基底膜Ⅳ型胶原含量参与肝星状细胞(hepatic stellate cell, HSC)活化, 肝硬化形成后可能与肝窦毛细血管化逆转等有关. 肝纤维化机制研究中采用酶图法测定MMP-2活性, 文章报道不多, 主要因为技术操作步骤复杂, 肝组织MMP-2含量较少而且还有其抑制物存在, 不容易作出活性, 但是其功能却只能以活性来说明, 单纯地以免疫组化法测定其蛋白表达意义有限, 甚至不能用以解释相关的病理改变.
MMP-2又称Ⅳ型胶原酶/明胶酶A, 肝脏内由HSC、库普弗细胞和窦内皮细胞合成, 以无活性的酶原形式分泌, 其氨基端裂解掉80个氨基酸后被激活[7-8]. 活化后的MMP-2可降解明胶与Ⅳ、Ⅴ、Ⅶ、Ⅹ型胶原, 但不能降解Ⅰ、Ⅱ、Ⅲ型间质纤维胶原. MMP-2降解Ⅳ型胶原发生在其分子中对胃蛋白酶抵抗的片段, 作用位点是甘氨酸-亮氨酸、甘氨酸-异亮氨酸键. MMP-2的激活与抑制受多种因素调控. 基质金属蛋白酶抑制因子家族目前报道有TIMP-1、TIMP-2、TIMP-3和TIMP-4. TIMP-2分子质量约22 ku, 可与MMP-1、MMP-2和MMP-3呈1/1结合, 但对MMP-2的抑制作用要较TIMP-1强7-10倍以上, 所以是主要的MMP-2调节因素. MT1-MMP是MMP家族的跨细胞膜成员, 可在细胞膜上与MMP-2和TIMP-2构成三联体, 并在Asn37·Leu38处裂解pro-MMP-2(前Ⅳ型胶原酶), 然后pro-MMP-2可在Asn80·Tyr81处自发裂解从而活化. TIMP-2、TIMP-3和TIMP-4都可以快速与MT1-MMP的水解部位结合, 抑制其裂解MMP-2的功能, 从而抑制MMP-2的活化, 但以TIMP-2最为重要. TIMP-1对活化裂解的第一步无作用, 但对第2步pro-MMP-2的自发裂解有抑制作用.Ⅰ型胶原可介导枯否细胞使MT1-MMP的蛋白表达增加, 结果是促进pro-MMP-2的活化. 虽然MMP-2的活化需要TIMP-2的存在, 但过多的TIMP-2反而抑制MMP-2的激活, 并抑制已激活的MMP-2的活性. 原因是TIMP-2可与MT1-MMP竞争结合Pro-MMP-2, 使之不能形成三联体而激活, 或与已经活化的MMP-2结合, 使之不能分解Ⅳ型胶原[9-11]. Ikeda et al学者[12-14]有相近报道. MMP-2的活化还和整合素系统有关. 主要在活化过程中需要integrin的多价聚合, 以把各种活化相关分子聚在一处.
人肝活化HSC和库普否细胞可分泌MT1-MMP和MMP-2, 主要在局部激活MMP-2, 并分解细胞外基质(extracel-lular matrix, ECM). 活化的MMP-2分子质量不很均一, 有69 ku、66 ku和62 ku等, 故以酶图法测定MMP-2活性时, 可以显示相对应的透亮条带. 早在1989年Friedman et al[13]就报道HSC在富含Ⅳ型胶原的EHS溶胶(小鼠胚胎瘤提取物, 含大量基底膜成分)上培养时没有明显的数量上的增生和形态的改变, 合成的ECM只有在塑料板上培养时的35%, 且以Ⅲ型胶原为主. 这说明HSC的微环境对HSC的状态发挥重要影响. Takahara et al[14]首次报道了CCI4诱发的大鼠肝纤维化模型中MMP-2的相关研究, 发现诱发早期, MMP-2 mRNA即上升达正常对照的7-12倍, 蛋白水平上升达对照的13-18倍. 国内有学者研究[15]Wistar大鼠肝纤维化时MMP-2 mRNA的表达, 发现比正常高, 但无显著性差异. 而从正常肝脏分离的HSC则不能检出MMP-2 mRNA的表达. 由于HSC正常时位于狄氏间隙, 故所释放的MMP-2活化后最先应作用于肝窦基底膜的Ⅳ型胶原, 使HSC的微环境发生改变, 失去了HSC赖以保持稳定的条件, 从而促进其活化, MMP-2的活化尚与Ⅳ型胶原含量有关. Pasco et al[16]报道来自前晶状体囊的Ⅳ型胶原和合成的Ⅳ型胶原α3多肽(185-203)可抑制黑色素瘤和纤维肉瘤细胞的迁移并通过减少MT1-MMP和integrin β3组件的表达而抑制膜依赖的MMP-2活化. 虽然肝脏HSC相关的此类报道尚未见到, 但不排除类似的分子机制. 所以MMP-2的活化、Ⅳ型胶原的减少这两个密切相关的因素均是促进HSC的活化. 有学者发现酶图法分析MMP-2的活性可精确到pg水平, 而且所检测的是MMP-2的活性形式, 与其功能密切相关, 由于MMP-2分泌后可以不活化, 不活化则无功能, 故以此法测定MMP-2的活性来说明其功能, 有不可替代的优点.
动态观察2 d时MMP-2的分泌高峰显然造成了1 wk时肝窦基底膜Ⅳ型胶原的急剧下降. 这可能与肝细胞大量坏死, 库普否细胞分泌MMP-9、TNF-α和TGF-β1, 后者激活HSC, 并分泌TGF-β1和MMP-2有关.1 wk时MMP-2已经下降至正常范围, 同时1 wk后至3 wkⅣ型胶原恢复至正常水平, 到4 wk达高峰.4 wk时MMP-2又有所上升, 相应的4-5 wkⅣ型胶原含量又有所下降; 5 wk到6 wk MMP-2下降到低于正常, 此期间Ⅳ型胶原含量下降又稍慢. 此后MMP-2继续上升, 到12 wk时达到第3个高峰, 且要高于4 wk时的第2个高峰, 正是这个高峰导致Ⅳ型胶原继续被分解, 到24 wk时Ⅳ型胶原已经恢复正常. 可见这二者之间存在一定相关. 值得注意的是, 在12 wk之前模型大鼠TIMP-2仅仅有个别微弱表达, 12 wk表达增加, 到24 wk表达更多.24 wk时MMP-2活性较12 wk时低, 可能与受到TIMP-2的抑制有关, 另外12-24 wk Ⅳ型胶原下降速度较缓慢, 也可能和此时TIMP-2开始表达并抑制MMP-2的活性有关. 既往有学者报道肝纤维化时胶原纤维的堆积是因为TIMP过多, 从而抑制了MMPs的活性, 导致胶原纤维不能被分解所致[17-18]. 本实验观察到至24 wk模型大鼠整体肝纤维化仍然没有恢复, 表现为纤维间隔依然存在, 羟脯氨酸含量仍然很高, 但肝窦部位Ⅳ型胶原已经恢复正常, 说明在本实验中肝窦区域Ⅳ型胶原的代谢有其特殊性, 即在这组Wistar雄性大鼠其肝脏组织TIMP-2的增多在时间上未能构成对MMP-2活性的抑制, 体现出肝窦部位Ⅳ型胶原代谢调节的特殊性, 这是否大鼠品系特性使然, 有待进一步研究. 虽然TIMP-2的表达增强不利于间隔部位Ⅳ型胶原的分解, 但对肝窦区域正常含量的Ⅳ型胶原却可能有保护作用. 正常肝窦基底膜对维持肝HSC的稳定是必不可少的, Ⅳ型胶原是肝窦基底膜的重要成分, 所以Ⅳ型胶原维持在正常状态, 对保持HSC稳定有积极意义.
肝窦周围狄氏间隙Ⅰ型胶原是否存在以及含量多少的问题, 有学者作过专门研究[19-20], 发现人肝纤维化时肝窦附近狄氏间隙有Ⅰ型胶原的堆积(窦周纤维化), 并且经过治疗后该部位Ⅰ型胶原的减少与患者其他方面的改善有一定联系.Ⅰ型胶原的网格结构可以诱发血窦内皮细胞协同表达MT1-MMP和MMP-2, 促进MMP-2活化. 这说明肝窦毛细血管化机制非常复杂, 各种因素相互影响, 呈现网络状特征. 可以设想, 在纤维化初期, MMP-2活化可能有助于分解肝窦基底膜Ⅳ型胶原, 从而促进HSC活化; 但在HSC活化后期, 已经发生肝窦毛细血管化, 则MMP-2的升高可能有助于分解过多的Ⅳ型胶原, 使肝血窦恢复正常. 我们在其他大鼠品系动物模型研究中, 已经多次发现并证实SD品系大鼠肝脏MMP-2活性作不出, 同时其TIMP-2表达比较高, 这可能提示肝窦基底膜Ⅳ型胶原代谢确实有特殊调节机制[21-23]. 这样的结果提示应该继续深入研究, 同时在以后的研究中应该充分重视动物品系不同所导致实验结果的差异.
编辑: 张海宁
| 3. | Jamall IS, Finelli VN, Que Hee SS. A simple method to determine nanogram levels of 4-hydroxyproline in biological tissues. Anal Biochem. 1981;112:70-75. [PubMed] |
| 4. | 金冬雁, 黎孟枫(译). 分子克隆实验指南. 第二版. 北京: 科学出版社 1993; 888-893. |
| 7. | 王 爱民, 王 宝恩. 基质金属蛋白酶. 国外医学临床生物化学与检验学分册. 1995;16:245-248. |
| 8. | 周 永健, 陈 岳祥, 李 石, 曾 民德. 基质金属蛋白酶及其抑制因子与肝纤维化. 国外医学消化系疾病分册. 1996;16:67-70. |
| 9. | Preaux AM, Mallat A, Nhieu JT, D'Ortho MP, Hembry RM, Mavier P. Matrix metalloproteinase-2 activation in human hepatic fibrosis regulation by cell-matrix interactions. Hepatology. 1999;30:944-950. [PubMed] |
| 10. | Benyon RC, Hovell CJ, Da Gaca M, Jones EH, Iredale JP, Arthur MJ. Progelatinase A is produced and activated by rat hepatic stellate cells and promotes their proliferation. Hepatology. 1999;30:977-986. [PubMed] |
| 11. | Takahara T, Furui K, Yata Y, Jin B, Zhang LP, Nambu S, Sato H, Seiki M, Watanabe A. Dual expression of matrix metalloproteinase-2 and membrane-type-1 matrix meta-lloproteinase in fibrotic human liver. Hepatology. 1997;26:1521-1529. [PubMed] |
| 12. | Ikeda K, Wakahara T, Wang YQ, Kadoya H, Kawada N, Kaneda K. In Vitro migratory potential of rat quiescent hepatic stellate cells and its augmentation by cell activation. Hepatology. 1999;29:1760-1767. [PubMed] |
| 13. | Friedman SL, Roll FJ, Boyles J, Arensen DM, Bissell DM. Maintenance of differentiated phenotype of cultured rat hepatic lipocytes by basement membrance matrix. J Biol Chem. 1989;264:10756-10762. [PubMed] |
| 14. | Takahara T, Furui K, Funaki J, Nakayama Y, Itoh H, Miyabayashi C, Sato H, Seiki M, Ooshima A, Watanabe A. Increased expression of matrix matalloproteinase-II in experimental liver fibrosis in rats. Hepatology. 1995;21:787-795. [PubMed] |
| 16. | Pasco S, Han J, Gillery P, Bellon G, Maquart FX, Borel JP, Kefalides NA, Monboisse JC. A specific sequence of the noncollagenous domain of the alpha3 (IV) chain of type IV collagen inhibits expression and activation of matrix metalloproteinases by tumor cells. Cancer Res. 2000;60:467-473. [PubMed] |
| 17. | Benyon RC, Iredale JP, Goddard S, Winwood PJ, Arthur MJ. Expression of tissue inhibitor of metalloproteinases 1 and 2 is increased in fibrotic human liver. Gastroenterology. 1996;110:821-831. [PubMed] |
| 18. | Iredale JP, Benyon RC, Arthur MJ, Ferris WF, Alcolado R, Winwood PJ, Clark N, Murphy G. Tissue inhibitor of metalloproteinase-1 messenger RNA expression is enhanced relative to interstitial collagenase messenger RNA in experimental liver injury and fibrosis. Hepatology. 1996;24:176-184. [PubMed] |
| 19. | 徐 列明, 朱 剑亮, 刘 成, 刘 平, 吕 刚, 薛 惠明, 胡 义杨, 洪 嘉禾. 桃仁提取物合虫草菌丝对肝炎后肝硬化肝窦毛细血管化的逆转作用观察. 中国中西医结合杂志. 1994;14:362-363. |
| 21. | Friedman SL. Cellular sources of collegen and regulation of collegen production in liver. Semin Liver Dis. 1990;10:20. [PubMed] |
| 22. | Xu GF, Wang XY, Ge GL, Li PT, Jia X, Tian DL, Jiang LD, Yang JX. Dynamic changes of capillarization and peri-sinusoid fibrosis in alcoholic liver diseases. World J Gastroenterol. 2004;10:238-243. [PubMed] |
| 23. | Xu GF, Li PT, Wang XY, Jia X, Tian DL, Jiang LD, Yang JX. Dynamic changes in the expression of matrix metalloproteinases and their inhibitors, TIMPs, during hepatic fibrosis induced by alcohol in rats. World J Gastroenterol. 2004;10:3621-3627. [PubMed] |