修回日期: 2005-02-01
接受日期: 2005-02-26
在线出版日期: 2005-04-01
DNA结合和分化抑制剂(inhibitor of DNA binding and differentiation, Id)是螺旋-环-螺旋(helix-loop-helix, HLH)转录因子亚家族的一个成员, 4个Id成员与碱性螺旋-环-螺旋(basic helix-loop-helix, bHLH)蛋白形成二聚体, 但缺乏碱性DNA结合结构域, 因此, Id-bHLH异源二聚体不能结合DNA, 故Id蛋白是bHLH转录因子的显性负调节子. Id蛋白也能与非HLH蛋白相互作用, 如Rb、Ets、同源盒家族转录因子Pax、小鼠Id相关蛋白1(MIDA-1), 并抑制其活性. 现已证实Id在肿瘤细胞中通常过表达, 并且与肿瘤细胞增生、分化、凋亡、侵袭等密切相关.
引文著录: 于新凤, 刘芝华. Id蛋白与肿瘤关系的研究进展. 世界华人消化杂志 2005; 13(7): 880-883
Revised: February 1, 2005
Accepted: February 26, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 880-883
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/880.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.880
螺旋-环-螺旋(helix-loop-helix, HLH)转录因子是调节细胞生长和分化的重要因子, 大多数HLH蛋白属于碱性HLH(bHLH)家族成员, 包括高度保守的HLH结构域和碱性DNA结合区. HLH结构域使这些蛋白形成特定的同源或异源二聚体, 从而获得转录活性. DNA结合区通过与E盒序列结合发挥转录激活或抑制作用. 碱性DNA结合区缺失的bHLH蛋白称为Id蛋白, Id蛋白主要与bHLH形成二聚体, 这些Id-bHLH异源二聚体不能结合DNA, 因此Id蛋白是bHLH蛋白的显性负调节子. 大多数bHLH蛋白正向调节细胞分化, 因此Id蛋白被认为是分化和DNA结合的抑制剂. 目前在哺乳动物已经发现了4种Id蛋白, 分别定位于人类染色体20q11(Id-1), 2p25(Id-2), 1p36.1(Id-3)和 6p21-22(Id-4)[1]. 这些蛋白均有高度保守的HLH结构域, 分子质量相近, 约13-20 ku. Id基因在很多未分化的细胞中表达, 在终末分化的细胞中表达水平降低. 在未分化的人二倍体成纤维细胞中, Id1和Id2在血清刺激后表现为双相表达, 表达峰在刺激后2-3 h和12 h, 这两个峰分别和细胞周期G1早期和G1-S期相对应[2], 表明Id蛋白参与细胞周期调控. 最近发现, Id蛋白调节肿瘤细胞增生、分化、侵袭等, 并与肿瘤进展和不良预后有关.
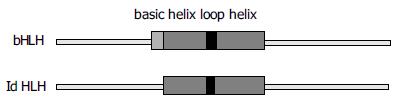
目前从酵母到人的生物体中已发现200多个HLH转录因子, HLH蛋白调节基因表达, 调控细胞周期, 决定细胞分化[3-4]. 如图1所示, 高度保守的HLH区包括两个两性α螺旋, 每个有15-20个氨基酸残基, 这两个α螺旋被可变长度和序列的中间环分隔开. HLH结构域主要介导同源或异源二聚化, 有利于DNA结合和转录调节. 几乎所有的HLH蛋白都有与HLH结构域相邻的碱性区, 有利于结合到含"E盒"的DNA序列CANNTG, 调节很多组织和细胞终末分化基因的转录. 一些HLH蛋白也结合到相关的"N盒"DNA序列CACNAG[4]. 缺少碱性DNA结合区的bHLH蛋白称为Id蛋白, Id-bHLH异源二聚体不能结合DNA, 因此Id蛋白是bHLH蛋白的显性负调节子.
Id蛋白除了与bHLH蛋白相互作用外, 还与非bHLH蛋白相互作用. 如Id2和Id4与pRb肿瘤抑制蛋白及其相关的袋形蛋白(pocket protein)p107和p130相互作用, 参与细胞周期调节[5-6]. Id1、Id2、Id3与含ETS结构域的三重复合因子(ternary complex factor, TCF)相互作用, 抑制与丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)偶联的立即早期基因的诱导[7]. Id1、Id2和Id3蛋白在体外和体内与同源盒家族转录因子(Pax)如Pax-2, Pax-5, Pax-8结合, 抑制Pax介导的B淋巴细胞特异性MB-1启动子的转录激活[8]. 脂肪细胞决定和分化因子1(adipocyte determination- and differentiation-dependent factor 1, ADD1)是bHLH-亮氨酸拉链转录因子家族成员, 与Id2和Id3相互作用调控脂质发生相关基因的表达[9]. 小鼠Id相关蛋白1(mouse ID-associated protein 1, MIDA1)是一种Z-DNA结合蛋白, Id1可增强其序列特异性的DNA结合, 参与细胞生长的正调节[10-11].
对Id基因双敲除小鼠的胚胎致死性研究, 进一步认识了Id基因的多方面功能. 有研究报道, Id基因对小鼠发育是必需的, 由于哺乳动物4个Id成员功能互补和表达分布的交叉, 仅同时有多个不同Id基因缺陷的小鼠是胚胎致死性的. Id1和Id3基因双敲除的小鼠在出生前就死亡, 目前只有对Id1-/-Id3-/-小鼠表型的文献报道. 早期胚胎表现为神经发生异常、血管畸形和血管内皮细胞发育不良[12]. 在成年Id1+/-Id3-/-小鼠, 由于Id1等位基因的存在, 小鼠可存活, 但移植瘤内皮细胞血管发育缺陷, 抑制了肿瘤的生长和转移[13]. Id基因双敲除小鼠的胚胎致死性与单个Id基因缺陷的小鼠表型形成鲜明对比. 仅Id2基因缺陷的小鼠表现出生长迟缓和初生疾病, 雄性Id2-/-小鼠精子发生异常, 存活的Id2-/-小鼠自然杀伤细胞产生缺陷, 免疫功能受损[13]. Id1缺陷的小鼠没有发现细胞功能异常, Id3缺陷小鼠表面正常, 但有微弱的淋巴细胞增生异常, 影响免疫系统的功能. 目前没有关于Id4缺陷小鼠的报道.
蛋白修饰对于调节蛋白功能是重要的, Id蛋白有蛋白激酶A、蛋白激酶C、cdc2激酶、酪氨酸激酶II的磷酸化位点, 除了酪氨酸激酶II位点外, Id1、Id2、Id3蛋白的这些位点在体外可被磷酸化[14]. Id1和Id2蛋白的蛋白激酶A位点磷酸化, 并未影响这些蛋白与bHLH蛋白异源二聚化. Id2、Id3、Id4蛋白的第5个氨基酸位点的丝氨酸残基能被cdc2、cyclin E-cdk2和cyclinA-cdk2磷酸化, 磷酸化的Id2和Id3二聚化亲和力发生改变[15-16].
Id蛋白寿命很短, 半衰期因细胞类型而不同, 大约20-60 min. Id蛋白快速降解可能是通过泛素-蛋白酶体途径. Id1、Id2、Id3蛋白泛素化后被26S蛋白酶体降解, Id4也被泛素化, 但对26S蛋白酶体不敏感. 负责降解Id蛋白的氨基酸序列还不清楚, 但在Id1、Id2、Id4蛋白发现了与A和B型周期蛋白类似的破坏盒共有序列[17].
Id蛋白调控细胞周期有两条途径: 第一条途径, Id蛋白负调节周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)抑制剂, 抑制周期蛋白和CDK形成复合物或抑制其活性. Id1抑制E2A bHLH调节的CDK抑制剂 P21Cip1/Waf1的表达, 降低P21Cip1/Waf1对cyclinA/E-cdk2活性的抑制, 从而磷酸化pRb, 使pRb与E2F解离, 促进G1-S期进行. 在骨骼肌细胞, P21Cip1/Waf1表达升高与终末分化和细胞周期阻滞有关, 并被MyoD诱导[18-19]. P21Cip1/Waf1启动子区含E盒, E盒是bHLH共有结合位点, 介导MyoD或E蛋白对P21Cip1/Waf1基因的激活[20-21]. Id1蛋白抑制bHLH因子转录激活P21Cip1/Waf1基因, 使cyclin A/E-cdk2活性下降, 细胞进入S期[20]. 在体内, Id1-/-Id3-/-小鼠胎脑成神经细胞过早退出细胞周期, 伴有P16Ink4a和P27Kip1表达增高[12]. 另外, Id2-/-小鼠乳腺上皮细胞在妊娠期停止增生, 同时P21Cip1/Waf1和P27Kip1蛋白表达增高[22]. 因此, Id负调节CDK抑制剂表达, 在细胞周期调控中起重要作用.
第二条途径涉及Id2和Id4与pRb及其相关袋形蛋白P107和P130蛋白直接作用, 降低pRb对E2F转录因子的抑制, 从而促进G1-S期的进行. 在G1期, pRb结合E2F蛋白, 抑制其促进细胞周期进行的作用, 导致G1-S期阻滞. CyclinD-cdk4和cyclin A/E-cdk2磷酸化pRb, 释放E2F因子, 使细胞进入S期[23]. pRb和E2F在G1期相互作用是通过pRb的袋形结构域, Id2通过HLH结构域结合未磷酸化的pRb的袋形结构域, 释放E2F因子, 促进细胞周期进行[5]. 研究表明, Id2是myc的直接靶点, myc基因促进细胞周期的活性高度依赖Id2[24], 因此, Id2可能介导myc调控细胞周期. 另外, Rb家族蛋白P107和P130, 也能被Id2蛋白拮抗. Id4蛋白可能也拮抗Rb家族蛋白, 但Id1和Id3蛋白没有该活性[5].
最早发现Id1抑制分化的作用来源于对肌细胞和造血细胞的研究. Id1在前体细胞中表达高而在分化细胞中表达低, 分化早期Id1过表达降低了小鼠红白血病细胞(murine erythroleukemia cells, MEL)的E盒结合活性[25]. 转染Id1基因的小鼠红白血病细胞通过阻止红细胞特异性基因的表达, 抑制了二甲基亚砜(DMSO)诱导的分化[26]. 另外, 成肌细胞中Id1过表达, Id1通过与E盒相互作用, 抑制了肌细胞分化[27].骨发生蛋白2(bone morphogenetic protein 2, BMP2)是肌细胞分化抑制剂, 可以在转录水平直接与Id1启动子作用, 诱导成肌细胞中Id1基因表达[28], 这表明Id1在细胞分化中起负性调控作用.
正常细胞在终末分化阶段停止增生, 表达组织特异性的标志物和非特异性的细胞周期调控因子如P21Cip1/Waf1和P27Kip1, 细胞阻滞在G1期. 最近Ling et al研究发现转化生长因子β(transforming growth factor-beta, TGFβ)诱导永生化的前列腺上皮细胞HPr-1分化, 表现为细胞形态改变, 生长阻滞, 角蛋白K8和K18表达增加, 同时Id1表达下调[29], 这表明Id1表达下调对起始和维持细胞分化起重要作用. 最近研究表明, Id1在增生旺盛的甲状腺组织中表达上调, 降低Id1mRNA水平可以抑制甲状腺细胞增生, 因此, Id1调节甲状腺组织的生长和分化[30]. 总之, Id1在多种细胞中抑制细胞分化, 从而促进细胞增生和永生化. 与之相反, Id2基因在乳腺上皮细胞分化过程中起正调控作用, Id2基因缺陷的孕鼠乳腺上皮分化不全[31].
大多数研究表明Id1在非上皮来源的细胞中促进凋亡, 目前大多数Id1表达上调的肿瘤都是上皮起源的, 因此Id1主要抑制细胞凋亡, 并与细胞类型有关. 如在前列腺癌细胞, Id1基因表达抑制细胞凋亡[32], 当凋亡诱导剂TNFα作用于人前列腺癌细胞LNCaP细胞, 在Id1表达阳性和阴性的细胞均发生程序性细胞死亡, 但Id1表达阴性的细胞比表达阳性的细胞凋亡率高, 而且Bax蛋白、Caspase和聚ADP核糖聚合酶(PARP)也增加, 表明Id1基因表达可以抑制前列腺细胞凋亡. 进一步研究表明这主要是通过Id1转录激活NFκB途径, 从而调节下游细胞间黏附分子-1(ICAM-1)和Bcl-xl蛋白表达实现的.
研究表明, 与Id1不同, Id2诱导细胞凋亡的机制可能与Id2拮抗Rb蛋白的功能有关[5]. 另外, Id2是Myc蛋白的靶蛋白[24], Myc蛋白可以直接诱导细胞凋亡[33-34]. 最近对Id蛋白诱导细胞凋亡的分子机制研究发现, Id2蛋白的N末端区与bHLH蛋白相互作用, 可能激活凋亡途径. Id3的N末端区没有该活性, 而与促凋亡的Bax蛋白有关[35].
Id蛋白在许多肿瘤组织中高表达, 与癌组织的过度增生和恶性转化有关. 最近报道在15种人类癌症中均有Id1转录和翻译水平的增高, 而且大多是上皮来源的肿瘤, 如前列腺癌[36], 卵巢癌[26]等, 这表明Id1对维持肿瘤细胞生长是必需的. Id1表达水平还与肿瘤侵袭和不良预后有关, 这在前列腺癌[36]和卵巢癌[37]的研究中得到了证实. 最近已把Id1作为宫颈癌早期不良预后的标志[38]. Id2过表达介导了细胞恶性转化, 促进了成神经细胞瘤的增生[39]. Id2 mRNA在胰腺癌中过表达, 用丁酸钠和TPA诱导胰腺癌细胞分化, Id2 mRNA水平降低, Id2反义核苷酸转染抑制了细胞生长, 表明Id2在胰腺癌发生中有重要作用[40].
如前所述, Id蛋白在正常细胞表达上调, 促进了DNA合成及细胞周期G1-S期进行, 进而促进了正常细胞增生. 干扰细胞周期调节也是Id蛋白调节癌细胞增生的机制. 如Id1诱导的前列腺细胞增生与P16INK4a表达下调有关, Rb蛋白磷酸化水平增加, 而其他的细胞周期蛋白依赖性激酶抑制剂P21Cip1/Waf1和P27Kip1在转染Id1的前列腺细胞没有发生改变[41]. 在不表达P16INK4a或P21Cip1/Waf1的癌细胞, Id1蛋白抑制P27Kip1, 而P27Kip1反过来诱导Rb蛋白磷酸化, 刺激细胞周期进展, 这在鼻咽癌的研究中得到了证实. 总之, Id蛋白通过抑制CDK抑制剂, 增加Rb蛋白磷酸化, 从而促进肿瘤细胞增生.
最近研究发现, 激活MAPK信号途径是引起Id1诱导的癌细胞增生的另一机制. 如异位表达Id1的前列腺癌细胞LNCaP中, MAPK信号途径的主要调节子Raf和MEK1/2磷酸化水平增加, 而且MAPK途径下游效应子如早期生长反应基因(early growth response gene-1, Egr-1)在转录和翻译水平也增加. 抑制MEK1/2激酶磷酸化, 可以抑制下游效应子Egr-1的表达. 抑制MEK1/2活性也能抑制Id1诱导的细胞增生, 使细胞生长速度下降. 这些结果表明异位Id1表达导致MAPK信号途径激活, 促进了肿瘤细胞的增生.
肿瘤侵袭和转移包括几个步骤, 首先癌细胞失去和其他细胞相互作用的能力, 消化周围基底膜, 侵袭到血液中, 随血液到达其他部位后继续增生并形成新生血管, 继而形成转移瘤. Id1在肿瘤进展中起重要作用. 研究表明, 永生化的小鼠乳腺上皮细胞系SCp2外源表达Id1, 导致细胞侵袭性和迁移性增加, 使其通过基底膜的侵袭力大大提高, 这可能与120 ku的基质金属蛋白酶表达增加有关, 但没有发生细胞恶性转化, 表明Id1可能是细胞迁移的正调控因子.
另有研究表明, Id1-/-Id3+/-小鼠由于血管形成不良导致肿瘤异体移植无法存活, Id1和Id3基因双敲除小鼠的肿瘤细胞血管形成缺陷, 这可能是由于依赖于血管内皮生长因子(VEGF)的骨髓来源的上皮细胞无法形成新生的肿瘤血管上皮细胞[12]. 最近研究表明, 一种新生血管形成的内源性抑制剂血栓收缩蛋白(thrombospordin-1, TSP-1), 是Id1调节血管形成的下游效应子. 在Id1-/-小鼠, TSP-1转录增加, 抑制了成纤维细胞生长因子(FGF)和VEGF诱导的血管生成, 并可被TSP-1失活所逆转. 因此Id1抑制TSP-1转录可能在促进血管生成方面起重要作用. 最近微阵列分析发现, 肿瘤上皮细胞Id1基因缺失导致几个促进血管生成的基因包括整合素α6和整合素β4, 基质金属蛋白酶2和成纤维细胞生长因子受体1表达下调, 表明Id1失活可能抑制了上皮细胞血管生成的能力. 因此, Id1蛋白在肿瘤细胞血管形成中起重要作用.
Id1在侵袭方面的作用在乳腺癌中得到了证实. 研究发现Id1在高度侵袭性的乳腺癌细胞系MDA-MB-321和 MDA-MB-435中表达较高, 而在低侵袭性的MCF7和T47D细胞中表达相对较低. 用Id1反义核苷酸技术抑制其表达, 能降低实验动物乳腺癌细胞肺转移的能力. 而且, 反义Id1载体稳定转染的乳腺癌细胞接种到裸鼠后, 其肺转移的能力也降低. 这些结果不仅表明Id1在乳腺癌转移中起重要作用, 而且提示降低Id1表达可以作为治疗乳腺癌转移的策略之一.
目前发现许多人类肿瘤中Id蛋白表达上调, 其表达水平与肿瘤进展和预后有关, 体外研究表明Id蛋白调节肿瘤细胞增生、分化、凋亡、侵袭和衰老等. Id蛋白家族有相似的表达方式, 其家族成员的相互作用可能对调节肿瘤发生发展至关重要. 目前, Id蛋白与其他蛋白的相互作用机制及调控Id基因表达的上游因子和Id蛋白的下游效应子还不清楚. 现在正致力于Id蛋白在人类肿瘤中的分子机制研究, 这不仅为人类肿瘤的诊断和治疗方法提供新的科学依据, 而且为发展新的抗癌药物提供作用靶点.
编辑: 张海宁
| 1. | Norton JD, Deed RW, Craggs G, Sablitzky F. Id helix-loop-helix proteins in cell growth and differentiation. Trends Cell Biol. 1998;8:58-65. [PubMed] |
| 2. | Hara E, Yamaguchi T, Nojima H, Ide T, Campisi J, Okayama H, Oda K. Id-related genes encoding helix-loop-helix proteins are required for G1 progression and are repressed in senescent human fibroblasts. J Biol Chem. 1994;269:2139-2145. [PubMed] |
| 3. | Littlewood TD, Evan GI. Transcription factors 2: helix-loop-helix. Protein Profile. 1995;2:621-702. [PubMed] |
| 4. | Massari ME, Murre C. Helix-loop-helix proteins: regulators of transcription in eukaryotic organisms. Mol Cell Biol. 2000;20:429-440. [PubMed] |
| 5. | Iavarone A, Garg P, Lasorella A, Hsu J, Israel MA. The helix-loop-helix protein Id2 enhances cell proliferation and binds to the Retinoblastoma protein. Genes Dev. 1994;8:1270-1284. [PubMed] |
| 6. | Lasorella A, Iavarone A, Israel MA. ID2 specifically alters regulation of the cell cycle by tumour suppressor proteins. Mol Cell Biol. 1996;16:2570-2578. [PubMed] |
| 7. | Yates PR, Atherton GT, Deed RW, Norton JD, Sharrocks AD. ID helix-loop-helix proteins inhibit nucleoprotein complex formation by the TCF-ETS domain transcription factors. EMBO J. 1999;18:968-976. [PubMed] |
| 8. | Roberts EC, Deed RW, Inoue T, Norton JD, Sharrocks AD. Id Helix-Loop-Helix Proteins Antagonize Pax Transcription Factor Activity by Inhibiting DNA Binding. Mol Cell Biol. 2001;21:524-533. [PubMed] |
| 9. | Moldes M, Boizard M, Liepvre XL, Feve B, Dugail I, Pairault J. Functional antagonism between inhibitor of DNA binding(Id) and adipocyte determination and differentiation factor 1/sterol regulatory element-binding protein-1c(ADD1/SREBP-1c) trans-factors for the regulation of fatty acid synthase promoter in adipocytes. Biochem J. 1999;344:873-880. [PubMed] |
| 10. | Shoji W, Inoue T, Yamamoto T, Obinata M. MIDA1, a protein associated with Id, regulates cell growth. J Biol Chem. 1995;270:24818-24825. [PubMed] |
| 11. | Inoue T, Shoji W, Obinata M. MIDA1, an Id-associating protein, has two distinct DNA binding activities that are converted by the association with Id1: a novel function of Id protein. Biochem Biophys Res Commun. 1999;266:147-151. [PubMed] |
| 12. | Lyden D, Young AZ, Zagzag D, Yan W, Gerald W, O'Reilly R, Bader BL, Hynes RO, Zhuang Y, Manova K. Id1 and Id3 are required for neurogenesis, angiogenesis and vascularisation of tumour xenografts. Nature. 1999;401:670-677. [PubMed] |
| 13. | Yokota Y, Mansouri A, Mori S, Sugawara S, Adachi S, Nishikawa S, Gruss P. Development of peripheral lymphoid organs and natural killer cells depends on the helix-loop-helix inhibitor, Id2. Nature. 1999;397:702-706. [PubMed] |
| 14. | Nagata Y, Shoji W, Obinata M, Todokoro K. Phosphorylation of helix-loop-helix proteins ID1, ID2, and ID3. Biochem Biophys Res Commun. 1995;207:916-926. [PubMed] |
| 15. | Deed RW, Hara E, Atherton GT, Peters G, Norton JD. Regulation of Id3 cell cycle function by Cdk-2 dependent phosphorylation. Mol Cell Biol. 1997;17:6815-6821. [PubMed] |
| 16. | Hara E, Hall M, Peters G. Cdk2-dependent phosphorylation of Id2 modulates activity of E2A-related transcription factors. EMBO J. 1997;16:332-342. [PubMed] |
| 17. | Bounpheng MA, Dimas JJ, Dodds SG, Christy BA. Degradation of Id proteins by the ubiquitin proteasome pathway. FASEB J. 1999;13:2257-2264. [PubMed] |
| 18. | Halevy O, Novitch BG, Spicer DB, Skapek SX, Rhee J, Hannon GJ, Beach D, Lassar AB. Correlation of terminal cell cycle arrest of skeletal muscle with induction of p21 by MyoD. Science. 1995;267:1018-1021. [PubMed] |
| 19. | Parker SB, Eichele G, Zhang P, Rawls A, Sands AT, Bradley A, Olson EN, Harper JW, Elledge SJ. p53-independent expression of p21Cip1 in muscle and other terminally differentiating cells. Science. 1995;267:1024-1027. [PubMed] |
| 20. | Prabhu S, Ignatova A, Park ST, Sun XH. Regulation of the expression of cyclin-dependent kinase inhibitor p21 by E2A and Id proteins. Mol Cell Biol. 1997;17:5888-5896. [PubMed] |
| 21. | Pagliuca A, Gallo P, De Luca P, Lania L. Class A helix-loop-helix proteins are positive regulators of several cyclin-dependent kinase inhibitors promoter activity and negatively affect cell growth. Cancer Res. 2000;60:1376-1382. [PubMed] |
| 22. | Mori S, Nishikawa SI, Yokota Y. Lactation defect in mice lacking the helix-loop-helix inhibitor Id2. EMBO J. 2000;19:5772-5781. [PubMed] |
| 23. | Sherr CJ, Roberts JM. CDK inhibitors: positive and negative regulators of G1-phase progression. Genes Dev. 1999;13:1501-1512. [PubMed] |
| 24. | Lasorella A, Noseda M, Beyna M, Yokota Y, Iavarone A. Id2 is a retinoblastoma protein target and mediates signalling by Myc oncoproteins. Nature. 2000;407:592-598. [PubMed] |
| 25. | Shoji W, Yamamoto T, Obinata M. The helix-loop-helix protein Id inhibits differentiation of murine erythroleukemia cells. J Biol Chem. 1994;269:5078-5084. [PubMed] |
| 26. | Lister J, Forrester WC, Baron MH. Inhibition of an erythroid differentiation switch by the helix-loop-helix protein Id1. J Biol Chem. 1995;270:17939-17946. [PubMed] |
| 27. | Jen Y, Weintraub H, Benezra R. Overexpression of Id protein inhibits the muscle differentiation program: in vivo association of Id with E2A proteins. Genes Dev. 1992;6:1466-1479. [PubMed] |
| 28. | Katagiri T, Imada M, Yanai T, Suda T, Takahashi N, Kamijo R. Identification of a BMP-responsive element in Id1, the gene for inhibition of myogenesis. Genes Cells. 2002;7:949-960. [PubMed] |
| 29. | Ling MT, Wang X, Tsao SW, Wong YC. Down-regulation of Id-1 expression is associated with TGF beta 1-induced growth arrest in prostate epithelial cells. Biochim Biophys Acta. 2002;1570:145-152. [PubMed] |
| 30. | Kebebew E, Peng M, Treseler PA, Clark OH, Duh QY, Ginzinger D, Miner R. Id1 gene expression is up-regulated in hyperplastic and neoplastic thyroid tissue and regulates growth and differentiation in thyroid cancer cells. J Clin Endocrinol Metab. 2004;89:6105-6111. [PubMed] |
| 31. | Miyoshi K, Meyer B, Gruss P, Cui Y, Renou JP, Morgan FV, Smith GH, Reichenstein M, Shani M, Hennighausen L. Mammary epithelial cells are not able to undergo pregnancy-dependent differentiation in the absence of the helix-loop-helix inhibitor Id2. Mol Endocrinol. 2002;16:2892-2901. [PubMed] |
| 32. | Ling MT, Wang X, Ouyang XS, Xu K, Tsao SW, Wong YC. Id-1 expression promotes cell survival through activation of NF-kappaB signalling pathway in prostate cancer cells. Oncogene. 2003;22:4498-4508. [PubMed] |
| 33. | Askew DS, Ashmun RA, Simmons BC, Cleveland JL. Constitutive c-myc expression in an IL-3-dependent myeloid cell line suppresses cell cycle arrest and accelerates apoptosis. Oncogene. 1991;6:1915-1922. [PubMed] |
| 34. | Evan GI, Wyllie AH, Gilbert CS, Littlewood TD, Land H, Brooks M, Waters CM, Penn LZ, Hancock DC. Induction of apoptosis in fibroblasts by c-myc protein. Cell. 1992;69:119-128. [PubMed] |
| 35. | Florio M, Hernandez MC, Yang H, Shu HK, Cleveland JL, Israel MA. Id2 promotes apoptosis by a novel mechanism independent of dimerization to basic helix-loop-helix factors. Mol Cell Biol. 1998;18:5435-5444. [PubMed] |
| 36. | Ouyang XS, Wang X, Lee DT, Tsao SW, Wong YC. Overexpr-ession of ID-1 in prostate cancer. J Urol. 2002;167:2598-2602. [PubMed] |
| 37. | Schindl M, Schoppmann SF, Strobel T, Heinzl H, Leisser C, Horvat R, Birner P. Level of Id-1 protein expression correlates with poor differentiation, enhanced malignant potential, and more aggressive clinical behavior of epithelial ovarian tumors. Clin Cancer Res. 2003;9:779-785. [PubMed] |
| 38. | Schindl M, Oberhuber G, Obermair A, Schoppmann SF, Karner B, Birner P. Overexpression of Id-1 protein is a marker for unfavorable prognosis in early-stage cervical cancer. Cancer Res. 2001;61:5703-5706. [PubMed] |
| 39. | Lasorella A, Boldrini R, Dominici C, Donfrancesco A, Yokota Y, Inserra A, Iavarone A. Id2 is critical for cellular proliferation and is the oncogenic effector of N-myc in human neuroblastoma. Cancer Res. 2002;62:301-306. [PubMed] |
| 40. | Kleeff J, Ishiwata T, Friess H, Buchler MW, Israel MA, Korc M. The helix-loop-helix protein Id2 is overexpressed in human pancreatic cancer. Cancer Res. 1998;58:3769-3772. [PubMed] |
| 41. | Ouyang XS, Wang X, Ling MT, Wong HL, Tsao SW, Wong YC. Id-1 stimulates serum independent prostate cancer cell proliferation through inactivation of p16(INK4a)/pRB pathway. Carcinogenesis. 2002;23:721-725. [PubMed] |