修回日期: 2005-02-11
接受日期: 2005-02-26
在线出版日期: 2005-04-01
目的: 探讨创伤弧菌(Vibrio vulnificus, Vv)经食管感染小鼠的致病特点.
方法: 39只SPF级昆明小鼠(雌性20只, 雄性19只), 实验组24只, 均强制性喂食Vv菌液(4.7×1010cfu/L, 菌株编号1.1758)0.6 mL/只; 对照组15只, 喂食灭菌培养基(含35 g/l NaCl的碱性蛋白胨水)0.6 mL/只. 观察小鼠一般情况, 分别于实验后12、32及72 h各处死8只实验组小鼠和5只对照小鼠, 取其食管、胃及肠组织进行病理学观察, 同时进行Vv分离培养, 并取胃组织进行扫描电镜观察. 另外用强酸及低盐处理Vv菌后, 行光镜观察及增菌培养.
结果: Vv经食管感染小鼠后并未导致其出现呕吐、腹泻等消化道症状, 且Vv的分离培养结果均为阴性, 但病理学及扫描电镜结果显示实验组小鼠胃黏膜表面附着有极度肿胀变形的Vv菌体, 且附着处部分胃黏膜上皮细胞脱落、溶解坏死. 强酸低盐处理过的Vv部分肿胀变形, 且增菌培养结果为阴性.
结论: Vv在正常小鼠的胃酸环境中不能存活, 难以进入肠道繁殖, 通常不引起小鼠呕吐和腹泻症状, 但可轻度损伤小鼠胃黏膜上皮; 1.1 758Vv株属消化道感染弱毒力株.
引文著录: 郑晶, 申洪, 陈清. 创伤弧菌经食管感染小鼠的致病性. 世界华人消化杂志 2005; 13(7): 860-863
Revised: February 11, 2005
Accepted: February 26, 2005
Published online: April 1, 2005
AIM: To characterize the Vibrio vulnificus (Vv) infection transmitted through the alimentary canal in mice.
METHODS: Thirty-nine KM mice (SPF) were divided randomly into 2 groups: the study group (n = 24) and the control group (n = 15). The model of alimentary canal transmitted Vv infection was established by feeding each mouse with 0.6 mL (4.7×1010cfu/L ) Vv inoculum (strain 1.1758). The mice in the control group were fed with sterile culture medium. The pathological changes of the alimentary canal were examined under microscope. Vv taken from the tissues was cultured. The morphology of Vv in acid (close to the gastric juice) and at low salinity (9 g/L NaCl) was also examined.
RESULTS: No digestive symptom such as vomiting or diarrhea was observed in the mice fed with Vv. The Vv culture results of the tissues were negative. However, degeneration and necrosis of the epithelial cells were observed in the gastric mucosa. Anamorphic and swollen Vv was found in the stomach under microscope in the study group. Vv processed in acid and low salt was also anamorphic and swollen.
CONCLUSION: Vv cannot survive in the acidic gastric juice with low salinity naturally, but it can still induce acute injury of the gastric mucosa. Vv strain 1.1 758 infected via enteron has a mild pathogenicity in the gastric mucosa.
- Citation: Zheng J, Shen H, Chen Q. Pathogenicity of Vibrio vulnificus infection in mice through enteron. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 860-863
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/860.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.860
创伤弧菌(Vibrio vulnificus, Vv)是弧菌属第5群细菌. 生的或未加工熟的贝甲类海产品(尤其是牡蛎)是导致创伤弧菌食源性感染的主要传播媒介. 很多临床病例已经证明, 进食被Vv污染的食物可引起创伤弧菌食物中毒, 主要表现为严重的蜂窝组织炎和败血症[1-2], 由Vv单独引起急性胃肠炎的病例却极为少见[3]. 因此, 食源性感染Vv后对消化道的致病性问题还尚待阐明. 为此, 我们在建立Vv经食管感染的小鼠模型基础上, 进行了相关实验性研究.
Vv购于中国科学院微生物研究所普通微生物保藏管理中心, 菌株编号1.1758, 无荚膜, 乳糖发酵阴性. 购回后进行冷冻干燥菌种的恢复培养, 培养基为35 g/L NaCl的碱性蛋白胨水, 培养后的Vv悬液用标准平板计数法测得菌液浓度为4.7×1010 cfu/L, 即应用于实验. SPF级6-8 wk昆明小鼠39只(雌性20只, 雄性19只), 由本校实验动物中心提供. 实验组24只, 又随机分成3组, 分别为12 h组、32 h组和72 h组, 每组8只; 每个不同时间组各5只作为对照, 即对照组小鼠共15只. 实验组及对照组小鼠实验前均禁食12 h.
取已灭菌的装有小鼠灌胃针头的1 mL注射器, 吸取Vv悬液0.8 mL, 抓取小鼠, 将针头置于小鼠口腔内(灌胃针头末端圆钝, 可避免损伤小鼠), 缓慢推进注射器, 使Vv悬液滴入小鼠口腔, 强制喂食, 每只实验组小鼠被喂食0.6 mL的Vv悬液. 用同样的方法给每只对照组小鼠喂进0.6 mL已灭菌的35 g/L NaCl碱性蛋白胨水. 密切观察小鼠, 包括毛发、精神状态、体温、进食量和排便量及大便性状等一般情况. 喂食后12 h断椎法处死实验组里12 h组8只小鼠及对照组5只小鼠, 并按徐景野et al[4]的方法对处死小鼠的胃肠组织用两种方法进行了Vv的分离培养, 一种是直接分离法, 即取每只处死小鼠的部分食管、胃及肠组织分别无菌碾碎后, 不经增菌培养, 直接将组织匀浆划线接种于弧菌选择性培养基硫代硫酸盐-枸橼酸盐-胆盐-蔗糖琼脂(thiosulfate-cifrate-bile salt-sucrose, TCBS)平板; 另一种是增菌分离法, 即将上述碾碎组织匀浆先分别接种于35 g/L NaCl碱性蛋白胨水中, 36℃过夜增菌后, 划线转种于TCBS平板. 另将每只小鼠余下的食管、肠及部分胃组织固定于40 g/L甲醛溶液中, 并按常规方法制成HE切片进行病理学观察. 再将上述未固定的胃组织用pH值为7.4的PBS缓冲液反复冲洗后置于25 g/L的戊二醛溶液中固定, 4℃过夜, 经过梯度丙酮脱水, 乙酸异戊酯置换, 临界点干燥后喷金进行扫描电镜观察(日立S-450, 本校电镜室).32 h组和72 h组的处理方法同12 h组. 在体外将上述用于饲喂小鼠的Vv菌悬液离心, 去上清, 加入灭菌的含9 g/L NaCl的酸性溶液(已用盐酸将其pH值调至2.2, 与小鼠胃环境pH值接近), 摇匀, 处理4 h后, 取一滴滴于玻片上, 革兰染色, 进行光镜观察, 余下的离心去上清后, 加入6 mL已灭菌的35 g/L NaCl碱性蛋白胨水作增菌培养. 在进行动物实验前, 我们也对Vv 1.1758菌体进行了透射电镜观察(日本电子JEM-1200, 本校电镜室), 方法为将上述恢复培养后的Vv悬液离心, 使Vv在离心管底部成团块, 吸出上清, 取Vv团块进行常规透射电镜脱水、染色以及超薄切片后观察.
实验组小鼠在喂食后均先后不同程度的出现了竖毛、少动及进食量减少的情况, 但在喂食24 h后, 上述情况都恢复正常. 且在实验过程中, 实验组小鼠的排便量及大便性状并未发生改变, 无呕吐, 体温也未见升高. 对照组小鼠无异样.
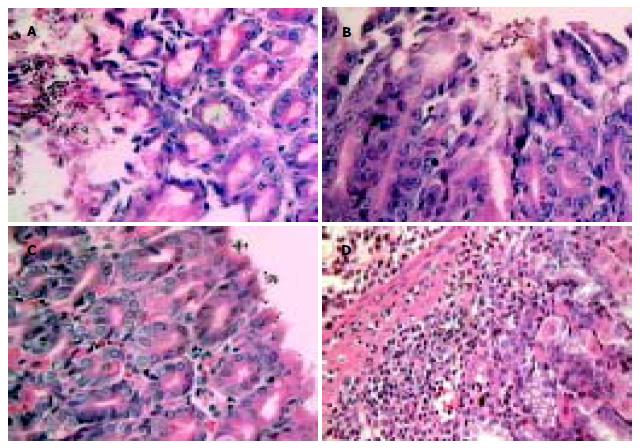
实验组12 h组8只小鼠及32 h组8只小鼠的胃组织均可见部分胃黏膜表面附着有数量不等Vv菌体, 大部分菌体明显肿胀变形, 弧形消失, 呈椭圆形或圆形, 且菌体附着处胃黏膜腺上皮细胞出现脱落和溶解坏死, 但病变仅限于黏膜层表面, 黏膜下层、肌层及浆膜层均未见Vv菌体.12 h组Vv菌数量较多, 胃黏膜上皮细胞溶解坏死也较明显(图1A), 在黏膜层深处及固有膜内可见较多的中性粒细胞浸润以及血管扩张充血(图1D); 32 h组Vv数量明显减少, 且胃黏膜病变有所减轻(图1B); 而72 h组已不见或仅见极少量的Vv, 胃黏膜已基本恢复正常(图1C). 实验组24只小鼠的食管及肠组织均未见明显病理学改变. 对照组15只小鼠食管、胃及肠组织均未见异常, 胃黏膜表面亦未见Vv菌体.
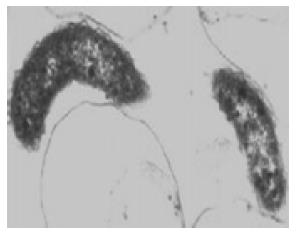
实验组小鼠(12 h组)部分胃黏膜表面见数量较多的Vv, 菌体肿胀变形, 且肿胀程度不一, 呈圆球或橄榄球状(图2), 与光镜下的形态相符. 对照组未见上述Vv菌体.
实验组小鼠食管、胃及肠组织的Vv分离培养结果均为阴性, 即增菌后划线转种于TCBS平板上未见菌落生长. 对照组也为阴性. 体外强酸低盐处理后, 在光镜下见Vv肿胀变形, Vv增菌培养结果为阴性. 正常Vv弯曲, 呈弧形或杆状, 菌体表面未见荚膜层(图3).
Vv感染主要表现为败血症及蜂窝组织炎等, 一旦出现败血症, 死亡率都大于50%[5-10], 而Vv单独引起胃肠炎的病例却极少. 那么为什么Vv与本属其他菌不同, 例如霍乱弧菌[11], 副溶血弧菌[12]等, 在经食管感染该菌后很少出现或者不出现消化道症状呢?我们知道, Vv为嗜盐性海生弧菌, 最适合其生长的盐度为3%-6%, 无盐或盐度超过8%均不能生长[13], 且适合在碱性环境中生长. 而在本实验中, Vv经过食管进入小鼠胃以后, 强酸低盐的胃环境并不适合Vv的生长, 甚至可以将其杀灭. 这一点可通过以下的结果来证明: (1)在光镜下我们可以看到, 实验组小鼠胃黏膜表面附着有Vv, 且大部分菌体肿胀变形, 而在胃组织黏膜层深部以下各层及细胞内均未查见Vv, 说明进入小鼠胃内的Vv已丧失运动能力. 另外通过对胃黏膜表面的扫描电镜观察, 也同样看到呈圆球或橄榄球状肿胀变形的Vv菌体. 而对照组小鼠胃黏膜表面未见上述菌体. (2)实验组小鼠胃及肠组织的Vv分离培养结果均为阴性. (3)体外模拟小鼠胃环境处理Vv后, 光镜也可以观察到其肿胀, 变形, 并且将处理后的Vv作增菌培养结果亦为阴性. 因此, 进入小鼠胃环境的Vv实际上大部分已丧失其正常的生物学活性, 尤其是丧失其运动活性, 并且不能生长繁殖, 因此Vv并不能像霍乱弧菌那样经食管感染小鼠后, 在肠道大量繁殖, 他在强酸性的胃环境中已大部分被杀灭, 因此, 也就没有Vv在肠道大量繁殖从而也不会引起相应的消化道症状. 在本实验中, 我们还看到Vv对其附着处的胃黏膜造成了损伤. 已有研究表明, Vv产生的一系列酶及毒素是其重要的毒力因素, 例如弹性蛋白酶和胶原酶、溶细胞素以及卵磷脂酶等, 他们分别与感染局部组织的坏死、细胞的溶解以及细胞线粒体膜的溶解密切相关[14-19]. 而本实验中Vv附着处的胃黏膜损伤就表现为黏膜坏死脱落, 腺上皮解离, 细胞坏死溶解, 但是这些损伤表现为一过性和局限性, 随着时间的推移, 损伤减轻明显, 并且可完全恢复. 在本实验中, Vv到达胃以后, 大部分会被强酸性的胃环境灭活, 但灭活不是一瞬间就可以达到, 而且到达胃的Vv有一定的数量, 那么在这个过程里, 没被灭活的Vv有可能在附着处释放以上毒素和酶, 损伤局部胃黏膜. 损伤因素并不是持续存在的, 当大多数Vv被杀灭后, 就没有上述的毒素和酶释放出来. 并且本实验所使用的Vv菌株(编号1.1758), 我们通过透射电镜观察发现其为无荚膜株, 而无荚膜的创伤弧菌一般只具有较弱的致病性[16,20]. 因此, 本实验中Vv对实验组小鼠胃黏膜的损伤就表现为上述的一过性和局限性. 本实验结果证明, 1.1758创伤弧菌株属消化道感染弱毒力致病株. 此外, 感染Vv后对机体的影响除了与Vv本身的毒力有关外, 还与感染的菌量及机体的免疫力密切相关. 免疫力低下尤其是慢性肝病患者是发生创伤弧菌食物中毒的高危人群[21-23]. 本实验已证明1.1758Vv株经食管感染小鼠后可对小鼠胃黏膜造成轻度损伤, 其损伤程度的进一步量化研究可应用超微病理学技术结合定量病理学技术来进行[24-25].
编辑: 张海宁 电编: 潘伯荣
| 1. | Johnson RW, Arnett FC. A fatal case of Vibrio vulnificus presenting as septic arthritis. Arch Intern Med. 2001;161:2616-2618. [PubMed] |
| 2. | Sie MY, Ip-yam PC, Oon LL. Vibrio vulnificus septicaemia. Anaesth Intensive Care. 2002;30:77-81. [PubMed] |
| 5. | Bisharat N, Agmon V, Finkelstein R, Raz R, Ben-Dror G, Lerner L, Soboh S, Colodner R, Cameron DN, Wykstra DL. Clinical, epidemiological, and microbiological features of Vibrio vulnificus biogroup 3 causing outbreaks of wound infection and bacteraemia in Israel. Israel Vibrio Study Group Lancet. 1999;354:1421-1424. [PubMed] |
| 6. | Nakafusa J, Misago N, Miura Y, Kayaba M, Tanaka T, Narisawa Y. The importance of serum creatine phosphokinase level in the early diagnosis, and as a prognostic factor, of Vibrio vulnificus infection. Br J Dermatol. 2001;145:280-284. [PubMed] |
| 7. | Sato T, Inatomi Y, Yonehara T, Fujioka S, Hashimoto Y, Hirano T, Uchino M. A patient with Vibrio vulnificus meningoen-cephalitis. Rinsho Shinkeigaku. 2005;45:18-21. [PubMed] |
| 10. | Midturi J, Baker D, Winn R, Fader R. Tubo-ovarian abscess caused by Vibrio vulnificus. Diagn Microbiol Infect Dis. 2005;51:131-133. [PubMed] |
| 14. | Hiady WG, Klontz KC. The epidemiology of Vibrio infections in florida, 1981-1993. J Infec Dis. 1996;173:1176-1183. [PubMed] |
| 15. | Miyoshi SI, Narukawa H, Tomochika K, Shinoda S. Actions of Vibrio vulnificus metalloprotease on human plasma proteinase- proteinase inhibitor systems: a comparative study of native protease with its derivative modified by polyethylene glycol. Microbial Immunol. 1995;39:959-966. [PubMed] |
| 16. | Hayat U, Reddy GP, Bush CA, Johnson JA, Wright AC, Morris JG Jr. Capsular types of Vibrio vulnificus: an analysis of strains from clinical and environmental sources. J Infect Dis. 1993;168:758-762. [PubMed] |
| 17. | Lee SE, Ryu PY, Kim SY, Kim YR, Koh JT, Kim OJ, Chung SS, Choy HE, Rhee JH. Production of Vibrio vulnificus hemolysin in vivo and its pathogenic significance. Biochem Biophys Res Commun. 2004;324:86-91. [PubMed] |
| 18. | Lee JH, Rho JB, Park KJ, Kim CB, Han YS, Choi SH, Lee KH, Park SJ. Role of flagellum and motility in pathogenesis of Vibrio vulnificus. Infect Immun. 2004;72:4905-4910. [PubMed] |
| 20. | Joseph LA, Wright AC. Expression of Vibrio vulnificus capsular polysaccharide inhibits biofilm formation. J Bacteriol. 2004;186:889-893. [PubMed] |
| 21. | Vibrio vulnificus infections associated with eating raw oysters-Los Angeles, 1996. Morb Mortal Wkly Rep. 1996;45:621-624. [PubMed] |
| 22. | Izumikawa K, Hazama H, Izumikawa K, Hara K, Miyazaki Y, Kamihira S, Kohno S. A case of a sudden death from Vibrio vulnificus septicemia in a patient with liver cirrhosis. Kansenshogaku Zasshi. 1999;73:1159-1162. [PubMed] |
| 23. | Stabellini N, Camerani A, Lambertini D, Rossi MR, Bettoli V, Virgili A, Gilli P. Fatal sepsis from Vibrio vulnificus in a hemodialyzed patient. Nephron. 1998;78:221-224. [PubMed] |
| 25. | 申 洪, 沈 忠英. 实用病理学技术. 第一版. 广州: 中山大学出版社 1991; 64-89. |