修回日期: 2005-01-28
接受日期: 2005-02-02
在线出版日期: 2005-03-15
目的: 探讨丹芍化纤方抗肝纤维化的作用机制.
方法: 采用Ⅳ型胶原酶消化及Ficoll密度梯度离心的方法, 分离、培养大鼠肝细胞, 加入5%、10%、20%药物血清干预体外培养的肝细胞, 用MTT法测定肝细胞的增生, 荧光实时定量PT-PCR(Real Time RT-PCR)法检测肝细胞内天冬氨酸特异的半胱氨酸蛋白酶-3(caspase-3)mRNA表达, 并检测培养上清中的白蛋白.
结果: 丹芍化纤方药物血清对肝细胞的增生及白蛋白合成有促进作用, 能显著下调肝细胞内caspase-3mRNA的表达, 其表达水平与正常大鼠血清组比较有显著性差异, 呈明显的浓度依赖关系.
结论: 丹芍化纤方发挥抗肝纤维化作用与其促进肝细胞增生、蛋白合成功能, 抑制肝细胞凋亡有关.
引文著录: 吴亚云, 耿晓霞, 程明亮. 丹芍化纤方对体外大鼠肝细胞增生、Caspase-3mRNA及白蛋白合成的影响. 世界华人消化杂志 2005; 13(6): 781-783
Revised: January 28, 2005
Accepted: February 2, 2005
Published online: March 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 781-783
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/781.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.781
肝脏损伤-肝实质炎症、坏死-HSC激活-大量细胞外基质沉积是肝纤维化发生机制的中心环节[1]. 肝细胞凋亡与肝细胞坏死不仅贯穿整个病变过程, 且可导致肝损伤继而导致肝纤维化, 是肝纤维化发生发展的始动因素[2]. 因此, 保护肝细胞、防止其变性、坏死, 促进肝细胞功能恢复, 在慢性肝病的治疗中具有重要意义. 临床及动物实验研究已证明丹芍化纤方具有抗肝纤维化作用[3-4], 但具体作用机制尚未完全阐明. 我们通过观察丹芍化纤方药物血清对肝细胞增生、凋亡及蛋白合成的影响, 旨在探讨丹芍化纤方抗肝纤维化的作用机制.
Wistar 雄性大鼠, 体重200-350 g, 由贵阳医学院动物实验中心提供. 丹芍化纤胶囊由贵阳制药厂生产, 主要成分为汉防已甲素、丹勺、赤芍、黄芪、银杏叶等, 临用前倾出胶囊内粉末内容物, 用蒸馏水稀释至所需浓度.Ⅳ型胶原酶、RPMI-1640培养基干粉、MTT(Sigma公司); 小牛血清(杭州四季青公司); 淋巴细胞分离液(Ficoll)(上海华精生物公司); 培养板(Nunc公司); 促肝细胞生长素(广东阳江制药厂); 糖原染色试剂盒(上海红桥医用试剂实验研究所).10×PCR Buffer II、10 mmol/LdNTP、50 μmol/LOligo dT、20 U/μLRNase Inhibitor、50 U/μL MuLv(RNA反转录酶)、SYBR green DNA PCR试剂盒、caspase-3及内参照β-action引物均由美国国立卫生研究院癌症/环境卫生研究所刘杰博士惠赠. 引物序列如下: caspase3 Forward primer: 5'-TGCGCCATGCTGAAACTG-3'Reverse primer: 5'-TGGCCACCTTCCGGTTAAC-3'β-action Forward primer: 5'-TCCTCCTGAGCGCAAGTACTCT-3'β-action Reverse primer: 5'-GCTCAGTAACAGTCCGCCTAGA-3'
1.2.1 丹芍化纤方药物血清的制备[5]: 10只大鼠随机分为正常组、丹芍化纤方给药组, 每组各5只. 给药组按1 g/kg·d予丹芍化纤胶囊粉末内容物(相当于临床用药量的16倍)灌胃, 正常组按1 g/kg·d灌以生理盐水, 2次/d, 连续3 d, 于末次给药后2 h再重复灌胃1次, 第2次灌胃1 h后股动脉取血, 1 500 r/min离心15 min, 混匀同组大鼠血清, 56℃水浴30 min灭活补体, 滤过除菌, 分装后, 置于-80℃冷藏备用.
1.2.2 肝细胞的分离与鉴定: 用10 g/L巴比妥钠(30 mg/kg)腹腔注射麻醉, 同时腹腔注射5000U肝素钠抗凝.麻醉生效后, 用碘酒、酒精消毒, 打开腹腔, 用静脉输液管行门静脉插管, 灌入D-Hank's液(15 mL/min), 同时剪断下腔静脉放血. 灌注至肝完全变为土黄色后, 小心分离肝脏, 移于平皿中用0.5 g/LⅣ型胶原酶继续循环灌注, 至肝脏表面出现细小的液泡时剥去包膜, 小心取下肝脏, 剪碎. 吸肝组织悬液于100 mL三角烧瓶中37℃水浴箱中震荡消化20 min, 200目钢网过滤. 滤液离心(500 r/min, 1-2 min)洗涤3-4次, 5 mL沉淀物重层于4倍体积的49.2%(V/V)Ficoll液上部, 500 r/min进行梯度离心5 min. 吸弃上清, 用RPMI-1640液沉洗2-3次, 沉淀细胞悬浮于RPMI-1640培养液中. 新分离的肝细胞用4 g/L台盼蓝溶液染色, 鉴定细胞活力并计算细胞数. 点涂片, 片干后用700 mL/L酒精固定约15 min, 行糖原染色(PAS染色)鉴定细胞的纯度[6]. 阳性细胞于细胞质中见密集粉红色糖原颗粒, 胞核呈空泡状. 将原代肝细胞用含100 mL/L小牛血清、胰岛素5 mg/L、促肝细胞生长素20 mg/L、氢化可的松10-6 mol/L、L-谷氨酰氨30 g/L、Hepes50 mmol/L、青霉素1×105U/L、链霉素100 mg/L的1640培养液配成2.5×108/L浓度.
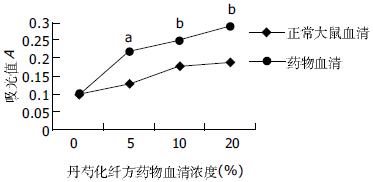
1.2.3 MTT比色法测定肝细胞的增生: 将浓度为2.5×108/L的原代肝细胞以每孔100 μL接种于96孔Nunc培养板中.37℃、50 mL/L CO2孵育箱中预培养24 h后, 加入不同浓度的正常大鼠血清和丹芍化纤方药物血清, 每组设5复孔. 孵育48 h后, 每孔加入5 g/L的MTT液20 μL. 继续孵育4 h, 每孔加入DMSO 200 μL, 稍振荡后, 用酶标仪分别于波长492 nm测其吸光值(A).
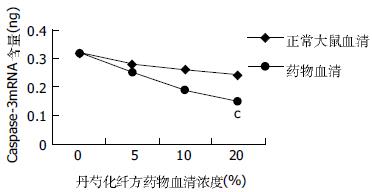
1.2.4 肝细胞内Caspase-3mRNA表达的检测: 将浓度为2.5×108/L原代肝细胞接种于24孔培养板中, 每孔1 mL.预培养24 h后, 每孔依次加入不同浓度的正常大鼠血清和丹芍化纤方药物血清, 继续孵育48 h后, 吸弃培养上清, 每孔加入1 mL Trizol, 反复吹洗, 收集细胞悬液, 然后按以下步骤检测caspase-3 mRNA表达情况: (1)提取、纯化各组肝细胞的总RNA: 按TRIzol Reagent 说明书进行, 用紫外分光光度计检测总RNA纯度(RNA样品A260/A280≥2.0), 再计算其浓度. (2)逆转录合成cDNA: 100 μL的反应体系中, 25 mmol/L MgCl2 22 μL, 10×PCR Buffer II 10 μL, 10 mmol/L dNTP 20 μL, 50 μmol/L Oligo dT 5 μL, 2×107 U/L RNase 抑制剂 2 μL, 5×107 U/L MuLv(RNA逆转录酶)2.5 μL, 最后补RNase-free H2O至100 μL. 于PCR仪上逆转录合成cDNA, 反应条 件: 25℃ 10 min→48℃ 60 min→95℃ 5 min→4℃ 保存. (3)荧光实时定量PCR: 25 μL的反应体系中, 2×Buffer 12.5 μL, 正向引物(100 μmol/L)0.5 μL, 反向引物(100 μmol/L)0.5 μL, RNase-free H2O 6.5 μL, 样本cDNA5 μL. 于定量PCR仪上进行PCR反应, 条件如下: 50℃ 2 min, 95℃ 10 min(1个循环)→95℃ 15 s, 60℃ 1 min(40个循环). 反应结束后分析PCR过程中各样本Ct值, 绘制标准曲线, 以β-action为内参照, 按参考文献[7]计算出各组mRNA含量(ng).
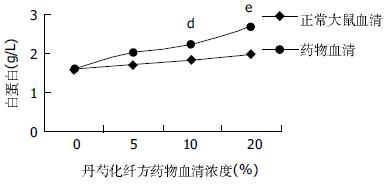
1.2.5 肝细胞合成白蛋白的测定: 将浓度为2.5×108/L原代肝细胞接种于24孔培养板中, 每孔1 mL, 预培养24 h后, 每孔依次加入不同浓度的正常大鼠血清和丹芍化纤方药物血清, 继续孵育48 h后, 收集培养上清, 经1 000 r/min离心3 min后, 装入透析袋中浓缩24 h, 用溴甲酚绿法于Beckman全自动生化分析仪上测定白蛋白含量.
统计学处理 计量资料以mean±SD表示, 采用t检验.
采用Ficoll密度梯度离心平均每只大鼠获取2.3×108个肝细胞, 台盼蓝溶液染色鉴定细胞活力达90%以上, 纯度98%以上. 用倒置相差显微镜对培养肝细胞进行连续动态观察发现: 新分离的肝细胞呈圆形、折光性强、有立体感. 接种后12 h开始贴壁、伸展; 24 h后95%以上细胞贴壁, 由球形转变为梭形或多边形, 体积增大; 48 h后细胞贴壁牢固, 部分细胞呈双核, 相互连接呈串状; 72 h后细胞明显增多, 铺满培养板, 并进一步相互连接成片岛状, 一直维持至第7 d; 第8-9 d培养上清中见较多漂浮细胞, 贴壁肝细胞越来越少, 逐渐出现颗粒化, 细胞形态不规则, 大部分细胞内有空泡形成; 培养至12 d左右细胞几乎从培养板上全部脱落, 漂浮于培养基中.
正常大鼠血清及丹芍化纤方药物血清对肝细胞的增生均有促进作用, 随浓度增高, 增生逐渐增强, 呈浓度依赖关系; 与相同浓度的正常大鼠血清比较, 丹芍化纤方药物血清促肝细胞增生作用更明显(图1).
培养基对照组肝细胞内均有一定量caspase-3mRNA表达, 正常大鼠血清组及丹芍化纤方药物血清组肝细胞内caspase-3mRNA含量随血清浓度增加有下降趋势, 尤以20%丹芍化纤方药物血清浓度组为甚(图2).
正常大鼠血清及丹芍化纤方药物血清均具有促进肝细胞合成白蛋白的作用, 随血清浓度增高, 合成功能逐渐增强, 呈浓度依赖关系; 与相同浓度的正常大鼠血清比较, 丹芍化纤方药物血清促进肝细胞合成白蛋白的作用更明显(图3).
临床及动物实验研究虽已证明丹芍化纤方具有保护肝细胞和抗肝纤维化作用, 由于体内研究受众多因素影响, 不能准确反映药物对肝细胞的影响, 肝细胞培养技术因可控制其外界环境的理化因素实现稳定条件下药物和其他作用的观察及检测而作为一种体外研究手段, 越来越多地被应用于肝毒性物质的筛选、护肝药的活性鉴定、机制分析及病毒转染等研究. 培养的肝细胞中如混有较多的间质细胞如枯否氏细胞、肝星状细胞, 这些细胞贴壁后占据了大量的空间, 肝细胞会因没有贴壁空间而死亡, 因此, 获取高纯度、高活力的肝细胞是体外实验成功的基础. 我们在Seglen原位二步酶灌流法基础上联合Ficoll密度梯度离心方法分离肝细胞, 其纯度98%以上, 细胞活力达90%以上, 确保了实验结果的准确性.
MTT是由活细胞线粒体内脱氢酶转化为难溶性的蓝紫色结晶物, 转化量的多少反映活细胞的数量, 可较好地用于细胞增生的测定, A值越高, 细胞的增生越强. 我们通过用MTT法对丹芍化纤方药物血清干预的体外培养正常大鼠肝细胞的增生进行测定, 结果显示: 丹芍化纤方药物血清较正常大鼠血清能显著地促进肝细胞的增生, 血清浓度越高, 对肝细胞增生的促进作用越强, 呈浓度依赖关系, 说明丹芍化纤方具有促进肝细胞再生作用, 有助于肝损伤时肝细胞的修复.
细胞凋亡是在基因调控下细胞主动死亡的过程. 在凋亡过程中的caspase联级反应中, caspase-3起效应性, 是细胞凋亡中公共的下游效应因子, 即凋亡下游的关键执行者, 在细胞凋亡中扮演重要角色. 激活的caspase-3可进一步切割各种蛋白底物蛋白使细胞最终走向死亡[8-9], 因此, 检测细胞内caspase-3的变化可作为判断细胞凋亡干预措施是否有效的可靠指标, caspase-3mRNA的表达与细胞凋亡呈正相关, 采用荧光实时定量PT-PCR 定量检测caspase-3, 可克服形态学方法不能精确定量、亦不能很好地区别细胞的凋亡和坏死, 具有一定的假阳性等缺点[10]. 我们结果表明: 随血清浓度增高, 丹芍化纤方药物血清较正常大鼠血清能显著下调肝细胞caspase-3mRNA的表达, 影响了蛋白酶的切割过程, 进而防止肝细胞凋亡和坏死的发生, 与整体动物实验结果一致[11]. 细胞凋亡过程中的caspase激活涉及两条途径, 即细胞表面死亡受体途径及线粒体途径, 有关丹芍化纤方是通过何种信号转导途径调控肝细胞凋亡, 有待进一步研究.
白蛋白是肝细胞特异分泌的功能性蛋白, 仅能由肝细胞合成. 肝损害时, 由于白蛋白的合成、细胞内运输和释放发生障碍, 引起血清白蛋白减少, 因此, 血清白蛋白水平变化可反映肝实质损坏的程度. 我们的结果显示: 随丹芍化纤方药物血清浓度增高, 肝细胞培养上清的白蛋白浓度增加, 亦呈浓度依赖关系, 与整体动物实验结果吻合[1], 提示丹芍化纤方具有促进肝细胞合成、分泌蛋白的能力.
总之, 通过实验我们可以看出, , 丹芍化纤方抗肝纤维化作用原因之一在于其具有促进肝细胞增生、合成功能, 保护肝细胞、防止其凋亡、变性和坏死作用, 减少了引起肝纤维化的启动刺激因素.
本实验细胞培养部分在贵阳医学院免疫与干细胞中心完成, 得到左丽教授、赵星助教等同志的大力帮助, 在此一并致谢!
编辑: 张海宁
| 2. | Canbay A, Friedman S, Gores GJ. Apoptosis: the nexus of liver injury and fibrosis. Hepatology. 2004;39:273-278. [PubMed] |
| 4. | Cheng ML, Lu YY, Wu J, Luo TY, Ding YS. Clincal study on reversing hepatic fibrosis with Handan Ganle capsule. CJIM. 2001;7:16-18. |
| 7. | Liu W, Saint DA. A new quantitative method of real time reverse transcription polymerase chain reaction assay based on simulation of polymerase chain reaction kinetics. Anal Biochem. 2002;302:52-59. [PubMed] |
| 10. | 张 勇, 沈 佰华, 余 奇文, 马 安伦, 李 宁丽, 张 冬青. 用荧光定量检测caspase-3的活性. 细胞与分子免疫学杂志. 2001;17:188-190. |