修回日期: 2005-01-16
接受日期: 2005-01-26
在线出版日期: 2005-03-15
目的: 构建表达人TGF-β1Ⅱ型受体细胞外结合区和人IgG1 Fc的融合蛋白逆转录病毒载体, 为进一步肝纤维化的基因治疗奠定实验基础.
方法: 以RT-PCR方法扩增目的基因TβRⅡ-IgG1 Fc, 扩增产物纯化后克隆至测序载体pGEM-T-Easy, 挑取阳性克隆酶切鉴定后测序;利用重组DNA技术, 将TβRⅡ-IgG1 Fc基因亚克隆至逆转录病毒载体pLXSN中, 重组质粒pL(TβRⅡ-IgG1 Fc)SN在脂质体介导下转染PA317包装细胞, G418筛选, 直至出现抗性克隆, 扩大培养, 测定病毒滴度.
结果: 经测序、限制性酶切分析及PCR方法鉴定, 载体插入基因序列、大小、位置均正确, 并用PA317细胞进行包装、病毒滴度测定、筛选, 建立具有较高滴度的感染性重组病毒产生细胞系.
结论: 成功构建了重组质粒pL(TβRⅡ-IgG1 Fc)SN, 可望为肝纤维化的基因治疗提供有效途径.
引文著录: 高巍, 周永兴, 张惠中, 聂青和. 可溶性TGF-β1II型受体逆转录病毒表达载体的构建. 世界华人消化杂志 2005; 13(6): 760-765
Revised: January 16, 2005
Accepted: January 26, 2005
Published online: March 15, 2005
AIM: To construct recombinant human retroviral vector carrying soluble TGFβ1 Type II receptor (TβR II) gene.
METHODS: The cDNA fragments of human TβRII and IgG1 Fc were amplified by RT-PCR from total RNAs of peripheral blood mononuclear cells. The purified cDNA fragments were ligated and subcloned into vector pGEM-T-Easy to get the fusion gene of TβRII-IgG1Fc. The fusion gene was then subcloned into retroviral vector pLXSN. The obtained recombinant retroviral vector pL (TβRII-IgG1-Fc) SN was transfected into PA317 cells and selected with G418. The stable expression of the TβRII-IgG1-Fc fusion gene in positive clones was identified by RT-PCR.
RESULTS: The restriction endonuclease digestion results and DNA sequencing indicated that the retroviral vector pL (TβRII-IgG1 Fc) SN was successfully constructed. The TβRII-IgG1 Fc fusion gene was integrated into the PA317 genome and expressed stably in the host cells.
CONCLUSION: The target retroviral vector pL(TβRII-IgG1 Fc) SN was constructed successfully. It provides an effective tool for gene therapy and will lay a foundation for clinical treatment of liver fibrosis.
- Citation: Gao W, Zhou YX, Zhang HZ, Nie QH. Construction of expression vector containing TGF-βRII-IgG1 Fc genes. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 760-765
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/760.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.760
肝纤维化的形成是一系列作用的结果[1-3], 转化生长因子-β1(transforming growth factorβ1, TGF-β1)与肝纤维化的发生有密切的关系, 是最强的肝纤维化促进因子[4-9], TGF-β1与TGF-β受体(TβR)结合而发挥作用, TβR由三部分组成, 细胞外部分与TGF-β1结合, 通过跨膜蛋白使胞质内部分-丝氨酸/苏氨酸激酶激活, 直接参与TGF-β1的信号转导[10]. 一旦其特异的膜受体缺乏细胞内激酶区, 其生物学效应就不能下传. 抑制TGF-β1信号传导可能是很有价值的治疗肝纤维化的方法[11]. 我们运用基因重组技术构建表达人TGF-β1Ⅱ型受体细胞外结合区和人IgG1 Fc的融合蛋白的真核细胞表达载体, 为进一步肝纤维化的基因治疗奠定实验基础.
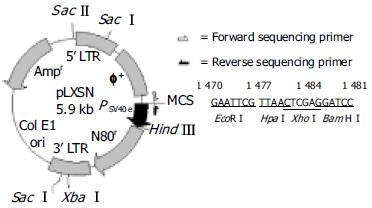
E. coli JM109购自Promega公司 E. coli DH5α购自Invitrogen公司; 克隆载体pGEM-T-easy购自Promega公司; pLXSN逆转录病毒表达载体由第四军医大学唐都医院全军骨肿瘤研究所张惠中副教授惠赠, 其上LTR(long terminal repeated sequence)下四个多克隆位点依次为EcoRI、HpaI、XhoI、BamHI. (图1)逆转录病毒包装细胞PA317细胞购自美国ATCC公司. 限制性内切酶、T4DNA连接酶、X-gal及IPTG: GIBCO公司. Tag DNA聚合酶: 上海生物工程有限公司产品. 质粒提取及纯化试剂盒WizardTM Plus Minipreps, PCR片段回收及纯试剂盒WizardTM Mini-column均购自Promega公司. 逆转录酶、Trizol购自GIBCO公司. 脂质体转染试剂盒Lipofect amine 2000购自Gibco公司. DMEM: Gibco公司. 小牛血清: 杭州四季青生物工程材料研究所. 引物合成及cDNA测序由上海基康生物工程公司完成.
根据人的TGF-β1II型受体、人IgG1全基因序列[12]设计PCR扩增的内外两组引物, 通过RT-PCR获得人TβRII基因细胞外片段和IgG1FC片段. 引物序列P1: 5'GGAATTCACCATGGGTCGGGGGCTGCTCAGGGGC-3, P2: 5'-GCACGGTGGGCATGTGTGAGTTTTGTCCAACAAGTCAGGATTGCTGGTGTTAT-3', P3: 5'-ATAACACCAGCAATCCTGACTTGTTGGACAAAACTCACACATGCCCACCGTGC-3'P4: 5'-GGGATCCTCATTTACCCGGAGACAGGGAGAGGCTCTTC-3. 划线部分为设计的酶切位点EcoRI和BamHI, P2和P3中斜体的部分分别为人IgG1 Fc序列和TβRII的互补序列. IgG1 Fc和TβRII细胞外结合区的融合片段, 以P1/P2, P3/P4联合PCR产物为模板, 以P1, P4为引物, 通过复式PCR获得. 以上引物由上海基康生物工程公司合成. 取健康成人外周血20 mL, 分离外周血淋巴细胞, 普通RPMI1640常规培养, 加PHA 5 mg/L培养3 d, 1 000 r离心10 min沉淀后重悬细胞加IL-2 100 kU /L传代培养, 以刺激细胞生长, 培养6 d观察细胞大量生长, 离心、洗涤、沉淀后以TrizoL试剂提取PBMC总RNA, 以反转录体系经RT-PCR制备PBMC cDNA.
1.2.1 目的基因的扩增和克隆: 以PBMC cDNA为模板, PCR反应条件: 94℃ 5 min, TβRII为60℃, IgG1 Fc为64℃, 融合片段为55℃ 2 min, 72℃ 2 min后94℃ 1 min, TβRII为60℃, IgG1 Fc为64℃, 融合片段为55℃ 1 min, 72℃ 2 min 35个循环, 最后72℃继续延伸10 min. 取PCR产物4 μL, 在含0.5 mg/L溴化乙锭(EB)的琼脂糖凝胶(15 g/L)中电泳分析, 紫外观测仪观察结果. 将上述PCR扩增产物进行低熔点琼脂糖凝胶电泳, 以WizardTMMini-column试剂盒回收纯化片段, 与pGEM-T-Easy测序载体按3: 1比例连接, 4℃连接反应过夜. 制备JM109感受态宿主菌, 冰浴条件下加入上述连接产物5 μL, 冰浴30 min, 42℃休克90 s后, 迅速冰浴2 min, 加LB培养液800 μL, 37℃保温1 h, 涂布于含有氨苄青霉素(100 mg/L), X-gal, IPTG的LB琼脂平板, 37℃培养15 h后经蓝白斑筛选后随机挑选. 命名为pGEM/ TβRⅡ-IgG1 Fc, 酶切鉴定. 选择酶切鉴定符合的克隆作为阳性克隆, Mini-column纯化质粒, 用通用引物T7 Primer进行双向测序.
1.2.2 pL(TβRⅡ-IgG1 F c)SN构建: 首先制备线性化双粘末端的pLXSN载体. EcoRI和BamHI双酶切载体pLXSN, 37℃ 4 h后以低熔点琼脂糖凝胶回收载体片段, WizardTMMinicolumn纯化. 再制备线性化双粘末端的TβRⅡ-IgG1 Fc基因片段. EcoRI和BamHI双酶切含TβRⅡ-IgG1 Fc基因的正确重组子pGEM/TβRⅡ-IgG1 Fc质粒, 37℃ 4 h后以低熔点琼脂糖凝胶回收大小约1.1 kb基因片段, WizardTMMinicolumn纯化. 将上述纯化的TβRⅡ-IgG1 Fc基因片段与线性化双粘末端的pLXSN载体片段以3: 1的比例连接.4℃连接反应过夜. 最后制备DH5α感受态宿主菌, 冰浴条件下加入上述连接产物, 冰浴30 min, 42℃休克90 s后, 迅速冰浴2 min, 加LB培养液800 μL, 37℃保温1 h, 涂于氨苄青霉素抗性的LB平板上, 37℃培养过夜.
随机挑取上述连接产物转化的单个菌落, 扩大培养, 碱裂解法小量快速提取载体DNA, EcoRI和BamHI双酶切载体pL(TβRⅡ-IgG1 Fc)SN, 酶切产物于15 g/L琼脂糖凝胶电泳, EB染色, 紫外透射仪观察结果. 并送测序鉴定.
1.2.3 重组PLXSN载体的包装及病毒滴度测定: 活化重组pL(TβRⅡ-IgG1 Fc)SN宿主菌单个菌落, 接种于5 mL LB培养液中培养过夜, Minicolumn纯化质粒, 溶于无菌Nuclease-Free水50 μL中. 加1/10倍体积的3 mol/L乙酸钠, 2.5倍体积的无水乙醇, 混匀后置于-70℃(>30 min)后14 000 g离心, 弃上清, 700 mL/L乙醇于超净台内冲洗晾干, 溶于无菌Nuclease-Free水60 μL中备转染用. PA317细胞于HAT培养液中选择性培养5 d, 换以HT培养液过渡培养4 d, 转入含100 mL/L牛血清的普通DMEM培养液中培养. 在转染前1 d, 选择生长状态良好的细胞, 用2.5 g/L胰蛋白酶消化后将6×105细胞接种于90 mm培养皿中, 置37℃, 50 mL/L CO2孵箱内培养24 h. 转染前4 h换10 mL新鲜完全DMEM培养液, 置37℃, 50 mL/L CO2孵箱内培养. 取5 μg纯化的重组pL(TβRⅡ-IgG1 Fc)SN质粒稀释于无血清的DMEM培养液250 μL中, LF2000转染试剂4 μL稀释于无血清的DMEM培养液250 μL中, 将二者混匀, 室温孵育20 min后将混合物逐滴加入接种PA317细胞的培养皿中, 置37℃, 50 mL/L CO2孵箱内培养16 h, 换完全DMEM培养液继续培养36 h. 换含有500 mg/L G418的完全DMEM培养液.5 d换液1次, 直至抗性细胞集落形成, 挑选细胞集落, 用普通完全DMEM培养液扩大培养, 以制备含病毒的包装细胞上清并测定病毒滴度. 转染的包装细胞命名为PA317/TβRⅡ-IgG1 Fc. 空白质粒pLXSN包装方法同上, 转染的包装细胞命名为PA317/0. 收集PA317/TβRⅡ-IgG1 Fc细胞培养上清液, 1 200 r/min离心10 min, -80℃保存备用. 病毒滴度测定以空白PA317细胞为指示靶细胞.2×105空白PA317细胞培养1 d后, 吸去培养液, 加入1 mL倍比稀释的PA317/TβRⅡ-IgG1 Fc细胞上清液(10-5, 10-4, 10-9/L), 置37℃, 50 mL/L CO2孵箱内培养5 h, 补加完全DMEM培养液5 mL继续培养24 h, 换以含有500 mg/LG418的完全DMEM培养液7-14 d, 直至细胞集落形成, 计数并计算集落形成率(colony forming unit, CFU). 空质粒pLXSN的包装及病毒滴度测定完全同上.
1.2.4 PA317/TβRⅡ-IgG1 F c基因组DNA中PCR分析: 分别提取逆转录病毒产生细胞PA317/TβRⅡ-IgG1 Fc对照PA317细胞中的基因组DNA. 取1×106细胞重悬于溶液A 37.5 μL, 加溶液B 37.5 μL及蛋白酶K 1 μL, 58℃水浴1 h, 98℃ 30 min, 12 000 g离心1 min, 转移上清至一新的离心管, -20℃保存待用. 用TβRⅡ-IgG1 Fc基因引物分别扩增PA317/TβRⅡ-IgG1 Fc细胞及对照PA317细胞中的基因组DNA中TβRⅡ-IgG1 Fc基因, 以证实外源基因导入靶细胞. PCR产物于15 g/L琼脂糖凝胶电泳, 紫外透射仪观察.
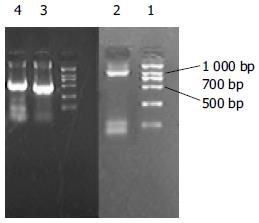
取PCR反应产物4 μL进行15 g/L琼脂糖凝胶电泳, 结果在518 bp区域可见一条特异性强荧光带与TβRⅡ细胞外结合区片段大小相符, 在714 bp区域可见一条特异性强荧光带与IgG1 Fc基因片段大小相符, 在约1 200 bp区域可见一条特异性强荧光带与融合基因片段大小相符(图2). 各基因序列经测序证实均与文献报道一致.
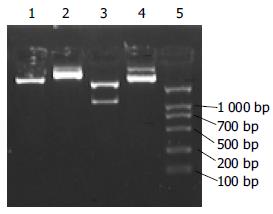
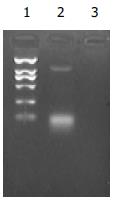
pL(TβRⅡ-IgG1 Fc)SN经EcoRI、BamHI酶切得到大小约1.2 kb的TβRⅡ-IgG1 Fc基因片段(图3), 测序证实均与文献报道一致.
以pL(TβRⅡ-IgG1 Fc)SN重组载体为模板, 以P1、P4为特异性引物, 总体系25 μL, 反应条件同前, 扩增插入片段, 得到大小正确的各条带(图4), 与酶切分析结果相一致, 证明各重组表达载体构建成功.
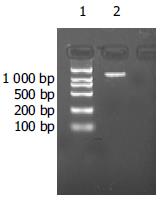
重组pL(TβRⅡ-IgG1 Fc)SN载体DNA5 μg经脂质体转染法转染6×105 PA317包装细胞, 500 mg/L G418筛选10 d后挑选50个细胞集落, 于不含G418的完全DMEM培养液中扩大培养, 其中24个细胞集落存活, 生长至2 wk左右测CFU. 以PA317为靶细胞测定24个细胞集落的CFU, 用倍比稀释的PA317/TβRⅡ-IgG1 Fc细胞上清感染PA317细胞, 24 h后500 mg/L G418筛选, 7-14 d后镜下可见抗性细胞集落形成, 结晶紫染色, 计数. 用引物P1, P4扩增细胞基因组DNA中的TβRⅡ-IgG1 Fc基因, PCR产物电泳后观察, 可见PA317/TβRⅡ-IgG1 Fc细胞扩增出1.2 kb的条带(图5), 证实细胞中有外源性TβRⅡ-IgG1 Fc基因的导入, 同时也证实了重组病毒的活性及转导靶细胞的可能性, 而对照PA317细胞未扩增出1.2 kb的条带.
TGF-β是由两条多肽链组成的蛋白质, 是一个多功能的细胞因子家族, 共有5个亚型并已克隆化, 哺乳类动物仅有Ⅰ、Ⅱ、Ⅲ型. TGF-β1为双硫键联结的二聚体碱性蛋白, 分子质量为25 ku, 体内多种细胞如淋巴细胞、血小板、巨噬细胞等均可合成与分泌TGF-β1. TGF-β1在肝内由非实质细胞合成, 主要在库普弗细胞(Kupffer cell, KC)中表达, 其表达量是肝星状细胞(HSC)的9倍. 肝纤维化时HSC可自分泌、旁分泌TGF-β1, 并产生自我增生的循环过程. 细胞外基质(ECM)的合成和降解主要由TGF-β1调控, TGF-β家族中的激活素A过度表达也是发生肝纤维化的一个重要因素[13-15]. TGF-β1与TGF-β受体(TβR)结合而发挥作用, TβR由三部分组成, 细胞外部分与TGF-β1结合, 通过跨膜蛋白使胞质内部分-丝氨酸/苏氨酸激酶激活, 直接参与TGF-β1的信号转导[16].
SMAD是新近发现的一族能完成TGF-β细胞生物信息由细胞膜到细胞核传递的胞内信号转导蛋白. TGF-β1信号的转导始于TGF-βⅠ型和Ⅱ型受体形成异源二聚体, 激活的TGF-βⅠ型受体使Smad2和Smad3磷酸化, 而Smad7与Ⅰ型受体稳定结合后可阻断此磷酸化, 使TGF-β1信号转导中断[17-18]. 肝内TGF-β1的主要激活途径是通过TGF-β1前体相关蛋白上的低聚糖残基与IGF受体Ⅱ/6-磷酸甘露糖(IGF-ⅡM6P)受体结合, 酶裂解相关蛋白, 释放出活性TGF-β同源二聚体, 其中丝氨酸蛋白酶性纤溶酶可能起一定作用[19-20].
随着分子生物学和肝细胞分离技术的进步, 证实肝纤维化可以逆转, 针对ECM的沉积增加、降解减少的因素, 制定出抑制ECM的生成, 加速其降解的有效治疗措施, 不仅可以逆转肝纤维化, 而且可以有效的防治肝硬化的发生[21-22]. 抑制肝纤维化刺激因子TGF-β1治疗肝纤维化的工作已经开展, 已取得一定的进展[23]. TGF-β1必须通过其特异的膜受体才能发挥生物学效应. 汪玲 et al[24]通过构建不含胞内激酶区、仅仅保留有胞外区和跨膜区的TGF-β1Ⅱ型受体, 脂质体包裹腹腔注射导入动物活体内, 与内源性TGF-β1Ⅱ型受体竞争结合配体. 外源受体由于缺乏胞内激酶区, 不能磷酸化, 信号不能下传, TGF-β1作用在受体水平被阻断. 结果显示在肝纤维化形成早期应用TGF-β1Ⅱ型受体表达质粒进行治疗可以预防肝纤维化的形成. Yata et al[25]证实腹腔注射可溶的TGF-β II型受体(STR), 剂量为4.0, 1.0, 和0.1 mg/kg体重, 大鼠I型胶原RNA(mRNA)表达比IgG对照组减少31%、49%、和60%, TGF-β受体可能成为治疗肝纤维化的有效手段. Arias et al[26]研究了编码TGF-β13'序列的反义mRNA载体腺病毒在培养的HSC中能否抑制TGF-β1的生成. 实验证实腺病毒载体转基因的高水平表达, 应用免疫沉淀、蛋白质印迹、TGF-β1定量ELISA法等证实反转录的基因具有生物活性, 并且应用细胞ELISA、RNA印迹等对TGF-β1基因活性差异的检测验证了转基因的生物学功能. 作者同时研究了转基因对TGF-β2、TGF-β3、转化生长因子联结蛋白1、α1(I)型胶原、I 型、II型TGF-β受体和α-平滑肌肌动蛋白表达的影响. 结果显示反义mRNA可以阻断TGF-β1在HSC自分泌的信号, 这也许是将来治疗肝纤维化的一个有效的治疗途径. 蒋炜 et al[27-29]运用重组DNA技术构建反义TGF-βI 型受体(TβR I)真核细胞表达质粒, 观察到反义TβR I表达质粒对实验性肝纤维化有较好的改善作用. 而本实验在上述实验基础上, 将TGF-βII型受体细胞外结合区和人IgG1 Fc段结合起来, 增加了TGF-βII型受体细胞外结合区的可溶性和靶向性, 可能会产生更加良好的治疗作用.
本实验所采用真核表达载体pLXSN为逆转录病毒载体[30-32], 来源于Moloney小鼠白血病病毒(MoMuLV), 转染包装细胞后能够瞬时或稳定表达包装信号ψ、插入的目的基因及标志基因Neo. 由于逆转录病毒为切除了gag、pol、env基因的缺陷型病毒, 不能包装子代病毒颗粒, 必须借助包装细胞中缺乏ψ序列的辅助病毒为其提供病毒结构蛋白. 包装细胞是由各种不同的辅助病毒转染小鼠成纤维细胞系NIH3T3而建成, 辅助病毒含有完整的gag、pol、env基因, 可为逆转录病毒载体提供包装所需蛋白组份, 但缺乏辅助病毒基因组包装成病毒颗粒的包装信号ψ序列. 将逆转录病毒载体导入包装细胞, 二者相互补偿, 就能够包装成具有感染性但无复制能力的子代病毒颗粒, 以芽生的方式从包装细胞膜分泌至培养上清, 即建立了产生重组逆转录病毒颗粒的细胞系. 由于逆转录病毒包膜中含有env基因编码的一种糖蛋白, 而许多哺乳动物细胞具有识别这种糖蛋白的受体, 二者结合可介导逆转录病毒对靶细胞的有效感染, 进而整合到宿主细胞染色体DNA中.
逆转录病毒载体具有将外源基因稳定整合进入靶细胞的基因组中及感染效率高的优点, 而且能够实现目的基因的长期、高效、稳定表达, 此外, 逆转录病毒载体还有安全性确定、宿主细胞范围广、制备方便等优点, 最适于体外间接基因治疗, 在本实验中, 我们将TβRⅡ-IgG1 Fc基因亚克隆至逆转录病毒表达载体pLXSN, 用脂质体转染法转染PA317包装细胞, G418筛选, 扩大培养后测定细胞集落的病毒滴度并收集上清, 为进一步研究肝纤维化的实验研究奠定了良好的实验基础.
编辑: 张海宁 电编: 潘伯荣
| 1. | Nie QH, Duan GR, Luo XD, Xie YM, Luo H, Zhou YX, Pan BR. Expression of TIMP-1 and TIMP-2 in rats with hepatic fibrosis. World J Gastroenterol. 2004;10:86-90. [PubMed] |
| 2. | Corpechot C, Barbu V, Wendum D, Chignard N, Housset C, Poupon R, Rosmorduc O. Hepatocyte growth factor and c-Met inhibition by hepatic cell hypoxia: a potential mechanism for liver regeneration failure in experimental cirrhosis. Am J Pathol. 2002;160:613-620. [PubMed] |
| 3. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Bai XG, Cao YZ. Methodologic research on TIMP-1, TIMP-2 detection as a new diagnostic index for hepatic fibrosis and its significance. World J Gastroenterol. 2002;8:282-287. [PubMed] |
| 4. | Vozenin-Brotons MC, Sivan V, Gault N, Renard C, Geffrotin C, Delanian S, Lefaix JL, Martin M. Antifibrotic action of Cu/Zn SOD is mediated by TGF-beta1 repression and phenotypic reversion of myofibroblasts. Free Radic Biol Med. 2001;30:30-42. [PubMed] |
| 5. | Branton MH, Kopp JB. TGF-β1 and fibrosis. Microbes Infect. 1999;1:1349-1365. [PubMed] |
| 6. | Scandura JM, Boccuni P, Massague J, Nimer SD. Transforming growth factor beta-induced cell cycle arrest of human hematopoietic cells requires p57KIP2 up-regulation. Proc Natl Acad Sci USA. 2004;101:15231-15236. [PubMed] |
| 7. | Yu L, Border WA, Anderson I, McCourt M, Huang Y, Noble NA. Combining TGF-beta inhibition and angiotensin II blockade results in enhanced antifibrotic effect. Kidney Int. 2004;66:1774-1784. [PubMed] |
| 8. | Suh N, Roberts AB, Birkey Reffey S, Miyazono K, Itoh S, ten Dijke P, Heiss EH, Place AE, Risingsong R, Williams CR. Synthetic triterpenoids enhance transforming growth factor beta/Smad signaling. Cancer Res. 2003;63:1371-1376. [PubMed] |
| 9. | Hellerbrand C, Stefanovic B, Giordano F, Burchardt ER, Brenner DA. The role of TGF betal in initiating hepatic stellate cell activation in vivo. J Hepatol. 1999;30:77-87. [PubMed] |
| 10. | Corpechot C, Barbu V, Wendum D, Kinnman N, Rey C, Poupon R, Housset C, Rosmorduc O. Hypoxia-induced VEGF and collagen I expressions are associated with angiogenesis and fibrogenesis in experimental cirrhosis. Hepatology. 2002;35:1010-1021. [PubMed] |
| 11. | George J, Roulot D, Koteliansky VE, Bissell DM. In vivo inhibition of ratstellate cell activation by soluble transforming growth factor β type II receptor: Apotential new therapy for hepatic fibrosis. Proc Natl Acad Sci USA. 1999;96:12719-12724. [PubMed] |
| 12. | Haviv YS, Takayama K, Nagi PA, Tousson A, Cook W, Wang M, Lam JT, Naito S, Lei X, Carey DE. Modulation of renal glomerular disease using remote delivery of adenoviral-encoded solubletype II TGF-beta receptor fusion molecule. J Gene Med. 2003;5:839-851. [PubMed] |
| 13. | Huang X, Li DG, Wang ZR, Wei HS, Cheng JL, Zhan YT, Zhou X, Xu QF, Li X, Lu HM. Expression changes of activin A in the development of hepatic fibrosis. World J Gastroenterol. 2001;7:37-41. [PubMed] |
| 14. | Wei HS, Lu HM, Li DG, Zhan YT, Wang ZR, Huang X, Cheng JL, Xu QF. The regulatory role of AT 1 receptor on activated HSCs in hepatic fibrogenesis: effects of RAS inhibitors on hepatic fibrosis induced by CCl(4). World J Gastroenterol. 2000;6:824-828. [PubMed] |
| 15. | Wei HS, Li DG, Lu HM, Zhan YT, Wang ZR, Huang X, Zhang J, Cheng JL, Xu QF. Effects of AT1 receptor antagonist, losartan, on rat hepatic fibrosis induced by CCl(4). World J Gastroenterol. 2000;6:540-545. [PubMed] |
| 16. | Shen F, Yin C, Jia J, Wang B. Receptors of hepatic stellate cells: new insights and prospects for therapy. Chin J Hepatol. 2002;10:479-480. [PubMed] |
| 17. | Cheng J, Zhou X, Gao Z, Huo Y, Xu Q, Li D. Influence of TGF-β1 on expression of Smad7 mRNA and protein in rat liver cells. Natl Med J China. 2002;82:111-113. [PubMed] |
| 18. | Gao R, Ball DK, Perbal B, Brigstock DR. Connective tissue growth factor induces c-fos gene activation and cell proliferation through p44/42 MAP kinase in primary rat hepatic stellate cells. J Hepatol. 2004;40:431-438. [PubMed] |
| 19. | Zhou GD, Zhao JM, Wang SS, Sun YL, Meng EH, Zhang TH, Liu P. Clinical and pathological analysis on characteristics of primary biliary cirrhosis. Zhonghua Ganzangbing Zazhi. 2003;11:483-486. [PubMed] |
| 20. | Zeitlin L, Resnick MB, Konikoff F, Schuppan D, Bujanover Y, Lerner A, Belson A, Lifschitz B, Reif S. Divergent patterns of extracellular matrix protein expression in neonatal versus adult liver fibrosis. Pediatr Pathol Mol Med. 2003;22:349-362. [PubMed] |
| 21. | Ueberham E, Low R, Ueberham U, Schonig K, Bujard H, Gebhardt R. Conditional tetracycline-regulated expression of TGF-beta1 in liver of transgenic mice leads to reversible intermediary fibrosis. Hepatology. 2003;37:1067-1078. [PubMed] |
| 22. | Meyer K, Ueberham E, Gebhardt R. Influence of organosulphur compounds from garlic on the secretion of matrix metalloproteinases and their inhibitor TIMP-1 by cultured HUVEC cells. Cell Biol Toxicol. 2004;20:253-260. [PubMed] |
| 23. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-807. [PubMed] |
| 24. | Wang L, Hu GL, Tan DM. Effects of truncated type II receptor of TGF-β1 expressing plasmid on rat liver fibrosis. Chin J Infect Dis. 2002;20:168-171. |
| 25. | Yata Y, Gotwals P, Koteliansky V, Rockey DC. Dose-dependent inhibition of hepatic fibrosis in mice by a TGF-beta soluble receptor: implications for antifibrotic therapy. Hepatology. 2002;35:1022-1030. [PubMed] |
| 26. | Arias M, Lahme B, Van de Leur E, Gressner AM, Weiskirchen R. Adenoviral delivery of an antisense RNA complementary to the 3' coding sequence of transforming growth factor-beta1 inhibits fibrogenic activities of hepatic stellate cells. C ell Growth Differ. 2002;13:265-273. [PubMed] |
| 27. | Jiang W, Yang CQ, Liu WB, Wang YQ, He BM, Wang JY. Blockage of transforming growth factor beta receptors prevents progression of pig serum-induced rat liver fibrosis. World J Gastroenterol. 2004;10:1634-1638. [PubMed] |
| 28. | Jiang W, Wang JY, Yang CQ, Liu WB, Wang YQ, He BM. Effects of antisense transforming growth factor beta receptor-II(TGFbetaRII)expressing plasmid on experimental liver fibrosis. Zhonghua Ganzangbing Zazhi. 2004;12:137-140. [PubMed] |
| 29. | Liu WB, Yang CQ, Jiang W, Wang YQ, Guo JS, He BM, Wang JY. Inhibition on the production of collagen type I, III of activated hepatic stellate cells by antisense TIMP-1 recombinant plasmid. World J Gastroenterol. 2003;9:316-319. [PubMed] |
| 30. | Hoeben RC, Valerio D, van der Eb AJ, van Ormondt H. Gene therapy for human inherited disorders: techniques and status. Crit Rev Oncol Hematol. 1992;13:33-54. [PubMed] |
| 31. | Cornetta K. Regulatory issues in human gene therapy. Blood Cells Mol Dis. 2003;31:51-56. [PubMed] |