修回日期: 2004-12-28
接受日期: 2005-01-05
在线出版日期: 2005-03-15
目的: 检测大鼠颌下腺5-羟色胺(5-HT)及生长抑素(SS)的表达情况.
方法: SD大鼠14只, 雌雄各半. 取其颌下腺, 用免疫组织化学SABC单染法、邻片单染双标法及图像分析方法进行研究.
结果: 雄性大鼠颌下腺的导管、浆液性腺泡、副交感神经节等部位均有5-HT表达, 而雌性大鼠仅纹状管有5-HT存在; 雄、雌性大鼠颌下腺导管上皮细胞胞质均呈SS免疫反应(immunoreactive, IR)阳性; 5-HT-IR细胞与SS-IR细胞部分定位相同, 主要定位于纹状管; 雌性大鼠颌下腺SS-IR细胞的平均黑度明显低于雄性大鼠(88.1±7.6 vs 98.4±14.4, t = 0.63, P = 0.005<0.01).
结论: 大鼠颌下腺表达5-HT及SS, 且雌雄差异明显, 推测他们的表达受雄激素影响.5-HT与SS有在纹状管上皮细胞内共存现象, 提示这两种生物活性物质可能有相互作用.
引文著录: 胡赟, 梁文妹. 大鼠颌下腺5-羟色胺及生长抑素的表达. 世界华人消化杂志 2005; 13(6): 752-754
Revised: December 28, 2004
Accepted: January 5, 2005
Published online: March 15, 2005
AIM: To investigate the expression of 5-hydroxytryptamine (5-HT) and somatostatin (SS) in rat submandibular gland.
METHODS: The submandibular glands were taken from 14 SD rats. The expression of 5-HT and SS was determined by immunohistochemical SABC single staining, double staining on adjacent sections, and image analysis techniques.
RESULTS: The expression of 5-HT was observed in the cytoplasm of duct cells, serous cells, and accessory sympathetic nerve ganglion cells in the submandibular gland of male rats. In contrast, only striated duct cells expressed 5-HT in the females. SS was positive stained in the cytoplasm of duct cells of submandibular gland. The co-localization of 5-HT- and SS was detected in striated ducts by double staining technique on adjacent sections. The mean staining density of SS in female tissues was significantly weaker than in male tisseus (88.1±7.6 vs 98.4±14.4, t = 0.63, P = 0.005).
CONCLUSION: 5-HT and SS are expressed in the submandibular gland of rats. The expression is different between males and females, which may be related to androgen. 5-HT and SS co-locate in the striated duct, indicating an interaction between them.
- Citation: Hu Y, Liang WM. Expression of 5-hydroxytrptamine and somatostatin in submandibular gland of rats. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 752-754
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/752.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.752
颌下腺能合成和分泌多种生物活性物质, 参与机体的多种生理反应. 因而颌下腺的结构和功能越来越受到人们关注. 目前, 有关5-HT及SS在颌下腺的定位研究较少见, 尤其尚未见到分析颌下腺5-HT与SS间相互关系的报道. 本实验用免疫组织化学SABC法, 对5-HT及SS在大鼠颌下腺的定位、分布特点及其共存现象进行了观察, 并运用图像分析方法对SS的雌雄差异进行了定量分析. 为深入研究颌下腺的功能以及为探讨5-HT与SS间可能的相互作用提供了形态学资料.
SD大鼠14只, 雌雄各半, 体质量180-220 g, 用30 g/L戊巴比妥钠ip麻醉, 经心脏用生理盐水灌洗, Bouin液灌注固定后取颌下腺. Bouin液再固定, 常规石蜡包埋, 制成4 μm厚连续切片.
免疫组织化学SABC单染法步骤: 100 ml/L甲醇-过氧化氢室温10 min, 正常羊血清(1: 50)室温30 min, 兔抗5-HT(1: 4 000, 第四军医大提供)、兔抗SS(1: 250, 第二军医大提供)分别于4℃孵育过夜, 羊抗兔IgG(1: 100, 博士德生物工程公司提供)37℃孵育20 min, SABC复合物(1: 100)37℃孵育20 min, DAB-H2O2液显色, 苏木精复染细胞核, 中性树胶封片. 免疫组织化学邻片单染双标法步骤: 取相邻两张切片, 一张滴加兔抗5-HT(1: 4 000), 另一张滴加兔抗SS(1: 250). 余步骤同上. 随机选取雌雄大鼠颌下腺切片各5张, 应用BioMias 29图像分析系统进行检测. 在40倍物镜下, 每张切片随机选取5个视野, 测得5-HT-IR, SS-IR细胞的平均黑度.
统计学处理 所得数据用t检验(mean±SD)进行统计学处理.
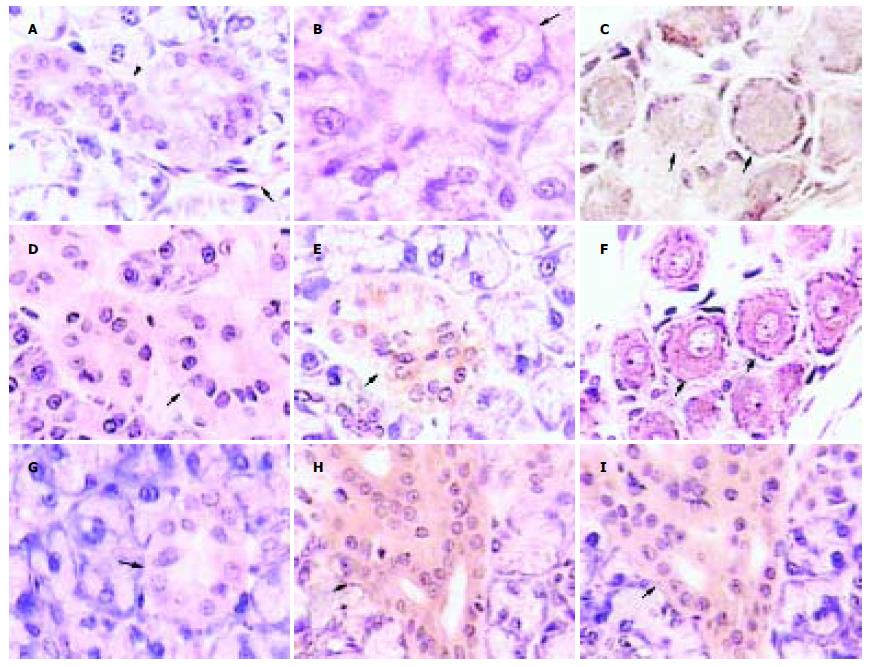
在雄性大鼠导管上皮细胞、浆液性腺细胞、副交感神经节细胞、毛细血管及小血管内皮细胞胞质内均有5-HT免疫反应物. 雌性大鼠颌下腺5-HT-IR细胞少, 且免疫染色浅, 主要定位于纹状管(图1A-D). 光镜下, 经DAB-H2O2显色, 见大鼠颌下腺SS-IR细胞分布于导管, 同一导管断面SS-IR细胞的免疫染色强弱不等. 副交感神经节细胞胞质也呈SS免疫反应阳性. 腺泡细胞为阴性反应. 雌性大鼠颌下腺SS-IR细胞数量少且免疫染色浅(图1E-I). 用免疫组织化学邻片单染双标法分别显示大鼠颌下腺5-HT-IR细胞与SS-IR细胞, 见部分5-HT-IR细胞(图1H)与SS-IR细胞(图1I)定位相同, 主要定位于纹状管. 此外, 在副交感神经节细胞也有共存现象(图1C, F).
雌雄性大鼠颌下腺SS-IR细胞平均黑度值有明显差异(88.1±7.6 vs 98.4±14.4, t = 0.63, P = 0.005<0.01)
我们观察到雄性大鼠颌下腺5-HT的定位表达与Huang et al[1]的报道结果一致. SS与贾雪梅et al[2]报道的存在于大鼠颌下腺导管上皮细胞及神经节细胞胞质结果相同. 此外我们发现, 5-HT及SS的表达存在雌雄差异. 推测这种差异与雄激素有关. 在雌性大鼠, 5-HT主要定位于颌下腺的纹状管. 这与Huang et al[1]报道5-HT定位于雌性大鼠颌下腺的排泄管的结果有所差异.5-HT是体内重要的神经递质和调节物, 与多方面的生理功能有关, 如睡眠[3]、行为和记忆[4]、下丘脑-垂体前叶功能[5]、疼痛感受[6]等.5-HT对神经细胞的发生发育有重要作用. 目前有研究表明, 5-HT与阿尔茨海默病及亨廷顿病密切相关[7]. 在BD病毒感染大鼠大脑皮质及海马等部位, 其5-HT的含量增加[8].5-HT也是调节肠道功能的一个重要因子, 对肠蠕动、肠分泌及脑-肠轴中感觉信号的传递都起着关键作用[9]. 有学者用免疫组织化学SABC法观察到淋巴结副皮质区的T淋巴细胞、淋巴滤泡生发中心的巨噬细胞等部位都有5-HT的表达. 提出5-HT是神经内分泌免疫网络中共同的生物语言, 对免疫系统和神经内分泌系统起着双向调节作用[10]. 外源性的5-HT在一定浓度范围内(10-9-10-7mol/L)能刺激颌下腺分泌NGF, 而5-HT浓度超过10-7mol/L时则表现为抑制作用. 提示5-HT对颌下腺NGF的分泌可能起双向调节作用[11].
SS在体内分布广泛, 对多种生理功能均具有抑制作用, 同时又具有免疫调节功能, 是神经内分泌免疫网络中重要的信号传导分子[12]. 有研究报道, SS能抑制干扰素2γ(IFN-2γ)、肿瘤坏死因子2α(TNF-2α)及IL-22的释放以及抑制自然杀伤细胞(NK细胞)的活性[13]. 而SS在免疫系统也有分布[14]. 这些研究结果提示颌下腺可能属于神经-内分泌-免疫网络的一部分. 我们观察到在大鼠颌下腺5-HT与SS有共存现象, 为探讨二者间的可能关系提供了一定的形态学依据.
编辑: 张海宁 电编: 潘伯荣
| 1. | Huang W, Sun L, Lu B, Wang W, Pu R, Chen L, Xia Y. Localization and in situ quantification of 5-hydroxytryptamine and its receptor in rat submaxillary gland. J Mol Histol. 2004;35:47-53. [PubMed] |
| 3. | Steriade M. Slow-wave sleep: serotonin, neuronal plasticity, and seizures. Arch Ital Biol. 2004;142:359-367. [PubMed] |
| 4. | Evers EA, Tillie DE, van der Veen FM, Lieben CK, Jolles J, Deutz NE, Schmitt JA. Effects of a novel method of acute tryptophan depletion on plasma tryptophan and cognitive performance in healthy volunteers. Psychopharmacology(Berl). 2005;178:92-99. [PubMed] |
| 5. | Veenema AH, Koolhaas JM, de Kloet ER. Basal and stress-induced differences in HPA axis, 5-HT responsiveness, and hippocampal cell proliferation in two mouse lines. Ann N Y Acad Sci. 2004;1018:255-265. [PubMed] |
| 6. | Oberlander TF, Grunau RE, Fitzgerald C, Papsdorf M, Rurak D, Riggs W. Pain reactivity in 2-month-old infants after prenatal and postnatal serotonin reuptake inhibitor medication exposure. Pediatrics. 2005;115:411-425. [PubMed] |
| 7. | Mattson MP, Maudsley S, Martin B. BDNF and 5-HT: a dynamic duo in age-related neuronal plasticity and neurodegenerative disorders. Trends Neurosci. 2004;27:589-594. [PubMed] |
| 8. | Dietz D, Vogel M, Rubin S, Moran T, Carbone K, Pletnikov M. Developmental alterations in serotoninergic neurotransmission in Borna disease virus(BDV)-infected rats: a multidisciplinary analysis. J Neurovirol. 2004;10:267-277. [PubMed] |
| 9. | Yeo A, Boyd P, Lumsden S, Saunders T, Handley A, Stubbins M, Knaggs A, Asquith S, Taylor I, Bahari B. Association between a functional polymorphism in the serotonin transporter gene and diarrhoea predominant irritable bowel syndrome in women. Gut. 2004;53:1452-1458. [PubMed] |
| 11. | 吕 葆真, 黄 威权, 蒲 若蕾. 5-HT受体亚型在大鼠颌下腺的免疫组织化学定位及5-HT的功能研究. 中国组织化学与细胞化学杂志. 2002;11:125-127. |
| 13. | Levite M, Chowers Y. Nerve-driven immunity: neuropeptides regulate cytokine secretion of T cells and intestinal epithelial cells in a direct, powerful and contextual manner. Ann Oncol. 2001;12:S19-25. [PubMed] |
| 14. | Dalm VA, van Hagen PM, van Koetsveld PM, Achilefu S, Houtsmuller AB, Pols DH, van der Lely AJ, Lamberts SW, Hofland LJ. Expression of somatostatin, cortistatin, and somatostatin receptors in human monocytes, macrophages, and dendritic cells. Am J Physiol Endocrinol Metab. 2003;285:E344-353. [PubMed] |