修回日期: 2004-12-15
接受日期: 2004-12-28
在线出版日期: 2005-03-15
目的: 研究缺血再灌注损伤对大鼠肝细胞活性和钙池操纵的钙通道电流(Isoc)的影响及钙通道阻滞剂(2-aminoethoxydiphenyl borane, 2-APB)的拮抗作用.
方法: 建立大鼠肝缺血再灌注损伤模型, 应用全细胞膜片钳技术研究缺血再灌注损伤对大鼠肝细胞Isoc的影响及2-APB的拮抗作用.
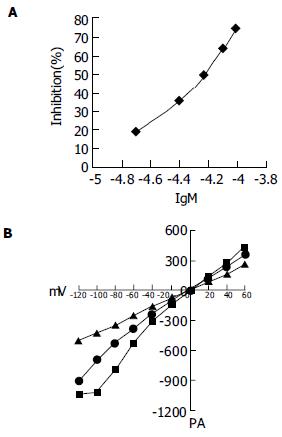
结果: 缺血再灌注组肝细胞Isoc为-1 058.0±223.3pA(n = 8), 假手术组为664.5±140.4pA(n = 8), 两组比较差异显著(P<0.05). (2)20、40、60、80、100 μmol/L的2-APB分别使Isoc由给药前的-1 056.7pA±225.1pA下降至给药后的-853.7pA±225.1pA、-686.3pA±145.0pA、 -534.4pA±120.4pA、-382.6pA±58.0pA 、-272.9pA±51.1pA, 抑制率分别为19.2%±6.2%、35.1%±7.6%、49.4%±9.9%、63.8%±15.8%、74.2%±16.5%; 给药前后的Isoc比较有显著差异(n = 8, P<0.05或P<0.01); 2-APB的抑制作用呈浓度依赖性增强, 其EC50为64.6±10.7 μmol/L.
结论: 缺血再灌注损伤具有增加大鼠肝细胞的钙离子内流的作用, 钙离子内流增加可能导致肝细胞钙超载, 从而降低肝细胞的活性; 2-APB对缺血再灌注损伤大鼠肝细胞的钙离子内流具有抑制作用, 因此对缺血再灌注损伤的肝细胞起到保护作用.
引文著录: 黄昌州, 张宗明, 裘法祖. 缺血再灌注损伤对大鼠肝细胞钙池操纵的钙通道电流的影响及药物拮抗. 世界华人消化杂志 2005; 13(6): 739-742
Revised: December 15, 2004
Accepted: December 28, 2004
Published online: March 15, 2005
AIM: To study the effects of hepatic ischemia/reperfusion (I/R) injury on hepatocellular viability and store-operated calcium channel currents (Isoc) in freshly isolated rat hepatocytes, and the effects of (2-aminoethoxydiphenyl borane) 2-APB on Isoc of hepatocytes after hepatic ischemia/reperfusion injury in rats.
METHODS: Rat hepatic ischemia and reperfusion injury model was established. Hepatocellular viabilities were determined by trypan blue exclusion assay. The effects of 2-APB on Isoc was investigated by whole-cell patch plamp technique.
RESULTS: Ischemia/reperfusion injury significantly reduced hepatocellular viability and increased Isoc in hepatocytes. 2-APB(20, 40, 60, 80, 100 μmol/L)induced a concentration-dependent decrease of Isoc with IC50 value of 64.6±10.7 μmol/L(n = 8).
CONCLUSION: Ischemia/reperfusion injury can reduce hepatocellular viability, probably through increasing Isoc in hepatocytes. 2-APB has a protective effect on ischemia/reperfusion-induced liver injury, probably though inhibiting Isoc.
- Citation: Huang CZ, Zhang ZM, Qiu FZ. Effects of 2-APB on store-operated Ca2+ channel currents of hepatocytes after hepatic ischemia/reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 739-742
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/739.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.739
肝脏缺血再灌注损伤, 引起肝细胞Ca2+超载, 进而引起肝细胞凋亡、甚至死亡, 导致肝脏功能衰竭. 肝细胞Ca2+超载的机制一直是近年来研究甚多却悬而未决的问题. 钙池操纵的钙通道(store-operated Ca2+ channels, SOC)几乎存在所有非兴奋细胞和部分兴奋性细胞上[1-4], 研究发现肝细胞存在SOC, 且对钙离子具有高度选择性[5].2-APB是一种三磷酸肌醇(inositol 1, 4, 5-trisphosphate, IP3)受体抑制剂[6], 也是一种SOC和瞬时受体电位(transient receptor potential, TRP)通道的抑制剂[7-9]. 我们探讨缺血再灌注损伤对大鼠肝细胞活性和钙池操纵的钙通道电流(Isoc)的影响及2-APB的拮抗作用.
雄性Spraqae-Dawley大白鼠, 体重200-300 g, 中国科学院上海实验动物中心提供. 胶原酶IV型(Collangenase IV), N-2-羟乙基哌嗪-N-2-乙磺酸(HEPES), 乙二醇-双(2-氨基乙基)四乙酸(EGTA), Trypan blue, 均为美国Sigma公司产品; DMEM(美国Gibco公司); 2-APB, BHQ(2, 5-di-tert-butyl-hydrounone)和BAPTA(12-bis(2-aminophenoxy)ethane-N, N, N', N'-tetraaceticacid)购自德国默克公司; 小牛血清(上海华美生物工程公司); 其余均为国产分析纯试剂. 电子蠕动泵(保定兰格恒流泵有限公司), 硬质玻璃电极(Would Precision, 美国), MP-285三维微操纵器(Sutter Instrument Co. 美国), Axopatch 200B膜片钳放大器及pCLAMP 9.0软件包(AXON Instrument, 美国), 防震台及静电屏蔽罩(IOI Technology Corporation Limited), MODEL P-97微电极拉制仪(Sutter Instrument Co. 美国).
大鼠肝缺血再灌注损伤模型: 参考Colletti et al(J Clin Invest 1990; 85: 1936[10]的方法建立, 加以修改如下: 大鼠用10 g/L戊巴比妥iP(0.05 ml/10 g体重)麻醉, 同时iP肝素(2 U/10 g体重)抗凝, 10 min后固定于操作台上, 消毒后取腹部正中切口, 打开腹腔后显露供应大鼠肝脏头(cephalad)三叶的门静脉和肝动脉分支, 然后用无创动脉铗阻断其血供, 20 min后移去无创动脉铗, 再灌注40 min后制成肝缺血再灌注损伤模型. 假手术组不阻断大鼠肝脏头(cephalad)三叶的血供, 其余手术步骤同上. 采用低浓度胶原酶循环灌注方法分离肝细胞, 在上述肝缺血再灌注模型基础上, 显露肝门部门静脉, 切开门静脉置一硅胶管并固定, 尽快接通启动蠕动泵, 同时剪开肝下下腔静脉远端, 用无钙无镁的Hanks液, 以20-30 ml/min快速灌注清除肝内血液, 持续灌注10 min至肝脏呈米黄色, 然后切开胸腔结扎肝上下腔静脉; 插另一只硅胶管入肝下下腔静脉并结扎固定, 换无钙无镁的Hanks液为胶原酶消化液(37℃预热)循环灌注, 速度为10-20/min, 持续10 min至肝质变软后停止, 小心剪取肝脏头三叶并置于消毒平皿内, 加入适量肝细胞洗涤液(4℃预冷), 剪碎肝组织制成混合肝细胞悬液, 经100目筛网过滤入15 mL离心管, 离心(500/min, 1-2 min), 去上清, 沉淀加DMEM液10 mL洗涤3次后再加入肝细胞培养液重悬为10 mL, 取适量计数, 并用4 g/L苔盼兰染色判断细胞存活率, 其余分装于多个35 mm的培养皿内, 在37℃培养箱中培养约1-2 h[11]. 将上述分离的肝细胞制成细胞悬液并作适当稀释(109细胞/L), 取9滴细胞悬液移入小试管中, 加4 g/L苔盼兰液1滴混匀, 在3 min内, 用血球计数板分别计数活细胞和死细胞, 然后计算活细胞率[12]. 采用全细胞膜片钳技术, 在电压钳模式下记录肝细胞Isoc. 硬质玻璃电极经微电极拉制仪分两步拉制成尖端直径为1-1.5 μm的电极, 充满电极内液后阻抗为2-5MO当电极尖端与细胞膜之间形成高阻封接(大于1 GO)后, 负压或电击破膜, 使电极内液与细胞内液相通, 调节膜片钳放大器的电容-慢控制(C-slow)和电导-串联控制(G-series)抵消瞬时电流, 并记录调节值. 电流信号经放大器放大后通过接口Labmaster TL-1与一台奔腾4计算机相连, 取3 KHz滤波, 采样频率为5 KHz, 设定钳制电位(holding potential, HP)为0 mV, 实验电位(test potential, TP)为-120-+60 mV, 阶跃为20 mV, 持续时间400 ms. 信号采集与贮存, 结果分析等均借助计算机用pCLAMP 9.0软件完成.
统计学处理 实验数据用均数±标准差(mean±SD)表示, 采用t检验进行统计学处理, P<0.05表示差异有显著性.
缺血再灌注组肝细胞活率为80.9±3.4%, 假手术组肝细胞活率为96.9±1.8%, 两组比较差异显著(n = 12, P<0.05).
肝细胞Isoc, 在钳制电位为-100 mV时, 缺血再灌注组肝细胞的Isoc明显高于假手术组. 缺血再灌注组肝细胞Isoc为-1 058.0±223.3 pA(n = 8), 假手术组为664.5±140.4 pA(n = 8), 两组比较差异显著(P<0.05).
当肝细胞Isoc全细胞膜片钳记录建立后, 将20、40、60、80、100 μmol/L 2-APB通过快速加药装置直接加入肝细胞周围, 观察2-APB对Isoc的影响, 结果发现20、40、60、80、100 μmol/L的2-APB分别使Isoc由给药前的-1 056.7±225.1 pA下降至给药后的-853.7±225.1 pA、-686.2±145.0 pA、-534.4±120.4 pA、-382.6±57.9pA、-272.9±51.1 pA, 抑制率分别为19.2±6.2%、35.1±7.6%、49.4±9.91%、63.8±15.82%、74.2±16.5%, 给药前后的Isoc比较有显著差异(n = 8, P<0.05或P<0.01); 2-APB的抑制作用呈浓度依赖性增强, 其EC50为64.6±10.7 μmol/L(图1).
本实验结果显示缺血再灌注损伤能明显降低肝细胞活性, 并进一步增加肝细胞的Isoc. 肝缺血再灌注损伤后产生大量氧自由基(reactive oxygen species, ROS), 并且ROS引起一系列肝细胞的病理生理事件, 如凋亡、坏死和炎症[13-15], 由此推测ROS可能在SOC激活过程中起着重要的作用, 我们的其他实验已证实ROS能增加人肝实质细胞的Isoc(资料未显示). Broad et al[16]发现磷脂酶C和多磷酸肌醇是SOC激活所必须的, 新近的资料发现在完好无损的细胞中, 具有活性的受体调节的磷脂酶C激活瞬时受体电位通道C3(transient receptor potential channel, TRPC3)是通过甘油二酯产物的作用来完成的, 而与蛋白G、蛋白激酶或三磷酸肌醇无关[17-18], 目前认为该类离子通道的本质是瞬时受体电位通道蛋白家族[19]. 本研究结果表明大鼠肝缺血再灌注损伤后产生大量的氧自由基, 进而与肝细胞膜上的受体结合引起膜磷脂酶C的激活, 然后激活细胞膜上的SOC通道, 导致肝细胞内钙离子超载, 从而引起肝细胞损伤.
我们发现2-APB对缺血再灌注损伤后肝细胞Isoc具有明显的抑制作用, 且该抑制作用呈浓度依赖性增强, 一些新近的研究也证明2-APB可能是一个钙通道直接阻滞剂而不是三磷酸肌醇受体拮抗剂, 并且通过细胞外应用2-APB, 钙离子释放激活钙电流(Ca2+ -release-activated Ca2+ current, Icrac)的活性被迅速地抑制, 而细胞内应用则不起作用[20-22]; 此外, Broad et al[16]证实在缺乏三磷酸肌醇受体的DT40细胞上, 2-APB能废除由肌浆内质网ATPase抑制剂(Thapsigagin)引起的容积性钙离子内流, 这与2-APB直接作用于SOC本身的观点一致, 因此我们可以推测2-APB能够通过抑制Isoc来减少钙离子内流, 减轻由缺血再灌注损伤所致的肝细胞损害.
总之, 我们可以得出如下结论: 缺血再灌注损伤具有增加大鼠肝细胞的钙离子内流的作用, 钙离子内流增加可能导致肝细胞钙超载, 从而降低肝细胞的活性; 2-APB对缺血再灌注损伤大鼠肝细胞的钙离子内流具有抑制作用, 因此对缺血再灌注损伤的肝细胞起到保护作用.
编辑: 张海宁 电编: 潘伯荣
| 1. | Vazquez G, Wedel BJ, Aziz O, Trebak M, Putney JW Jr. The mammalian TRPC cation channels. Biochim Biophys Acta. 2004;1742:21-36. [PubMed] |
| 2. | Penner R, Fleig A. Store-operated calcium entry: a tough nut to CRAC. Sci STKE. 2004;2004:pe38. [PubMed] |
| 3. | Putney JW Jr. Store-operated calcium channels: how do we measure them, and why do we care. Sci STKE. 2004;2004:pe37. [PubMed] |
| 4. | Gregory RB, Hughes R, Riley AM, Potter BV, Wilcox RA, Barritt GJ. Inositol trisphosphate analogues selective for types I and II inositol trisphosphate receptors exert differential effects on vasopressin-stimulated Ca2+ inflow and Ca2+ release from intracellular stores in rat hepatocytes. Biochem J. 2004;381:519-526. [PubMed] |
| 5. | Rychkov G, Brereton HM, Harland ML, Barritt GJ. Plasma Membrane Ca2+ release-activated Ca2+ channels with a high selectivity for Ca2+ identified by patch-clamp recording in rat liver cells. Hepatology. 2001;33:938-947. [PubMed] |
| 6. | Maruyama T, Kanaji T, Nakade S, Kanno T, Mikoshiba K. 2-APB, 2-aminoethoxydiphenyl borate, a membrane-penetrable modulator of ins(1, 4, 5)P3-induce Ca2+ release. J Biochem (Tokyo). 1997;122:498-505. [PubMed] |
| 7. | Iwasaki H, Mori Y, Uchida K, Zhou H, Mikoshiba K. 2-aminoethoxydiphenyl borate(2-APB)inhibits capacitative calcium entry independently of the function of inositol 1, 4, 5-trisphospate receptors. Receptors Channels. 2001;7:429-439. [PubMed] |
| 8. | Bootman MD, Collins TJ, Mackenzie L, Roderick HL, Berridge MJ, Peppiatt CM. 2-aminoethoxydiphenyl borate(2-APB)is a reliable blocker of store-operated calcium entry but an inconsistent inhibitor of ins P3-induce Ca2+ release. FASEB J. 2002;16:1145-1150. [PubMed] |
| 9. | Braun FJ, Aziz O, Putney JW Jr. 2-aminoethoxydiphenyl borane activates a novel calcium-permeable cation channel. Mol Pharmacol. 2003;63:1304-1311. [PubMed] |
| 10. | Colletti LM, Remick DG, Burtch GD, Kunkel SL, Strieter RM, Campbell DA Jr. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. J Clin Invest. 1990;85:1936-1943. [PubMed] |
| 11. | Riccalton-Banks L, Bhandari R, Fry I, Shakeff KM. A simple method for the simultaneous isolation of stellate cells and hepatocytes from rat liver tissue. Mol Cell Biochem. 2003;248:97-102. [PubMed] |
| 12. | Barros LF, Stutzin A, Calixto A, Catalan M, Castro J, Hetz C, Hermosilla T. Nonselective Cation Channel as effectors of free radical-induced rat liver cell necrosis. Hepatology. 2001;33:114-122. [PubMed] |
| 13. | Fan C, Zwacka RM, Engelhardt JF. Therapeutic approaches for ischemia/reperfusion injury in the liver. J Mol Med. 1999;77:577-592. [PubMed] |
| 14. | Pardini RS. Toxicity of Oxygen from naturally occurring redox-active pro-oxidants. Arch Insect Biochem Physiol. 1995;29:101-118. |
| 15. | Losser MR, Payen D. Mechanisms of liver damage. Semin Liver Dis. 1996;16:357-367. |
| 16. | Broad LM, Braun FJ, Lievremont JP, Bird GS, Kurosaki T, Putney JW Jr. Role of phospholipase C-inositol 1, 4, 5-trisphosphate pathway in calcium release-activated calcium current and capacitatative calcium entry. J Biol Chem. 2001;276:15945-15952. [PubMed] |
| 17. | Zhang Z, Tang J, Tikunova S, Johnson JD, Chen Z, Qin N, Dietrich A, Stefani E, Birnbaumer L, Zhu MX. Activation Of Trp3 by inositol 1, 4, 5-trisphosphate receptor through displacement of inhibition calmodulin from a common binding domain. Proc Natl Acad Sci USA. 2001;98:3168-3173. [PubMed] |
| 18. | Trebak M, St J Bird G, McKay RR, Birnbaumer L, Putney JW Jr. Signaling mechanism for receptor-activated canonical transient receptor potential 3(TRPC3)channels. J Biol Chem. 2003;278:16244-16252. [PubMed] |
| 19. | Clapham DE, Runnels LW, Strubing C. The TRP ion channel family. Natu Rev Neurosci. 2001;2:387-396. |
| 20. | Ma HT, Patterson RL, Van Rossum DB, Birnbaumer L, Mikoshiba K, Gill DL. Requirement of the inositol trisphosphate receptor for activation of store-operated Ca2+ channels. Science. 2000;287:1647-1651. [PubMed] |
| 21. | Braun FJ, Broad LM, Armstrong DL, Putney JW Jr. Stable activation of single Ca2+ release-activated Ca2+ channels in divalent cation-free solutions. J Biol Chem. 2001;276:1063-1070. [PubMed] |
| 22. | Kukkonen JP, Lund PE, Akerman KE. 2-aminoethoxy-diphenyl borate reveals heterogeneity in receptor-activated Ca2+ discharge and store-operated Ca2+ influx. Cell Calcium. 2001;30:117-129. [PubMed] |