修回日期: 2005-01-28
接受日期: 2005-02-02
在线出版日期: 2005-03-15
目的: 观察D-氨基葡萄糖衍生物体外对人胃癌SGC-7901细胞增生的影响, 探讨其可能作用机制.
方法: 采用MTT法, 筛选药物作用最佳浓度. 用流式细胞仪分析诱导凋亡前后的细胞DNA含量, 透射电镜观察凋亡细胞的超微结构. 免疫组化测定CD44表达.
结果: D-氨基葡萄糖衍生物能明显抑制胃癌细胞的增长(P<0.01), MTT 法显示抑制程度具有时间和剂量效应关系, 统计组间比较差异有显著性(P<0.01); 流式细胞仪分析可见亚二倍体(Sub-G1)凋亡峰; 电镜观察到凋亡细胞的典型变化, 免疫组化及光密度检测示CD44表达下降(216.5±7.0 vs 190.0±14.2, P = 0.000).
结论: D-氨基葡萄糖衍生物通过诱导肿瘤细胞凋亡而抑制人胃癌SGC-7901细胞增生, 同时还有下调CD44的作用.
引文著录: 吴静, 周芸, 路红, 王玉玲, 王爱勤, 薛群基. D-氨基葡萄糖衍生物对人胃癌细胞系SGC-7901增生的影响. 世界华人消化杂志 2005; 13(6): 720-723
Revised: January 28, 2005
Accepted: February 2, 2005
Published online: March 15, 2005
AIM: To study the in vitro inhibitory effect of amino-D-glucose derivative on the proliferation of the gastric carcinoma cell line SGC-7901.
METHODS: Cell growth was measured by MTT colorimetric assay. DNA content was detected by flow cytometer (FCM). The morphological changes of apoptotic cells were evaluated by transmission electronic microscopy. CD44 expression was analyzed by immunohistochemistry.
RESULTS: Amino-D-glucose derivative inhibited SGC-7901 cell in a time- and dose-dependent manner. After treatment, apoptosis peak was demonstrated by FCM, and apoptotic morphological changes were observed under microscope. Immunohistochemist and image analysis showed that expression of CD44 was downregulated (216.5±7.0 vs 190.0±14.2, P = 0.000).
CONCLUSION: Amino-D-glucose derivative can induce SGC-7901 cell apoptosis, inhibit the cancer proliferation and downregulate expression of CD44 expression.
- Citation: Wu J, Zhou Y, Lu H, Wang YL, Wang AQ, Xue QJ. Effect of amino-D-glucose derivative on proliferation of human gastric carcinoma cell line SGC-7901 in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 720-723
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/720.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.720
D-氨基葡萄糖是一种几乎分布于人体所有组织具有生物活性的小分子. 体外由甲壳类水生物的壳完全降解后所得. D-氨基葡萄糖有独立的抗氧化、抗细菌的特性[1]. 还可用于治疗骨关节炎[2]. 抑制炎症或肉芽组织增生范围扩大[3]. 参与人体肝肾解毒、发挥抗炎护肝作用, 还可以抑制肿瘤细胞的增长[4]. 对其进行部分衍生化后对肿瘤细胞具有诱导分化作用[5]. 研究表明, 将D-氨基葡萄糖连接到抗肿瘤药物5-FU的侧链上可增强其抗肿瘤的作用[6]. D-氨基葡萄糖盐酸盐对小鼠移植瘤有显著的抑制作用, 且高、低剂量对小鼠外周血白细胞、骨髓粒细胞与红细胞比值及荷瘤小鼠体质量无明显的抑制作用. D-氨基葡萄糖衍生物是一种新的抗肿瘤化合物, 其毒性小, 而且可活化NK, LAK细胞, 具有免疫调节作用. 我们通过观察D-氨基葡萄糖衍生物体外对胃癌SGC-7901细胞凋亡的诱导, 探讨其作用机制.
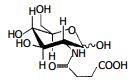
人胃癌细胞株SGC-7901由上海中国科学院细胞库提供. D-氨基葡萄糖衍生物由中国科学院兰州分院化学物理研究所合成、表征和纯化, 纯度为99.9%分子式为: C10H17O8(图1).
RPMI1640培养液, 含100 mL/L小牛血清为美国GIBCO公司生产. 氮蓝四唑盐(MTT)、二甲基亚砜(DMSO)碘化丙锭由实验室提供. 胰酶为美国GIBCO公司生产. 一抗为鼠抗CD44v5mAb, SP试剂盒购自福州迈新生物技术开发有限公司.
人胃癌细胞株SGC-7901, 维持在950 mL/L空气湿度, 用含100 mL/L小牛血清的RPMI1640培养液在50 mL/L CO2, 37℃恒温条件下培养, 48 h换液1次.
1.2.1 MTT比色分析法测定细胞活力: 取对数生长期的胃癌细胞, 1×104/孔接种于96孔培养板中. 设实验组和对照组, 实验组分别加入浓度为0.01, 0.02, 0.04, 0.08, 0.16 mmol/L的D-氨基葡萄糖衍生物, 对照组加等体积的培养液, 每个浓度设4个复孔. 分别培养24、48、72 h后, 每孔加入5 g/L MTT10 μL, 再培养4 h弃去上清液, 加入DMSO 100 μL, 振荡10 min, 使结晶甲臢充分溶解, 在酶联仪吸收波长490 nm处, 测每孔吸光度A值, 计算: 杀伤率(%)=(对照孔A值-实验孔A值)/对照孔A值×100%
1.2.2 流式细胞技术分析: 取对数生长期细胞1×107个接种于培养瓶中, 于24 h细胞贴壁后, 加入D-氨基葡萄糖衍生物, 药物浓度为 0.04 mmol/L 继续培养72 h后, 机械吹打收集细胞, PBS洗涤后制成细胞悬液, 约107个细胞悬于200 μL PBS中加入750 mL/L冰冷乙醇4 mL冰浴过夜, 离心后重新悬浮于800 μL PBS中, 最后加入50 mg/L碘化丙锭100 μL, 37℃暗盒中孵育30 min, 流式细胞仪分析: 用480 nm度长的光束分析每个细胞总DNA, 每组细胞样品分析1×104个细胞, 所得数据用Multicgcle软件分析.
1.2.3 透射电镜观察: 细胞经0.04 mmol/L药物处理, 72 h后收集离心(2 500 r/min, 10 min), 用25 g/L戊二醛前固定, 10 g/L四氧化锇酸后固定, 梯度乙醇脱水, 环氧树脂包埋, 超薄切片, 醋酸双氧铀和枸橼酸铅染色晾干, 透射电镜观察凋亡细胞的超微结构特征.
1.2.4 免疫组织化学SP染色: 取对数生长期的细胞接种后爬片, 于24 h细胞贴壁后, 设实验组和对照组, 实验组加入浓度为0.05 mol/L的2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖, 对照组加等体积的培养液, 培养48 h. 按常规SP方法进行, 大致流程如下: 长满SCG-7901细胞的玻片从培养液中取出, PBS冲洗, 置950 mL/L乙醇固定30 min, PBS冲洗5 min, 3 mL/L甲醇双氧水(试剂A)去除内源性过氧化物酶, 1 g/L TritonX-100(PBS)冲洗15 min后滴加正常羊血清(试剂B), 滴加抗CD44鼠抗人mAb, 4℃湿盒内孵育过夜, PBS冲洗后滴加兔抗鼠IgG(试剂C)室温下孵育10 min, 最后滴加SP复合物(试剂D)于室温下孵育10 min 后DAB显色. 经图像分析仪高倍镜下检测平均吸光度, 组间比较.
统计学处理 实验数据用均数±标准差(mean±SD)表示, 用SPSS11.5统计软件进行单因素方差分析.
| 分组 | 药物剂量mmol/L | 吸光度 | 抑制率(%) | ||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | ||
| 对照组b | 0 | 0.546±0.03 | 0.780±0.02 | 1.096±0.04 | 0 | 0 | 0 |
| 实验组 | 0.01 | 0.512±0.01 | 0.561±0.02 | 0.687±0.02 | 6.23 | 28.08 | 37.32 |
| 0.02 | 0.383±0.02 | 0.342±0.03 | 0.367±0.05 | 29.85 | 56.15 | 66.51 | |
| 0.04 | 0.307±0.03 | 0.282±0.03 | 0.280±0.03 | 43.77 | 63.85 | 74.45 | |
| 0.08 | 0.310±0.01 | 0.279±0.02 | 0.262±0.03 | 43.22 | 64.23 | 76.09 | |
| 0.16 | 0.269±0.02 | 0.250±0.01 | 0.226±0.03 | 50.73 | 67.95 | 79.38 | |
可以看出D-氨基葡萄糖衍生物能明显抑制胃癌细胞的增长. 随着药物浓度的升高, 作用时间的延长, 对SGC-7901细胞的抑制率也升高.
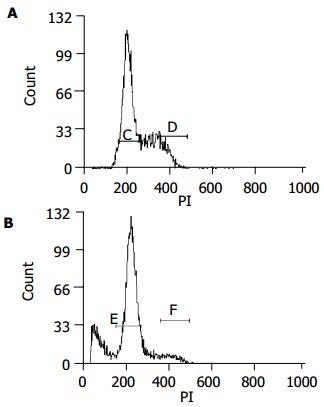
用药处理后的胃癌细胞周期直方图上, G1峰前出现的亚二倍体(Sub-G1)峰, 即凋亡峰, 是凋亡细胞核固缩、DNA裂解的特征, 可通过凋亡峰的面积测出凋亡细胞在整个细胞群中所占比例. 结果显示0.04 mmol/L D-氨基葡萄糖衍生物作用细胞72 h后, G1峰前出现了凋亡峰, 凋亡细胞占细胞总数24.65±1.74%(图2A), 而对照组凋亡细胞比例为4.13±1.41%(图2B). 同时SGC-7901细胞周期G1期细胞数明显增加, 由未经处理对照组43.54±2.03%增加为83.51±2.11%, 而S期细胞比例由35.66±1.84%减少至14.61±1.92%. 实验组与对照组相比差异有显著性(P<0.01).
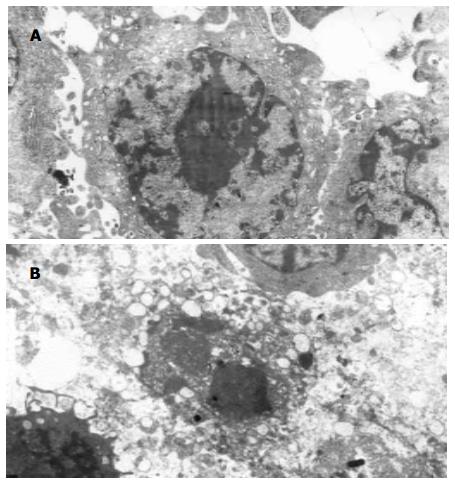
在透射电镜下, 未经药物处理的胃癌细胞SGC-7901形态结构规则, 染色质分布均匀, 细胞膜完整(图3A). 在0.04 mmol/L的D-氨基葡萄糖衍生物作用72 h后, 细胞呈现细胞皱缩, 核固缩染色质边集于核膜处, 出现"酶原样"高电子密度的颗粒和空泡明显增多. 分析其来源主要有以下两种可能: (1)细胞凋亡时, 细胞功能处于整体无序而局部有序的状态, 因而细胞尚具有某些合成功能, 如酶原的合成. 但由于细胞功能的整体无序, 而无法将其分泌到胞外, 从而在细胞内潴留. (2)细胞凋亡时, 由凋亡相关基因合成某些与凋亡有关的酶(图3B).
细胞浆染成棕黄色为阳性, 以细胞膜性表达为主, 部分细胞呈细胞浆或细胞膜和细胞浆混合性表达. 对照组平均吸光度A值为216.5± 7.0加药组平均吸光度A值为190.0±14.2, F = 27.998, P = 0.000表明 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖可下调肿瘤细胞表面黏附分子CD44表达.
细胞凋亡过程如果被抑制, 引起细胞数的正动态失衡, 就会导致肿瘤发生[7-8]. 细胞凋亡与肿瘤发病的关系为抗癌药物的研究提供了新的药理学机制和新靶点[9]. 目前有关化疗诱导胃癌细胞凋亡的研究国内外报道较多. 但利用D-氨基葡萄糖衍生物诱导胃癌细胞凋亡的研究国内外尚未见报道. 我们以人胃癌细胞系SGC-7901细胞为靶细胞, 观察D-氨基葡萄糖衍生物对SGC-7901细胞增生的影响及诱导凋亡的作用. 胃癌是我国最常见的恶性肿瘤, 对无法手术的晚期胃癌, 寻求有效的药物进行综合治疗以改善预后和提高生活质量十分重要. 作为抗肿瘤药若能大量地诱发癌细胞的凋亡, 激活其自发的程序性死亡过程, 就可避免因大量细胞坏死而释放胞内物质引起的各种副作用, 减轻化疗对正常组织的损伤, 延长患者的生存期[10-11]. 药物诱导肿瘤细胞凋亡的能力, 是判定抗癌药物疗效的一种指标, 他已成为筛选抗癌药的一种新指标[12]. 我们应用FCM检测细胞凋亡和观察细胞超微结构的改变发现, D-氨基葡萄糖衍生物不但明显抑制胃癌细胞生长, 并且能诱导胃癌细胞凋亡[13-15]. 流式细胞仪显示, 经D-氨基葡萄糖衍生物处理后, 细胞周期发生变化, G1期细胞增多, S期较对照组有明显下降. 提示D-氨基葡萄糖衍生物对SGC-7901增生的抑制主要将细胞周期阻滞在G1期从而失去进入有丝分裂的能力. 在进展期胃癌患者特别是化疗疗效不显著的实体肿瘤来说, G0期细胞比较多[16]. 在细胞周期直方图上出现凋亡峰, 表明D-氨基葡萄糖衍生物有诱导细胞凋亡的作用. 推测其可能原因: (1) D-氨基葡萄糖衍生物引起细胞膜通透性增加, 导致胃癌细胞内(Ca2+)明显升高从而启动凋亡信号传导[17]; (2)启动细胞凋亡相关基因表达. MTT法研究也显示药物对肿瘤细胞的抑制率与浓度和时间呈正相关性. 随时间的延长和剂量的增加, SGC-7901细胞的抑制率呈上升趋势, 但当浓度升到0.04 mmol/L时, D-氨基葡萄糖衍生物的抑癌趋势渐平缓, 这说明D-氨基葡萄糖衍生物在一定浓度范围内时, 对胃癌细胞的抑制作用较好, 超过一定范围时, 抑癌效果不再明显增加.
细胞黏附分子CD44是一种分布广泛的跨膜糖蛋白, 介导细胞与细胞、细胞与间质之间的黏附[18-20]. CD44能与细胞外基质中的透明质酸、胶原蛋白、纤粘蛋白、层粘蛋白等基质分子结合, 与细胞骨架蛋白结合, 参与细胞的迁移运动是肿瘤细胞浸润和转移的启动因素[21-24]. 已有资料发现肿瘤组织中异常表达CD44, 与其转移有相关性[25-28]. 从实验结果看, D-氨基葡萄糖衍生物体外能有效地抑制胃癌细胞株增生并诱导其凋亡, 并可诱导细胞表面黏附分子CD44表达的下降. 同时研究还发现该化合物对正常人骨髓基质细胞无明显的生长抑制的作用, 可能表明其毒副作用小, 有望成为一种新的有效的抗癌药物. 该化合物易得、价廉, 有很好的应用前景, 因而深入研究其作用机制和体内抗癌, 以求提高疗效, 减少不良反应, 无疑将有重大的临床意义.
编辑: 张海宁 电编: 潘伯荣
| 1. | O'Rourke M. Determining the efficacy of glucosamine and chondroitin for osteoarthritis. Nurse Pract. 2001;26:44-52. [PubMed] |
| 2. | McAlindon TE, LaValley MP, Gulin JP, Felson DT. Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta-analysis. JAMM. 2000;283:1469-1475. [PubMed] |
| 3. | Delafuente JC. Glucosaminein the treatment of osteoarthritis. Rheum Dis Clin North Am. 2000;26:1-11. [PubMed] |
| 5. | 王 哲, 乔 岩, 黄 高升, 王 爱勤, 张 永清, 冯 冀良, 杨 国嵘, 郭 英, 梁 蓉. N-乙酰氨基葡萄糖诱导白血病细胞K562向巨噬细胞分化. 第四军医大学学报. 2003;24:46. |
| 7. | Lu CX, Fan TJ, Hu GB, Cong RS. Apoptosis-inducing factor and apoptosis. Shengwu Huaxue Yu Shengwu Wuli Xuebao(Shanghai). 2003;35:881-885. [PubMed] |
| 8. | Jaattela M. Programmed cell death: many ways for cells to die decently. Ann Med. 2002;34:480-488. [PubMed] |
| 9. | Li DQ, Wang ZB, Bai J, Zhao J, Wang Y, Hu K, Du YH. Effects of mifepristone on proliferation of human gastric adenocarcinoma cell line SGC-7901 in vitro. World J Gastroenterol. 2004;10:2628-2631. [PubMed] |
| 10. | Mate MJ, Ortiz-Lombardia M, Boitel B, Haouz A, Tello D, Susin SA, Penninger J, Kroemer G, Alzari PM. The crystal structure of the mouse apoptosis-inducing factor AIF. Nat Struct Biol. 2002;9:442-446. [PubMed] |
| 11. | Cande C, Cohen I, Daugas E, Ravagnan L, Larochette N, Zamzami N, Kroemer G. Apoptosis-inducing factor(AIF): a novel caspase-independent death effector released from mitochondria. Biochimie. 2002;84:215-222. [PubMed] |
| 12. | Joza N, Susin SA, Daugas E, Stanford WL, Cho SK, Li CY, Sasaki T, Elia AJ, Cheng HY, Ravagnan L. Essential role of the mitochondrial apoptosis inducing factor in programmed cell death. Nature. 2001;410:549-554. [PubMed] |
| 13. | Gu ZQ, Sun YH, Xu CL, Liu Y. Study of baicalin in inducing prostate cancer cell line DU145 apoptosis in vitro. Zhongguo Zhongyao Zazhi. 2005;30:63-66. [PubMed] |
| 14. | Richy F, Bruyere O, Ethgen O, Cucherat M, Henrotin Y, Reginster JY. Structural and symptomatic efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive meta-analysis. Arch Intern Med. 2003;163:1514-1522. [PubMed] |
| 15. | Dwarakanath BS, Khaitan D, Ravindranath T. 2-deoxy-D-glucose enhances the cytotoxicity of topoisomerase inhibitors in human tumor cell lines. Cancer Biol Ther. 2004;3:864-870. [PubMed] |
| 16. | Gibbs JB. Anticancer drug targets : growth factors and growth factor signaling. J Clin Invest. 2000;105:9-21. [PubMed] |
| 19. | Lakshman M, Subramaniam V, Wong S, Jothy S. CD44 promotes resistance to apoptosis in murine colonic epitheliu. J Cell Physiol. 2004;16:1-6. [PubMed] |
| 20. | Yang W, Toffa SE, Lohn JW, Seifalian AM, Winslet MC. Malignant ascites increases the antioxidant ability of human ovarian(SKOV-3)and gastric adenocarcinoma(KATO-III)cells. Gynecol Oncol. 2005;96:430-438. [PubMed] |
| 21. | Gong Y, Sun X, Huo L, Wiley EL, Rao MS. Expression of cell adhesion molecules, CD44s and E-cadherin, and microvessel density in invasive micropapillary carcinoma of the breast. Histopathology. 2005;46:24-30. [PubMed] |
| 22. | Chuang CK, Liao SK. Differential expression of CD44 variant isoforms by cell lines and tissue specimens of transitional cell carcinomas. Anticancer Res. 2003;23:4635-4639. [PubMed] |
| 23. | Makrydimas G, Zagorianakou N, Zagorianakou P, Agnantis NJ. CD44 family and gynaecological cancer. In Vivo. 2003;17:633-640. [PubMed] |
| 24. | Messinetti S, Giacomelli L, Fabrizio G, Giarnieri E, Gabatel R, Manno A, Feroci D, Guerriero G, Masci E, Vecchione A. CD44v6 and Nm23-H1 protein expression related to clinico pathological parameters in colorectal cancer. Ann Ital Chir. 2003;74:45-51. [PubMed] |
| 25. | Kim HS, Park YB, Oh JH, Jeong J, Kim CJ, Lee SH. Expression of CD44 isoforms correlates with the metastatic potential of osteosarcoma. Clin Orthop. 2002;396:184-190. [PubMed] |
| 26. | Gunthert U, Hofmann M, Rudy W, Reber S, Zoller M, Haussmann I, Matzku S, Wenzel A, Ponta H, Herrlich P. A new variant of glycoprotein CD44 confers metastatic potential to rat carcinoma cells. Cell. 1991;65:13-22. [PubMed] |
| 27. | Gu H, Shang P, Zhou C. Expression of CD44v6 and E-cadherin in prostate carcinoma and metastasis of prostate carcinoma Article in Chinese. Zhonghua Nan Ke Xue. 2004;10:32-38. [PubMed] |
| 28. | Wong K, Rubenthiran U, Jothy S. Motility of colon cancer cells: modulation by CD44 isoform expression. Exp Mol Pathol. 2003;75:124-130. [PubMed] |