修回日期: 2005-01-15
接受日期: 2005-01-26
在线出版日期: 2005-03-15
目的: 研究尿激酶型纤溶酶原激活系统uPA, uPAR, PAI-1蛋白及血管内皮生长因子(VEGF)在胃癌组织中的表达及其与胃癌生物学行为的关系.
方法: 采用免疫组化S-P法检测67例胃癌及癌旁组织中uPA, uPAR, PAI-1及VEGF蛋白表达情况, 同时结合临床生物学特征进行分析.
结果: 癌和癌周比较uPA, uPAR, PAI-1及VEGF蛋白阳性表达率明显升高(P<0.01), 阳性产物主要分布在癌细胞胞质中. 侵及浆膜组阳性率明显高于未及浆膜组(P = 0.000, 0.014, 0.016, 0.000). uPA, uPAR蛋白在淋巴结转移组中的阳性率明显高于无淋巴结转移组(P = 0.002, 0.008). PAI-1蛋白在低分化组中的阳性率明显低于中分化和高分化组(P<0.05). uPA, uPAR及VEGF蛋白阳性率在胃癌组织不同分化程度间差异无显著性. 在胃癌组织中uPA, uPAR蛋白的表达呈显著正相关(r = 0.653, P<0.001). 在uPA, uPAR蛋白同时阳性的41例病例中, 有28例发生淋巴结转移, 与阴性组(4/15)相比, 转移发生率明显增高(P<0.01). 胃癌组织中uPA蛋白表达与VEGF表达显著正相关(r = 0.300, P<0.05). PAI-1蛋白表达与VEGF表达具有极显著正相关性(r = 0.413, P<0.01). 应用COX回归模型进行多变量分析并采用向前逐步回归法, 仅浸润深度、uPA表达和病理类型对淋巴结转移有影响.
结论: uPA、uPAR、PAI-1及VEGF蛋白在胃癌组织中表达增强, uPA, uPAR与胃癌浸润转移密切相关.
引文著录: 秦蓉, 盛霞, 吴继锋, 王道斌. 胃癌组织中uPA系统及VEGF表达与侵袭转移的关系. 世界华人消化杂志 2005; 13(6): 706-710
Revised: January 15, 2005
Accepted: January 26, 2005
Published online: March 15, 2005
AIM: To detect the expression of urokinase-type plasminogen activator (uPA), uPA receptor (uPAR), plasminogen activator inhibitor type 1 (PAI-1) and vascular endothelial growth factor (VEGF) in human gastric cancer (GC) and to reveal their correlation to the major clinicopathological characteristics including tumor invasion and metastasis.
METHODS: Expression of uPA, uPAR, PAI-1 and VEGF was examined in the tissue sections from 67 cases of human GC using streptoavidin-biotin-peroxidase immunohistochemistry method.
RESULTS: The expression of uPA, uPAR, PAI-1 and VEGF was mainly located in the cytoplasm of GC cells. The expression of uPA, uPAR, PAI-1 and VEGF in GC was significantly higher than in the cancer-adjacent tissue (P<0.01). The expression of uPA, uPAR, PAI-1 and VEGF in GC with serosa invasion was significantly higher than that in cancer without serosa invasion (P<0.05). Positive rates of staining for uPA and uPAR in GC with lymph node metastasis were significantly higher compared to cancer without lymph node metastasis (P = 0.002 and 0.008 respectively). The expression of PAI-1 was significantly associated with the differentiation degree of cancer (P<0.01), while no relationship was found between the expression of uPA, uPAR, VEGF and the differentiation degree of cancer. The expression of uPA was correlated with uPAR in cancer tissue(r = 0.653, P<0.001). In 41 cases positive for uPA and uPAR, 28 were with lymph node metastasis (P<0.01, compared with 4/15). Positive correlation was observed between the expression of uPA and VEGF protein (r = 0.300, P<0.05), and between PAI-1 and VEGF (r = 0.413, P< 0.01). Multivariate Cox regression analysis indicated that only the depth of invasion, the expression of uPA and the differentiation affected lymph node metastasis in GC.
CONCLUSION: Expression of uPA, uPAR, PAI-1 and VEGF protein is increased in gastric cancer. uPA and uPAR may play an important role in the invasion and metastasis through VEGF which promotes angiogenesis.
- Citation: Qin R, Sheng X, Wu JF, Wang DB. Expression of urokinase-type plasminogen activator system and vascular endothelial growth factor in human gastric cancer and the relationship with tumor invasion and metastasis. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 706-710
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/706.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.706
尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator, uPA)是一种蛋白水解酶, 其介导的纤维蛋白降解作用能破坏细胞外基质和基底膜, 在肿瘤浸润转移中起重要作用[1-2]. 肿瘤诱导的血管生成反应亦与其生物学行为密切相关, 血管内皮生长因子(vascular endothelial growth factor, VEGF)被认为是作用最强、特异性最高的血管生成调控因子[3]. 我们采用免疫组织化学方法检测67例胃癌组织中uPA, uPAR, PAI-1及VEGF的表达, 探讨其与胃癌生物学行为的关系.
安徽医科大学附属医院1994-10/1997-10胃癌手术切除标本67例, 术前未接受过抗肿瘤治疗. 男54例, 女13例; 年龄23-73(中位56)岁; 胃贲门部29例, 胃体部24例, 胃窦部14例. 组织学Ⅰ级即高分化乳头状(或管状)腺癌13例, Ⅱ级即中分化管状腺癌19例, Ⅲ级即低分化腺癌、黏液细胞癌和黏液腺癌共35例. 临床TNMⅠ, Ⅱ期57例, Ⅲ, Ⅳ期10例. 以癌旁组织为对照. 所有标本组织经40 g/L甲醛固定, 常规石蜡包埋.4 μm厚连续切片.
采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(S-P)方法. 兔抗人uPA蛋白多克隆抗体(BA0405)、兔抗人uPAR蛋白多克隆抗体(BA1368)、兔抗人PAI-1蛋白多克隆抗体(BA1334)均购自武汉博士德生物技术公司, 工作浓度分别为1: 50, 1: 100, 1: 100. VEGF多克隆抗体、免疫组化S-P试剂盒均购自北京中山生物技术公司, VEGF工作浓度为1: 50. 每批染色均用已知阳性切片作阳性对照, 用PBS代替一抗作阴性对照. 染色结果判断分别按阳性细胞百分数及染色强度计分. 阳性细胞数为0, 计0分; 1%-25%计1分; 26%-50%计2分; >50%计3分. 染色阴性计0分; 淡黄色计1分; 棕黄色计2分; 棕褐色计3分. 两种积分相加, 积分为0-2分, 表示阴性(-); 积分为3-4分, 表示阳性(+); 积分为5-6分, 表示阳性(++).+、++均视为阳性表达.
统计学处理 应用SPSS10.0统计分析软件包处理, 数据统计采用行×列χ2检验, 相关分析采用Spearman等级相关分析, 应用COX回归模型进行多变量分析并采用向前逐步回归法, P<0.05有统计学意义.
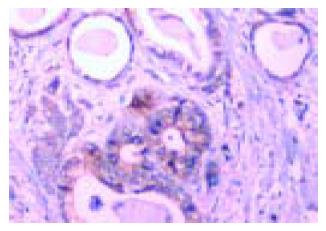
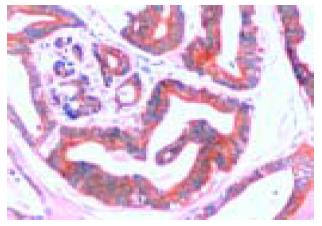
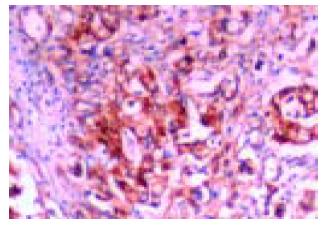
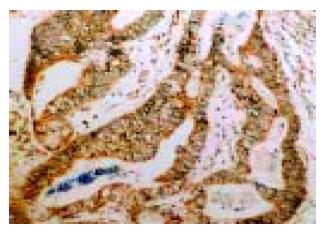
uPA, uPAR蛋白的阳性产物主要位于胃癌细胞的胞质中, 强度深浅不一(图1, 2). 肿瘤内少量成纤维细胞、血管内皮细胞可见较弱的阳性表达. PAI-1蛋白的阳性产物也主要定位于胃癌细胞的胞质中(图3), 但与分化程度有关: 在分化高的胃癌组织, 肿瘤细胞呈弥漫性胞质着色; 随着分化程度降低, 染色有加深趋势, 部分胞质中出现棕褐色颗粒. 上述三种蛋白在癌旁组织都有不同程度的阳性表达, 主要位于不典型增生上皮和肠化上皮. 正常胃黏膜上皮多呈阴性表达. VEGF蛋白阳性信号主要定位于癌细胞胞质(图4), 其表达呈明显异质性, 在低分化癌和印戒细胞癌中的表达多呈强阳性, 一些血管内皮细胞也可见弱的VEGF表达. 在癌旁组织中, 大部分腺上皮呈阴性表达, 在异型增生和肠化的腺体中可见阳性表达. 胃癌组织中uPA, uPAR, PAI-1, VEGF蛋白的阳性表达率分别为68.7%, 68.7%, 70.1%和76.2%, 明显高于他们在癌旁组织中的阳性表达, 分别为28.4%, 31.3%, 40.3%和20.9%, 差异具有显著性意义(P<0.01).
uPA, uPAR, PAI-1, VEGF蛋白在侵及浆膜组中的阳性表达率明显高于未及浆膜组, 差异具有显著性意义(表1). uPA, uPAR蛋白在淋巴结转移组中的阳性率明显高于无淋巴结转移组, 差异具有显著性意义. PAI-1蛋白在低分化组中的阳性率明显低于中分化和高分化组, 差异有显著性(P<0.05). uPA, uPAR, VEGF蛋白阳性率在不同分化程度间差异无显著性. 在胃癌组织中uPA与uPAR蛋白的表达具有极显著正相关性(r = 0.653, P<0.001). 在uPA, uPAR蛋白同时阳性的41例病例中, 有28例发生淋巴结转移, 与阴性组(4/15)相比, 转移发生率明显增高(P<0.01).
| 分类 | n | uPA | uPAR | PAI-1 | VEGF | |||||||||
| - | +~++ | 阳性率(%) | - | +~++ | 阳性率(%) | - | +~++ | 阳性率(%) | - | +~++ | 阳性率(%) | |||
| 年龄(岁) | ||||||||||||||
| <55 | 29 | 9 | 20 | 68.9 | 8 | 21 | 72.4 | 10 | 19 | 65.5 | 5 | 24 | 82.8 | |
| ≥55 | 38 | 12 | 26 | 68.4 | 13 | 25 | 65.8 | 10 | 28 | 73.7 | 11 | 27 | 71.1 | |
| 性别 | ||||||||||||||
| 男 | 54 | 15 | 39 | 72.2 | 15 | 39 | 72.2 | 15 | 39 | 72.2 | 15 | 39 | 72.2 | |
| 女 | 13 | 6 | 7 | 53.8 | 6 | 7 | 53.8 | 5 | 8 | 61.5 | 1 | 12 | 92.3 | |
| 肿瘤大小(cm) | ||||||||||||||
| <5 | 30 | 12 | 18 | 60.0 | 9 | 21 | 70.0 | 8 | 22 | 73.3 | 8 | 22 | 73.3 | |
| ≥5 | 37 | 9 | 28 | 75.7 | 12 | 25 | 67.6 | 12 | 25 | 67.6 | 8 | 29 | 78.4 | |
| 分化程度 | 高分化 | 13 | 4 | 9 | 69.2 | 4 | 9 | 69.2 | 3 | 10 | 76.9 | 6 | 7 | 53.8 |
| 中分化 | 19 | 4 | 15 | 78.9 | 2 | 17 | 89.5 | 2 | 17 | 89.5 | 2 | 17 | 89.5 | |
| 低分化 | 35 | 13 | 22 | 62.9 | 15 | 20 | 57.1 | 15 | 20a | 57.1 | 8 | 27 | 77.1 | |
| 浸润深度 | ||||||||||||||
| 未及浆膜 | 9 | 7 | 2 | 22.2 | 6 | 3 | 33.3 | 7 | 2 | 22.2 | 6 | 3 | 33.3 | |
| 侵及浆膜 | 58 | 14 | 44b | 75.9 | 15 | 43a | 74.1 | 18 | 40a | 68.9 | 10 | 48b | 82.8 | |
| 淋巴结转移 | ||||||||||||||
| 无 | 32 | 16 | 16 | 50.0 | 15 | 17 | 53.1 | 8 | 24 | 75.0 | 8 | 24 | 75.0 | |
| 有 | 35 | 5 | 30b | 85.7 | 6 | 29b | 82.9 | 12 | 23 | 65.7 | 8 | 27 | 77.1 | |
| 临床分期 | ||||||||||||||
| Ⅰ+Ⅱ期 | 58 | 20 | 38 | 65.5 | 20 | 38 | 65.5 | 19 | 39 | 67.2 | 15 | 43 | 74.1 | |
| Ⅲ+Ⅳ期 | 9 | 1 | 8 | 88.9 | 1 | 8 | 88.9 | 1 | 8 | 88.9 | 1 | 8 | 88.9 | |
胃癌组织中uPA蛋白表达与VEGF蛋白表达显著正相关(r = 0.300, P = 0.014<0.05). PAI-1蛋白的表达与VEGF蛋白表达具有极显著正相关性(r = 0.413, P = 0.001<0.01). uPAR与VEGF蛋白表达呈正相关(r = 0.206, P = 0.095). 应用COX回归模型进行多变量分析并采用向前逐步回归法, 得出在诸多临床病理因素以及uPA, uPAR, PAI-1和VEGF蛋白等指标中, 仅浸润深度、uPA表达和病理类型被引进方程, 对淋巴结转移有影响(表2).
| 变量 | 回归系数 | 标准误 | P值 | OR for 95%CI |
| 浸润深度 | 0.346 | 0.167 | 0.043 | 0.012-0.680 |
| uPA表达 | 0.439 | 0.130 | 0.001 | 0.179-0.699 |
| 病理类型 | 0.264 | 0.083 | 0.002 | 0.097-0.431 |
uPA介导的纤溶酶降解系统在肿瘤浸润转移过程中发挥重要作用. uPA是一种丝氨酸蛋白酶, 由多种肿瘤细胞或其他细胞分泌, 通过与细胞膜上的特异性受体uPAR结合发挥作用, 激活纤溶酶原成为纤溶酶. 另外, uPA还激活潜在活性的胶原酶, 与纤溶酶一起均促使细胞外基质(包括层粘连蛋白、纤维连接蛋白、蛋白多糖和Ⅳ型胶原等)和血管基膜的降解, 最终导致肿瘤细胞的浸润和转移[4]. uPA的活性被他的特异性抑制剂PAI-1所调控. 我们的结果显示uPA, uPAR, PAI-1蛋白主要定位于胃癌组织中的癌细胞胞质, 肿瘤内少量成纤维细胞、血管内皮细胞可见较弱的uPA, uPAR蛋白阳性表达. uPA, uPAR, PAI-1蛋白在胃癌组织中的表达较癌旁组织明显增高(P<0.01), 表明随着细胞恶性程度的增高, uPA, uPAR, PAI-1蛋白表达呈增高趋势. 其他学者利用ELISA和免疫组织化学方法检测uPA, uPAR蛋白表达水平时, 亦发现癌中心、癌边缘和正常组织中uPA、uPAR、PAI-1蛋白活性逐渐降低[5-6], 与本结果基本一致. 我们还发现uPA, uPAR蛋白在侵及浆膜组中的阳性表达率明显高于未及浆膜组(P<0.05), 在淋巴结转移组中的阳性率明显高于无淋巴结转移组(P<0.01), 差异均具有显著性意义, 进一步证实了uPA/uPAR系统参与了胃癌的侵袭和转移过程, 这可能是因为高表达uPA和uPAR蛋白的癌细胞降解细胞外基质和基底膜成分的能力增强, 使这部分细胞更易向组织深层和淋巴管浸润, 并导致远处转移. 结果显示, 在胃癌组织中uPA和uPAR蛋白的表达存在显著的正相关(r = 0.653, P<0.001), 提示在胃癌侵袭转移过程中, 对细胞外基质和基底膜的降解作用是二者共同作用的结果. 在uPA, uPAR蛋白同时阳性的41例病例中, 有28例发生淋巴结转移, 与阴性组(4/15)相比, 转移发生率明显增高(P<0.01), 提示在胃癌侵袭转移过程中, uPA, uPAR协同高表达时, 肿瘤细胞可能具有更高的移动性和侵袭力. 最近的研究表明, uPA和uPAR结合后可促进整合素介导的信号传导作用, 而这一信号传导作用又进一步促进肿瘤的转移[7-8]. 目前有关PAI-1在肿瘤生物学中的确切作用还不清楚, 他在纤溶酶原激活系统中可能担当重要的调节剂或者是肿瘤细胞防止自身降解的保护剂而不是这个系统单纯的抑制剂[9]. 也有学者认为, PAI-1在肿瘤浸润转移中与uPA, uPAR有协同和调节作用.
VEGF是一类作用最强、特异性最高的可溶性血管生成促进因子, 他与内皮细胞上的两个特殊受体flt和flk(kDk)结合, 刺激内皮细胞增生, 在肿瘤血管发生中起着重要作用. 在肿瘤血管的生成过程中, 肿瘤也完成了扩展、侵袭和转移, 故VEGF与肿瘤的生长、侵袭和转移等特性密切相关[10-11]. 本结果表明, VEGF蛋白主要表达于胃癌细胞的胞质中, 一些血管内皮细胞也可见弱表达. VEGF在胃癌组织中的阳性表达(76.1%)明显高于癌旁组织(20.9%)(P<0.01), VEGF的表达还与肿瘤浸润深度呈明显正相关(P<0.01). 说明VEGF的表达对肿瘤细胞的恶性表型有一定的作用, 随着肿瘤恶性程度的增高以及侵袭性的增强, 癌细胞必须通过增加VEGF等促血管生成因子的分泌来刺激血管新生, 以满足其自身营养需求. 肿瘤新生血管形成与ECM降解是恶性肿瘤生长、浸润转移过程中的关键因素. uPA系统在肿瘤新生血管形成过程中起重要作用. VEGF可直接刺激肿瘤新生血管形成, 并上调内皮细胞表达uPA, uPA也能直接激活VEGF[12]. VEGF与uPA系统相互作用, 形成正反馈调节环, 极大增加uPA产物, 降解ECM及微血管基底膜, 为内皮细胞迁移、增生以及肿瘤新生血管形成有利的微环境, 同时也有利于癌细胞脱落进入血管或向邻近组织扩散, 为肿瘤的浸润、转移创造条件. 而PAI-1对肿瘤新生血管形成的调节主要包括两方面: 首先PAI-1抑制uPA活性, 防止过分的ECM降解, 适度的ECM降解则是内皮细胞迁移、增生所必需. 其次, PAI-1与uPAR, FN, VN及整合素等相互作用, 通过复杂的信号转导机制调节内皮细胞的黏附、增生和分化, 促进肿瘤血管的发生、形成[13-14]. 本结果显示, 胃癌组织中uPA, PAI-1蛋白表达与VEGF蛋白表达显著正相关(P<0.01), 说明uPA系统与VEGF在胃癌的血管生成中可能起着协同作用, 他们在胃癌的发生发展和浸润转移过程中起着重要作用, uPA在肿瘤转移中的作用可能部分由于其对血管生成的作用. 因此, 采用uPA拮抗剂及血管生成抑制剂可能会抑制胃癌的浸润和转移.
编辑: 张海宁 电编: 潘伯荣
| 1. | Li P, Gao Y, Ji Z, Zhang X, Xu Q, Li G, Guo Z, Zheng B, Guo X. Role of urokinase plasminogen activator and its receptor in metastasis and invasion of neuroblastoma. J Pediatr Surg. 2004;39:1512-1519. [PubMed] |
| 2. | Konno H, Abe J, Kaneko T, Baba M, Shoji A, Sunayama K, Kamiya K, Tanaka T, Suzuki S, Nakamura S. Urokinase receptor and vascular endothelial growth factor are synergistically associated with the liver metastasis of colorectal cancer. Jpn J Cancer Res. 2001;92:516-523. [PubMed] |
| 3. | Ribatti D. The crucial role of vascular permeability factor/vascular endothelial growth factor in angiogenesis: a historical review. Br J Haematol. 2005;128:303-309. [PubMed] |
| 4. | Andreasen PA, Egelund R, Petersen HH. The plasminogen activation system in tumor growth, invasion, and metastasis. Cell Mol Life Sci. 2000;57:25-40. [PubMed] |
| 5. | Cho JY, Chung HC, Noh SH, Roh JK, Min JS, Kim BS. High level of urokinase-type plasminogen activator is a new prognostic marker in patients with gastric carcinoma. Cancer. 1997;79:878-883. [PubMed] |
| 6. | Okusa Y, Ichikura T, Mochizuki H. Prognostic impact of stromal cell-derived urokinase-type plasminogen activator in gastric carcinoma. Cancer. 1999;85:1033-1038. [PubMed] |
| 7. | Yebra M, Goretzki L, Pfeifer M, Mueller BM. Urokinase-type plasminogen activator binding to its receptor stimulates tumor cell migration by enhancing integrin-mediated signal transduction. Exp Cell Res. 1999;250:231-240. [PubMed] |
| 8. | Kugler MC, Wei Y, Chapman HA. Urokinase receptor and integrin interactions. Curr Pharm Des. 2003;9:1565-1574. [PubMed] |
| 9. | Schmitt M, Harbeck N, Thomssen C, Wilhelm O, Magdolen V, Reuning U, Ulm K, Hofler H, Janicke F, Graeff H. Clinical impact of the plasminogen activation system in tumor invasion and metastasis: prognostic relevance and target for therapy. Thromb Haemost. 1997;78:285-296. [PubMed] |
| 10. | Maeda K, Chung YS, Ogawa Y, Takatsuka S, Kang SM, Ogawa M, Sawada T, Sowa M. Prognostic value of vascular endothelial growth factor expression in gastric carcinoma. Cancer. 1996;77:858-863. [PubMed] |
| 11. | Kimura H, Konishi K, Nukui T, Kaji M, Maeda K, Yabushita K, Tsuji M, Miwa A. Prognostic significance of expression of thymidine phosphorylase and vascular endothelial growth factor in human gastric carcinoma. J Surg Oncol. 2001;76:31-36. [PubMed] |
| 12. | Cavallaro U, Tenan M, Castelli V, Perilli A, Maggiano N, Van Meir EG, Montesano R, Soria MR, Pepper MS. Response of bovine endothelial cells to FGF-2 and VEGF is dependent on their site of origin: Relevance to the regulation of angiogenesis. J Cell Biochem. 2001;82:619-633. [PubMed] |
| 13. | Isogai C, Laug WE, Shimada H, Declerck PJ, Stins MF, Durden DL, Erdreich-Epstein A, DeClerck YA. Plasminogen activator inhibitor-1 promotes angiogenesis by stimulating endothelial cell migration toward fibronectin. Cancer Res. 2001;61:5587-5594. [PubMed] |