修回日期: 2004-12-01
接受日期: 2004-12-08
在线出版日期: 2005-03-01
目的: 探讨幼年大鼠内毒素血症对小肠细胞凋亡与增生的影响, 为抗凋亡或促增生治疗提供理论依据.
方法: 用内毒素(4 mg/kg大肠杆菌脂多糖)ip制备幼年大鼠内毒素血症模型, 同等量生理盐水ip为对照组, 分别在注射后0 h(只限于对照组)或死后10 min(只限于内毒素组), 2, 4, 6, 24, 72 h取4 cm远端回肠, HE染色观察小肠绒毛的病理变化, 原位末端标记法(TUNEL)检测小肠上皮的细胞凋亡, 免疫组织化学方法测定增生细胞核抗原(PCNA)的表达.
结果: 内毒素组各时间点小肠绒毛上皮细胞凋亡指数均明显高于对照组(分别为37.4±7.1, 44.1±9.3, 46.6±8.2, 54.7±9.0, 45.3±7.2, 33.9±6.1 vs 0.02±0.01, P<0.01), PCNA表达均明显低于对照组(P<0.05). 注内毒素后2 h上皮细胞凋亡指数明显增加, 随着时间延长, 逐渐增加, 于24 h达高峰, 72 h恢复到6 h的水平; PCNA的表达于2 h (30.2±8.3 vs 74.6±16.2, t = 6.874, P<0.01)明显降低, 4 h (21.4±6.7 vs 74.6±18.7, t = 7.566, P<0.01)和6 h (23.9±14.7 vs 73.6±13.7, t = 6.999, P<0.01)达最低水平, 24 h (35.8±11.4 vs 76.3±11.8, t = 7.010, P<0.01)恢复到2 h的水平, 72 h (59.6±18.0 vs 78.7±16.9, t = 2.185, P = 0.046<0.05)仍未达到正常. 死亡组细胞凋亡指数(33.9±6.1)和PCNA表达(20.2±9.2)分别与注内毒素后2 h和4 h的接近. 将同一时间点的PCNA表达与细胞凋亡指数的比值进行比较发现, 内毒素组的比值(分别为0.8±0.3, 0.5±0.1, 0.5±0.3, 0.6±0.2, 1.3±0.3, 和 0.6±0.2)明显低于正常[(3.2±0.8)×103 - (3.7±0.7)×103](P<0.01), 死亡组比值与注内毒素后4, 6, 24 h的接近, 近于最低点.
结论: 幼年大鼠内毒素血症时小肠上皮细胞凋亡增加, PCNA表达降低, 细胞凋亡与细胞增生之间的平衡破坏是严重感染时肠屏障破坏的病理机制之一.
引文著录: 吴秀清, 王虹, 孙梅, 吕庆杰, 周卓. 幼年大鼠内毒素血症对小肠上皮细胞凋亡及PCNA表达的影响. 世界华人消化杂志 2005; 13(5): 621-625
Revised: December 1, 2004
Accepted: December 8, 2004
Published online: March 1, 2005
AIM: To investigate the effect of endotoxemia on enterocyte apoptosis and proliferation in baby rats, to provide theoretical evidence for anti-apoptotic or growth-promoting therapy.
METHODS: The model of endotoxemia of baby rats was established by intraperitoneal injection of either saline (control) or endotoxin (4 mg/kg of Escherichia coli lipopolysaccharide). 4 cm lower ileum was collected at 0 h (control group only), or within 10 min after dead (endotoxin group only), 2, 4, 6, 24, and 72 h after injection respectively. The pathologic changes of small intestine villus were observed by hematoxylin-eosin (HE) staining. Apoptotic cells were detected by terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling (TUNEL) staining and proliferating cell nuclear antigen (PCNA) expression was measured by immunohistochemistry staining.
RESULTS: Apoptotic activity in each endotoxin group was significantly higher than that of control group (37.4±7.1, 44.1±9.3, 46.6±8.2, 54.7±9.0, 45.3±7.2 and 33.9±6.1 vs 0.02±0.01, P<0.01 respectively). PCNA expression in each endotoxin group was significantly lower than that of corresponding control group (P<0.05). The markedly increased apoptosis index started from 2 h after injection of endotoxin, and increased continually there after, peaked at 24 h, retrieved to the level of 6 h at 72 h. The significantly decreased PCNA expression was found from 2 h (30.2 8.3 vs 74.6 16.2, t = 6.874, P<0.01) after injection of endotoxin, reached the lowest level at 4 h (21.4±6.7 vs 74.6±18.7, t = 7.566, P<0.01) and 6h (23.9±14.7 vs 73.6±13.7, t = 6.999, P<0.01), retrieved to the level of 2 h at 24 h (35.8±11.4 vs 76.3±11.8, t = 7.010, P<0.01), and did not get normal at 72 h (59.6±18.0 vs 78.7±16.9, t = 2.185, P = 0.046). Apoptosis index (33.9±6.1) and PCNA expression (20.2±9.2) in dead group were close to those of 2 h and 4 h after injection of endotoxin respectively. Comparison was made by the time points between ratios of PCNA expression and apoptosis index in the same hours. It was found that the ratios of endotoxin group (0.8±0.3, 0.5±0.1, 0.5±0.3, 0.6±0.2, 1.3±0.3, and 0.6±0.2 respectively) were significantly lower than that of control group [(3.2±0.8)×103-(3.7±0.7)×103] (P<0.01), and that the ratio of dead group was close to those of 4, 6, 24 h after injection of endotoxin group, and it was approximately the lowest level.
CONCLUSION: Enterocyte apoptotic activity is increased and PCNA expression is decreased during endotoxemia in baby rats, and the imbalance between apoptosis and proliferation is one of the pathologic mechanisms of gut barrier impairment during severe infection.
- Citation: Wu XQ, Wang H, Sun M, Lv QJ, Zhou Z. Effect of endotoxemia on enterocyte apoptosis and PCNA expression in baby rats. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 621-625
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/621.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.621
严重感染是儿科危重症中胃肠功能障碍的常见病因之一, 其发病机制与内毒素血症和肠屏障功能破坏密切相关, 内毒素血症可通过缺氧、自由基增多、炎症递质释放致肠屏障功能破坏, 大量细菌移位又加重内毒素血症, 致多器官功能障碍, 甚至引起死亡[1]. 细胞凋亡在增生活跃的胃肠上皮是一个基本生理过程, 增生和凋亡必须很好的同步才能维持黏膜上皮完整性[2-3], 从而确保其功能正常. 小肠细胞凋亡与增生在内毒素血症时肠屏障功能破坏中的作用尚少见报道[4-5]. 我们采用幼年大鼠内毒素血症模型, 对小肠上皮细胞凋亡及增生细胞核抗原(PCNA)的表达进行动态观察, 以探讨内毒素血症时肠屏障破坏的机制, 为抗凋亡或促增生治疗提供理论依据.
18日龄清洁级Wistar大白鼠, 不分雌雄, 体质量22-40 g, 与母鼠共同饲养, 由中国医科大学第二临床学院实验动物中心提供. 随机分为内毒素组和对照组, 每组48只, 各分为6个亚组(考虑到内毒素血症时的死亡率, 内毒素组实际设60只, 取材够数后剩余的鼠继续饲养, 为保证例数均衡, 死亡组只取8只). 内毒素组内毒素(大肠杆菌脂多糖, Sigma公司产品)4 mg/kg ip[6], 配比浓度为4 g/L, 用生理盐水溶解. 对照组(假注射组)生理盐水1 mL/kg ip. 每组动物分别于注射后立即(只限于对照组, 为0点对照)或死后10 min内(内毒素组死亡者), 2, 4, 6, 24, 72 h 6个时间点各随机取8只, 100 mL/L水合氯醛4 mL/kg ip麻醉, 为防止人为污染, 无菌操作下断头处死, 取远端回肠4 cm, 用冰盐水灌注清除小肠内容物, 放入0.1 mol/L PBS配制的40 g/L多聚甲醛溶液中固定保存, 常规石蜡包埋, 切片.
HE染色光镜下观察小肠绒毛的病理变化. 细胞凋亡的检测为原位末端标记法(TUNEL), 试剂盒由武汉博士德生物工程有限公司提供. 按说明书步骤进行, 其中消化步骤采用的是放入0.01 mol/L柠檬酸缓冲液(pH6.0)中, 微波煮沸2 min, 停5 min, 再煮沸1 min, 放置自然凉. 细胞核中有棕黄色颗粒者为凋亡细胞. 阴性对照只加标记缓冲夜, 不加末端脱氧核糖核酸转移酶. PCNA的表达用免疫组织化学方法测定, 试剂盒由武汉博士德生物工程有限公司提供, 一抗为1: 160小鼠抗-PCNA, 按说明书方法操作. 细胞核中有棕褐色颗粒者为PCNA阳性表达. 以PBS代替一抗作为阴性对照. 应用MetaMoph/C-5050/BX41(UIC/Olympus, US/JP)显微图像分析系统, 每张切片取6个高倍视野进行分析. 光镜下400× 计数100个细胞中凋亡细胞数, 以凋亡指数表示; 对PCNA的表达进行阳性染色的单位面积积分光密度值测定, 并用积分光密度值的千分之一表示; 所得结果取均值作为每张切片的值.
统计学处理 用SPSS11.0统计软件包进行, 所有资料均采用mean±SD表示, 组间比较采用方差分析和LSD法(方差齐)及矫正t检验(方差不齐), P<0.05为差异有显著意义.
内毒素组动物注药后30 min出现倦怠、抖动; 1 h后出现腹泻、腹胀、呼吸快; 4-6 h出现口唇、四肢青紫, 周身凉, 腹胀加重, 死亡9只; 24 h吃奶减少, 腹泻、腹胀持续, 体重不增, 活动少, 又死亡3只; 72 h体质量下降明显, 腹胀、呼吸快减轻, 无死亡. 对照组未见异常, 3 d内体质量增长良好. 在HE染色光镜下观察, 内毒素组小肠在2 h未见明显异常, 在4, 6, 24, 72 h及死亡组可见炎细胞浸润. 对照组各时间点小肠绒毛结构正常.
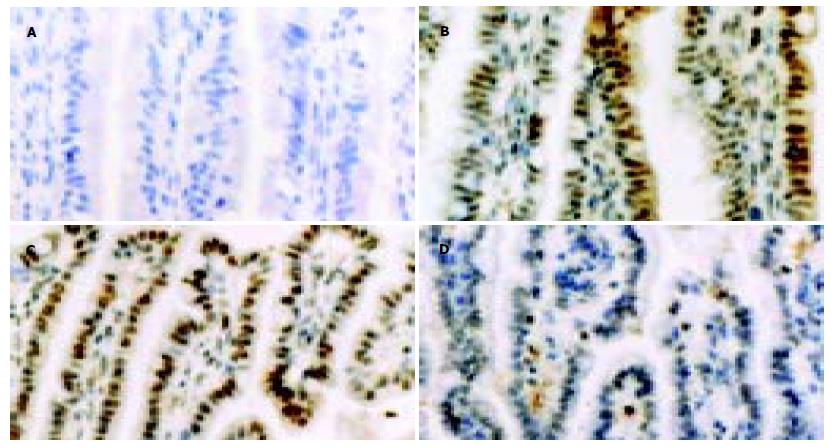
内毒素ip后小肠组织, 凋亡阳性细胞数较多, 以肠绒毛端为主. 各时间点细胞凋亡指数分别为37.4±7.1(2 h), 44.1±9.3(4 h), 46.6±8.2(6 h), 54.7±9.0(24 h), 45.3±7.2(72 h)和33.9±6.1(死亡), 而对照组仅为0.02±0.01(P<0.01)(图1).
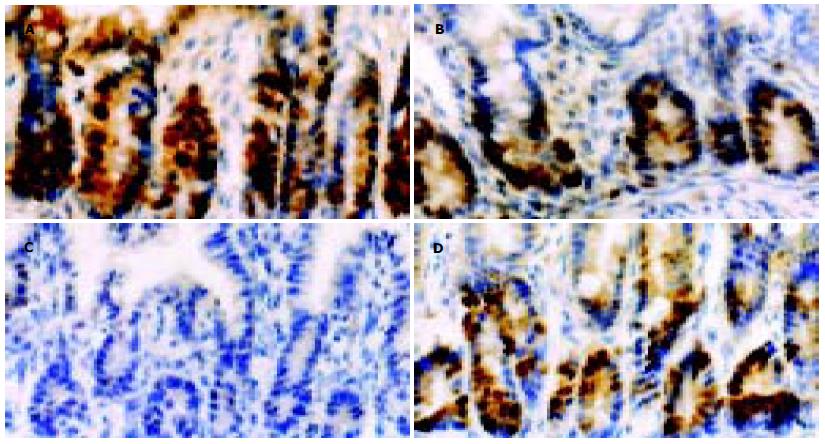
正常小肠组织, 胞核PCNA阳性染色很多, 棕褐色, 位于肠绒毛基底部. 内毒素ip后小肠组织, 胞核PCNA阳性染色明显减少. 内毒素ip后2 h PCNA的表达就明显降低(t = 6.874, P<0.01), 4-6 h近于最低(t = 7.566, P<0.01, t = 6.999, P<0.01), 24 h有所恢复(t = 7.010, P<0.01), 72 h未恢复到正常(t = 2.185, P = 0.046<0.05), 死亡组PCNA的表达则是最低点(t = 7.152, P<0.01). 内毒素组PCNA表达与凋亡指数的比值明显低于正常(P<0.01), 死亡组的比值与内毒素组4-24 h的接近(表1, 图2).
严重感染是儿科危重症中胃肠功能障碍的常见病因之一[1,7], 但其发病机制还不清楚. 研究提示, 败血症时发生了肠黏膜萎缩[8], 因此, 人们设想, 细胞凋亡增加或细胞增生能力减低在严重感染时肠功能障碍的机制中可能起一定作用. 本结果显示, 内毒素组光镜下只见到炎细胞浸润, 因此普通的光镜病理变化不能证明败血症时发生了肠屏障结构破坏. 原位细胞凋亡(TUNEL)检测则证明, 幼年大鼠内毒素血症时小肠细胞确实发生了凋亡增加. 内毒素组各时间点小肠绒毛上皮细胞凋亡指数均明显高于对照组, 差异有非常显著意义(P<0.01), 注内毒素后2 h上皮细胞出现明显凋亡, 随着时间的延长, 凋亡指数逐渐增加, 到24 h达高峰, 72 h后恢复到6 h的水平, 而死亡组细胞凋亡的程度则与2 h组的接近.
增生细胞核抗原(proliferating cell nuclear antigen, PCNA)又称周期蛋白, 是一种核内蛋白质, 是细胞增生时所需的DNA聚合酶辅助蛋白, 通常用来作为细胞增生的标志物, 其本身也参与对细胞周期的调控[4,9-10]. 本结果看出, 内毒素组各时间点小肠绒毛上皮细胞PCNA的表达均明显低于对照组, 差异有显著意义(P<0.05), 内毒素ip后2 h PCNA的表达就明显降低, 4-6 h近于最低, 24 h有所恢复, 但72 h仍未恢复到正常水平, 死亡组PCNA的表达则是最低点. 提示, 内毒素血症时小肠上皮细胞不仅发生了凋亡, 而且出现了增生受抑, 即增生和凋亡双向异常共同造成了细胞结构平衡的破坏, 由此引起一系列肠功能障碍的表现[6-7]. 此与以往的一些研究报道结果一致[5,11-14].
细胞凋亡参与肠屏障功能的破坏[6,15-28], 但凋亡程度与动物死亡之间的关系却未见分析, 我们发现, 内毒素血症死亡组肠细胞凋亡程度并不是最重的, 因此仅用细胞凋亡一个指标来衡量肠屏障结构的损伤程度是不够的, 因为肠组织结构的完整取决于细胞增生与凋亡之间的平衡[29-32], 尤其在3 mo之内处于生长发育阶段的大鼠, 其肠细胞是以增生为主[4], 因此细胞增生受抑的程度对幼年大鼠肠结构破坏起更主要作用, 本死亡组的PCNA表达在各组中最低也证实了这一点. 为了观察增生与凋亡之间平衡破坏的程度, 本文将PCNA表达与凋亡指数的比值进行比较, 发现内毒素组的比值均远远低于正常, 除72 h的 P<0.05之外, 其余各组的都是P<0.01. 死亡组的比值与内毒素组4-24 h的比值接近, 在统计学上没有差异, 可认为是各组中的最低点.72 h后其比值呈回升趋势, 但仍未达正常. 这个结果与临床所观察的死亡动物多发生在注内毒素后24 h之内, 72 h后死亡减少, 但动物胃肠功能障碍仍持续相符. 该研究证明, 小肠细胞增生与凋亡之间平衡破坏的严重程度与动物死亡密切相关. 出现24 h内死亡多, 72 h后死亡反而少的情况, 其原因可能为: (1)内毒素血症早期不断增加肠细胞凋亡, 同时抑制肠细胞的增生, 破坏了肠屏障结构, 致肠功能障碍, 大量细菌移位又加重内毒素血症, 致多器官功能障碍, 甚至引起死亡[1]. (2)随着肠功能障碍的继续, 能量吸收减少, 加上内毒素血症造成的系统炎症反应耗竭能量[33], 主动耗能的凋亡过程受到限制或凋亡细胞在体内部分被吞噬清除[7], (3)机体代偿性调节细胞增生以维持肠黏膜的完整性, 使增生与凋亡的比值得以回升, 肠黏膜结构的破坏暂时得以减轻.
上述结果提示, 幼年大鼠内毒素血症时小肠上皮细胞凋亡增加, PCNA表达降低, 细胞凋亡与增生之间的平衡破坏是严重感染时肠屏障破坏的病理机制之一, 导致死亡的因素不是取决于肠细胞凋亡的程度, 而可能是取决于细胞增生与凋亡之间平衡破坏的程度. 本研究为治疗小儿严重感染时应用抗凋亡或促增生药物治疗胃肠功能障碍提供了理论依据.
电编: 潘伯荣
| 2. | Szabo I, Tarnawski AS. Apoptosis in the gastric mucosa: molecular mechanisms, basic and clinical implications. J Pysiol Pharmacol. 2000;51:3-15. [PubMed] |
| 3. | Tarnawski AS, Szabo I. Apoptosis-programmed cell death and its relevance to gastrointestinal epithelium: survival signal from the matrix. Gastroenterology. 2001;120:294-299. [PubMed] |
| 4. | Wang L, Li J, Li Q, Zhang J, Duan XL. Morphological changes of cell proliferation and apoptosis in rat jejunal mucosa at different ages. World J Gastroenterol. 2003;9:2060-2064. [PubMed] |
| 5. | Sukhotnik I, Mogilner J, Krausz MM, Lurie M, Hirsh M, Coran AG, Shiloni E. Oral arginine reduces gut mucosal injury caused by lipopolysaccharide endotoxemia in rat. J Surg Res. 2004;122:256-262. [PubMed] |
| 6. | Alscher KT, Phang PT, McDonald TE, Walley KR. Enteral feeding decreases gut apoptosis, permeability, and lung inflammation during murine endotoxemia. Am J Physiol Gastrointest Liver Physiol. 2001;281:G569-576. [PubMed] |
| 7. | Behrns KE, Schrum LW, Que FG. Apoptosis: cell death by proteolytic scalpel. Surgery. 1999;126:463-468. [PubMed] |
| 8. | Piguet PF, Vesin C, Donati Y, Barazzone C. TNF-induced enterocyte apoptosis and detachment in mice: induction of caspases and prevention by a caspase inhibitor, ZVAD-fmk. Lab Invest. 1999;79:495-500. [PubMed] |
| 9. | Ezaki T, Yao L, Matsuno K. The identification of proliferating cell nuclear antigen (PCNA) on rat tissue cryosections and its application to double immunostaining with other markers. Arch Histol Cytol. 1995;58:103-115. [PubMed] |
| 10. | Sheen-Chen SM, Ho HT, Chen WJ, Eng HL. Obstructive jaundice alters proliferating cell nuclear antigen expression in rat small intestine. World J Surg. 2003;27:1161-1164. [PubMed] |
| 12. | Varedi M, Chinery R, Greeley GH Jr, Herndon DN, Englander EW. Thermal injury effects on intestinal crypt cell proliferation and death are cell position dependent. Am J Physiol Gastrointest Liver Physiol. 2001;280:G157-163. [PubMed] |
| 13. | 王 立生, 潘 令嘉, 陈 村龙, 李 明松, 孙 勇, 张 亚历, 周 殿元. 双歧杆菌对裸鼠移植大肠癌增生与凋亡的原位研究. 世界华人消化杂志. 2000;8:429-431. [DOI] |
| 15. | Evans SM, Ashwood P, Warley A, Berisha F, Thompson RP, Powell JJ. The role of dietary microparticles and calcium in apoptosis and interleukin-1b release of intestinal macrophages. Gastroenterology. 2002;123:1543-1553. [PubMed] |
| 16. | Monack DM, Navarre WW, Falkow S. Salmonella-induced macrophage death: the role of caspase-1 in death and inflammation. Microbes Infect. 2001;3:1201-1212. [PubMed] |
| 17. | Sukhotnik I, Khateeb K, Krausz MM, Sabo E, Siplovich L, Coran AG, Shiloni E. Sandostatin impairs postresection intestinal adaptation in a rat model of short bowel syndrome. Dig Dis Sci. 2002;47:2095-2102. [PubMed] |
| 18. | Paris F, Fuks Z, Kang A, Capodieci P, Juan G, Ehleiter D, Haimovitz-Friedman A, Cordon-Cardo C, Kolesnick R. Endothelial apoptosis as the primary lesion initiating intestinal radiation damage in mice. Science. 2001;293:293-297. [PubMed] |
| 19. | Sileri P, Morini S, Sica GS, Schena S, Rastellini C, Gaspari AL, Benedetti E, Cicalese L. Bacterial translocation and intestinal morphological findings in jaundiced rats. Dig Dis Sci. 2002;47:929-934. [PubMed] |
| 20. | Husain SS, Szabo IL, Tamawski AS. NSAID inhibition of GI cancer growth: clinical implications and molecular mechanisms of action. Am J Gastroenterol. 2002;97:542-553. [PubMed] |
| 21. | Sun Z, Wang X, Wallen R, Deng X, Du X, Hallberg E, Andersson R. The influence of apoptosis on intestinal barrier integrity in rats. Scand J Gastroenterol. 1998;33:415-422. [PubMed] |
| 22. | Abreu MT, Palladino AA, Arnold ET, Kwon RS, McRoberts JA. Modulation of barrier function during Fas-mediated apoptosis in human intestinal epithelial cells. Gastroenterology. 2000;119:1524-1536. [PubMed] |
| 23. | Keefe DM, Brealey J, Goland GJ, Cummins AG. Chemotherapy for cancer causes apoptosis that precedes hypoplasia in crypts of the small intestine in humans. Gut. 2000;47:632-637. [PubMed] |
| 24. | Rollwagen FM, Yu ZY, Li YY, Pacheco ND. IL-6 rescues enterocytes from hemorrhage induced apoptosis in vivo and in vitro by a bcl-2 mediated mechanism. Clin Immunol Immunopathol. 1998;89:205-213. [PubMed] |
| 25. | Wildhaber BE, Yang H, Teitelbaum DH. Total parenteral nutrition-induced apoptosis in mouse intestinal epithelium: modulation by keratinocyte growth factor. J Surg Res. 2003;112:144-151. [PubMed] |
| 26. | Lightfoot E Jr, Horton JW, Maass DL, White DJ, McFarland RD, Lipsky PE. Major burn trauma in rats promotes cardiac and gastrointestinal apoptosis. Shock. 1999;11:29-34. [PubMed] |
| 27. | Cinel I, Avlan D, Cinel L, Polat G, Atici S, Mavioglu I, Serinol H, Aksoyek S, Oral U. Ischemic preconditioning reduces intestinal epithelial apoptosis in rats. Shock. 2003;19:588-592. [PubMed] |
| 28. | Wolf SE, Ikeda H, Matin S, Debroy MA, Rajaraman S, Herndon DN, Thompson JC. Cutaneous burn increases apoptosis in the gut epithelium of mice. J Am Coll Surg. 1999;188:10-16. [PubMed] |
| 29. | Gallagher AM, Gottlieb RA. Proliferation, not apoptosis, alters epithelial cell migration in small intestine of CFTR null mice. Am J Physiol Gastrointest Liver Physiol. 2001;281:G681-687. [PubMed] |
| 30. | Que FG, Gores GJ. Cell death by apoptosis: basic concepts and disease relevance for the gastroenterologist. Gastroenterology. 1996;110:1238-1243. [PubMed] |
| 31. | Jones BA, Gores GJ. Physiology and pathophysiology of apoptosis in epithelial cells of the liver, pancreas, and intestine. Am J Physiol. 1997;273:G1174-1188. [PubMed] |
| 32. | Ramachandran A, Madesh M, Balasubramanian KA. Apoptosis in the intestinal epithelium: its relevance in normal and pathophysiological conditions. J Gastroenterol Hepatol. 2000;15:109-120. [PubMed] |