修回日期: 2005-01-20
接受日期: 2005-01-26
在线出版日期: 2005-03-01
目的: 为研究大鼠在部分肝切除术后肝再生过程中是否存在骨髓细胞的增生与动员以支持肝脏再生过程, 以及肝卵圆细胞(hepatic oval cells, HOC)在体内细胞标志物的演变过程.
方法: SD(Sprague-Dawley)大鼠81只, 随机分为3组: 2/3部分肝切除组(partial hepatectomy, PHx)、2/3部分肝切除加2-乙酰氨基芴(2-acetylaminofluorene, 2AAF)预处理组(PHx+2AAF)及假手术组, 每组分为9小组(n = 3), 分别于术后1, 2, 4, 6, 8, 12, 16, 20, 24 d采集大鼠骨髓细胞及再生肝组织; 采用percoll密度梯度液分离骨髓细胞中的单个核细胞, 并用流式细胞分析技术检测单个核细胞中CD34+, CD45+细胞比例; 采用冰冻组织切片技术进行再生肝组织切片, 并用免疫荧光组织化学染色检测再生组织中与CD34共表达的部分造血干细胞、肝卵圆细胞及肝细胞的细胞标志物Thy1.1, CD45, CK19, vimentin, AFP, Alb.
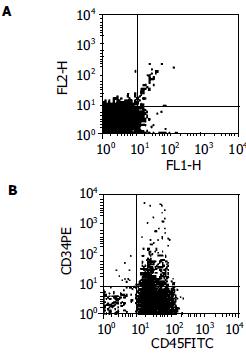
结果: 在PHx模型中, 流式细胞检测结果显示大鼠骨髓单个核细胞中CD34+及CD45+细胞在术后2, 4, 6 d与对照组相比增高(分别为2.774±0.166 vs 1.903±0.044, P = 0.016<0.05; 3.164±0.056 vs 1.862±0.057, P = 0.002<0.01; 2.708±0.160 vs 1.897±0.149, P = 0.032<0.05), 免疫荧光组织化学染色结果示在肝组织中第4 d发现少量CD34, CD45共表达细胞, 但未检出其他共表达的细胞标志物. 在PHx+2AAF模型中, 流式细胞仪检测结果示CD34+及CD45+细胞于术后2, 4 d与对照组相比增高(分别为2.472±0.141 vs 1.903±0.044, P = 0.020<0.05; 2.985±0.120 vs 1.862±0.057, P = 0.008<0.01), 荧光免疫组织化学染色显示其再生肝组织中与CD34共表达的抗原Thy1.1, CK19, Alb, AFP, vimentin等存在动态演变: 在标志物出现过程中, Thy1.1最早出现, 随后可检出AFP, vimentin, CK19, 而Alb最后检出; 在标志物的消失过程, 则Thy1.1, Alb, CK19最早消失, 随后AFP, vimentin未检出.
结论: 大鼠在急性肝损时的肝再生过程中存在骨髓CD34+与CD45+的细胞增生现象, 再生肝组织中与CD34共表达抗原的动态演变可能反映肝卵圆细胞在体内的产生与分化的演变过程.
引文著录: 潘孝本, 刘峰, 王松霞, 丛旭, 费然, 陈红松, 高燕, 魏来. 大鼠肝脏再生过程中细胞标志物演变与骨髓细胞增生. 世界华人消化杂志 2005; 13(5): 612-616
Revised: January 20, 2005
Accepted: January 26, 2005
Published online: March 1, 2005
AIM: To investigate the replication and mobilization of bone marrow (BM) cells in support of liver regeneration, and the alteration of hepatic oval cell markers in the regenerated liver.
METHODS: In the Sprague-Dawley (SD) rats receiving 2/3 partial hepatectomy (PHx) with or without 2-acetylamin-ofluorene (2AAF) treatment, CD34+, CD45+ BM cells were measured by flow cytometry. The changes in cell markers of hemopoietic stem cells, hepatic oval cells and hepatocytes in the regenerated liver were determined by fluorescence immunohistochemistry at the indicated time points after PHx.
RESULTS: The numbers of CD34+ and CD45+ BM cells were increased in both PHx (2-6 d) and PHx+2AAF (2-4 d) rats. CD34 and CD45 co-expressing cells were observed in the regenerated liver sections, which was significantly increased after 2AAF treatment. In the PHx+2AAF rats, the cell markers co-expressed with CD34 exhibited dynamic changes: Thy1.1appeared first, followed by AFP, vimentin, CK19, and Alb; while Thy1.1, Alb, and CK19 disappeared earlier than AFP and vimentin.
CONCLUSION: CD34+, CD45+ BM cells replicate during the liver regeneration in rats. The changes of the cell markers co-expressed with CD34 reflect the in vivo development of hepatic oval cells.
- Citation: Pan XB, Liu F, Wang SX, Cong X, Fei R, Chen HS, Gao Y, Wei L. Changes of bone marrow cells and cell markers in regenerated liver after partial hepatectomy in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 612-616
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/612.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.612
既往认为肝脏内只有库氏细胞来源于骨髓的造血系统, 但近年来关于干细胞的研究显示骨髓来源的干细胞可以向肝脏的其他细胞如肝卵圆细胞、胆管上皮细胞、肝细胞及血管内皮细胞等横向分化[1-4], 并有研究认为骨髓来源细胞对肝脏再生可能有一定的帮助作用[5-6]; 但最近研究显示细胞融合可能是骨髓来源细胞向肝细胞所谓"分化"的主要原因[7-8]. 此外, Ng et al[9]对人肝移植样本研究证实骨髓细胞在肝脏中的绝大部分分化为库氏细胞, 仅约1.6%的骨髓来源细胞显示为向肝细胞分化. 而Dahlke et al[10]报道在大鼠急性肝损模型中只有少数骨髓来源的细胞在再生肝组织中检出, 因此其对肝脏再生过程中的功能恢复意义不大. 但也有学者认为其从组织中检出的本身证明其可能具有重要作用, 在组织学水平, 少量的细胞也可能扮演重要的角色; 而在骨髓中本身存在着具有向肝细胞分化潜能的干细胞, 其在某些特定情况下对肝脏的再生有显著意义[11]. 因此, 关于骨髓来源细胞在肝脏再生过程中能起多大作用尚有争议[12]. 为进一步研究在不同肝损情况下骨髓细胞与肝脏再生过程可能存在的联系, 我们采用了大鼠PHx及PHx/2AAF模型, 观察肝脏再生过程中骨髓造血细胞相对计数的变化, 以及再生肝组织中一些相关细胞标志物的演变.
Percoll密度梯度离心液(Pharmacia公司), 2AAF(Sigma公司), 流式分析用荧光标记抗体: PE-抗CD34(小鼠来源), FITC-抗CD45(小鼠来源), PE-抗小鼠IgG, FITC-抗小鼠IgG(Sigma公司). 抗CD45, 抗Thy1.1(BD公司), 抗AFP(Santa Cruze公司), 抗Alb(ICN公司), 抗vimentin, 抗CK19(Biogenex公司), 以上抗体均来自小鼠, FICT-抗小鼠IgG(Santa Cruze公司), PE-抗CD34(山羊来源, Sigma公司). 流式细胞分析仪(FACSCalibur, BD公司), 荧光显微镜(AX80TF, Olympus公司). SD大鼠由北京实验动物中心提供, 约10 wk龄, 重量200-250 g, SPF级. 随机分为3组: PHx组、PHx+2AAF组及假手术组, 每组分为9小组(n = 3). PHx术: 大鼠术前禁食12 h, 乙醚吸入麻醉. 据Higgins et al所用方法从腹中线切开上腹部, 结扎并切除肝左叶及中叶, 切除量约70%. PHx+2AAF组, 大鼠术前1 wk以20 mg/(kg·d) 2AAF灌胃, 手术与PHx组相同, 术后继续以20 mg/(kg·d) 2AAF灌胃1 wk. 为避免左、中肝叶切除导致绝对血容量减少而引起骨髓细胞增生的可能, 我们采用假手术组作为对照. 此组大鼠打开腹腔后, 据左、中肝叶所含血量约1 mL, 从门静脉取血1 mL, 不做部分肝切除. 所有动物实验均于上午8:30-10:30在无菌实验室完成.
1.2.1 流式细胞分析: 部分肝切除术后不同时间点的大鼠乙醚吸入麻醉, 取左胫骨, 去除表面肌肉组织, 修剪骨垢. 用18号针插入胫骨踝端, 用PBS 5 mL冲洗入试管内, 以100 mm的微孔筛过滤.200 r/min离心5 min, 弃上清液, 用PBS 5 mL重悬、离心3次. 将细胞悬液5 mL轻置于570 g/L Percoll(密度为1 073 g/L)密度梯度液10 mL上, 400 r/min, 4℃离心30 min, 取中间单个核细胞层. PBS洗涤后调整单个核细胞数为1×106/管. 每样本2管, 测定管加入FITC-抗CD45, PE-抗CD34各5 mL避光置4℃孵育30 min. 对照管加无关抗体 PE-抗小鼠IgG, FITC-抗小鼠IgG各5 mL避光置4℃孵育30 min. 加入冷PBS 200 mL离心洗3次, 以除去多余未结合抗体, 加入1 mL流式细胞固定液4℃保存, 上流式细胞分析仪测定CD34, CD45双阳性细胞占单个核细胞比例(图1).
1.2.2 免疫双荧光组织化学: 术后不同时间点的大鼠乙醚吸入麻醉, 沿腹中线打开腹腔, 门静脉插管, 剪断肝脏的肝上与肝下下腔静脉, 灌注冷PBS50 mL以冲洗循环系统中的血液细胞. 切取肝脏组织(大小约5 mm×5 mm×3 mm)置液氮中固定, 每组织块用冰冻切片(4-5 mm), 冷丙酮固定, 吹干后4℃保存. 免疫组织化学: 肝组织切片以PBS漂洗5 min×2次, 加PBS 1: 20稀释的二抗同种血清封闭液50 mL室温孵育20 min, 加适当稀释一抗(各一抗稀释度: 抗Thy1.1 1: 100, 抗-AFP1: 100, 抗vimentin 1: 200, 抗CK19 1: 200, 抗Alb 1: 10, 抗CD45 1: 100)50 mL, 37℃孵育60 min. PBS洗2 min×3次. 加FITC-抗小鼠IgG(1: 100)50 mL 37℃孵育30 min. PBS洗2 min×3次. 以上各片均用PE-抗CD34(1: 100)50 mL 37℃孵育30 min复染, PBS洗2 min×3次. 封片, 荧光显微镜(Olympus AX80TF)观察, PE-抗CD34与其他FITC标记的抗体激发后分别为红色与绿色荧光, 如在同一细胞上双重表达则重叠为黄色. 另我们对各切片做HE染色, 以初步观察肝脏再生及肝卵圆细胞产生情况.
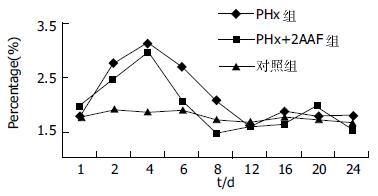
流式检测结果采用 SPSS11.0统计学分析软件, 对 PHx组, PHx+2AAF组各时间点数据与对照组相应数据进行配对T检验, P<0.05为显著性差异水平(表1). 此外, 我们采用Excel软件将各组数据转换为曲线图, 以直观反映其动态变化(图2).
| t/d | PHx | PHx+2AAF | control |
| 1 | 1.767±0.164 | 1.966±0.203 | 1.749±0.112 |
| 2 | 2.774±0.166a | 2.472±0.141a | 1.903±0.044 |
| 4 | 3.164±0.056b | 2.985±0.120b | 1.862±0.057 |
| 6 | 2.708±0.160a | 2.073±0.167 | 1.897±0.149 |
| 8 | 2.078±0.287 | 1.476±0.088 | 1.720±0.109 |
| 12 | 1.584±0.092 | 1.576±0.136 | 1.647±0.161 |
| 16 | 1.884±0.120 | 1.634±0.061 | 1.759±0.109 |
| 20 | 1.768±0.074 | 1.985±0.191 | 1.715±0.121 |
| 24 | 1.792±0.098 | 1.533±0.133 | 1.653±0.057 |
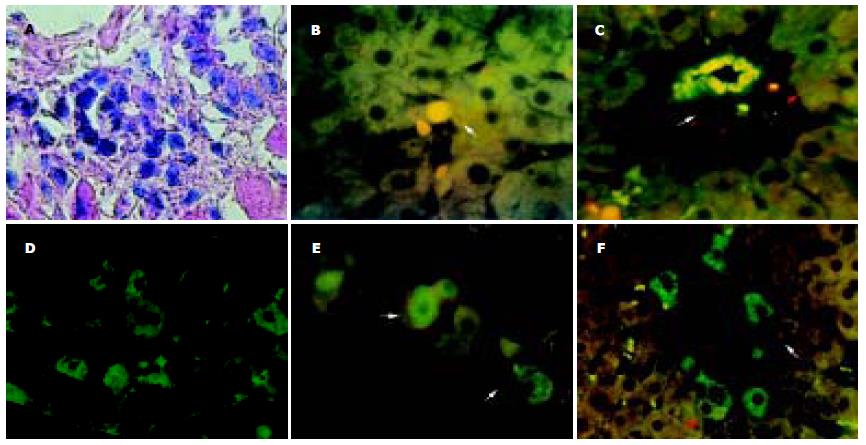
在PHx及PHx+2AAF组再生肝组织中, HE染色均可见大量淋巴细胞浸润(图3A). 在PHx组仅散在见少量CD34+, CD45+细胞(图3B), 但在PHx+2AAF组CD34与CD45共表达的细胞检出相对PHx组较多, 多位于肝窦及血管周边(图3C), 并在8 d可见vimentin阳性细胞镜下数量达最大值, 呈散在分布(图3D). 在不同的术后时间点还可检测到与CD34共表达的其他抗原(表2, 图3E-F). 假手术组再生肝组织中未检出与CD34及其他抗原共表达的细胞.
| t/d | CD34+CD45 A B C | CD34+Thy1.1 A B C | CD34+AFP A B C | CD34+CK19 A B C | CD34+Vim A B C | CD34+Alb A B C |
| 1 | - - - | - - - | - - - | - - - | - - - | - - - |
| 2 | - - - | - + - | - - - | - - - | - - - | - - - |
| 4 | - + + | - + + | - + - | - + - | - + - | - - - |
| 6 | - + - | + + + | - + + | - + + | - + + | - + - |
| 8 | - + - | + + - | + + + | + + + | + + + | + + - |
| 12 | - - - | - + - | + + - | - + + | + + - | - + - |
| 16 | - - - | - - - | - + - | - - - | - + - | - - - |
| 20 | - - - | - - - | - - - | - - - | - + - | - - - |
| 24 | - - - | - - - | - - - | - - - | - - - | - - - |
在肝脏损伤后的再生反应过程中, 可能存在3个层次的细胞增生反应: 成熟肝细胞, 肝脏的干/祖细胞及骨髓来源的干细胞; 不同水平的肝脏损伤模型会导致不同的细胞增生反应[13-16]. 我们采用了PHx模型和PHx+2AAF模型, PHx模型是研究肝脏再生过程经典模型, 而2AAF可抑制肝细胞增生而使卵圆细胞激活[17]. 结果表明, 在PHx模型中, 肝切除后2 d, 骨髓中的CD34+与CD45+细胞水平即有增高, 于4 d达最大值, 此后下降, 于8 d与对照组无显著性差异. 在PHx+2AAF模型中亦得到类似的结果, 其于术后2 d, 4 d即有增高, 但其峰值比单纯的PHx组低, 于术后6 d与对照组无显著性差异(表1, 图2).骨髓中CD34, CD45双阳性细胞主要为造血的祖\干细胞, 其先增高后降低, 提示在急性严重肝损的情况下, 骨髓中造血细胞存在着的增生及可能迁移的过程. 大鼠在70%的肝切除后, 10 d内基本完成再生过程, 其组织学重构涉及多种肝脏细胞的增生. 库氏细胞来源于血液中游走的单核细胞, 是肝脏中的重要功能细胞之一, 在肝脏的迅速再生过程需要大量的库氏细胞聚集补充; 再生肝组织的HE染色可见有大量的炎症细胞, 主要为淋巴细胞浸润(图3A), 这可能与肝脏的组织学重构有关. 库氏细胞和淋巴细胞均来源于骨髓造血系统, 因此骨髓中造血系细胞的增生有可能是机体对消耗的单核巨噬细胞和淋巴细胞的一种反应, 但其他是否向肝脏的其他细胞如肝细胞, 胆管上皮细胞、内皮细胞、肝卵圆细胞分化, 我们尚在做进一步研究. 图2中可见在PHx+2AAF组中骨髓造血细胞的升高程度低于单纯PHx组, 增高时间亦较短, 其差别是否有意义尚不明确.2AAF对中CD34+, CD45+细胞的分裂是否亦有一定的抑制作用, 或者2AAF组骨髓中造血细胞更快向外迁移而导致其值较低?也有待进一步研究.
大鼠PHx+2AAF是比较常用的肝卵圆细胞产生模型, 从PHx+2AAF组的免疫组织化学结果vimentin, CD34, CK19, AFP等卵圆细胞标志物的表达, 证明我们应用此模型是成功的. 在PHx+2AAF组免疫双荧光组织化学检测中, 由于CD34是造血干细胞和肝卵圆细胞的共同标志, 因此我们采用了CD34作为相对固定的抗原标志物, 以此跟踪其他抗原的改变情况. 在其他的抗原中, CD45与Thy1.1为造血细胞标志, Thy1.1, AFP, vimentin, CK19等为卵圆细胞标志物、CK19与Alb则分别为成熟的胆管上皮与肝细胞标志物. 在肝再生的早期我们在肝窦及门管区周边可检测出少量的CD34及CD45阳性细胞, 在PHx+2AAF组比单纯的PHx数量为多(图3B, C), 这显示骨髓中增生的造血细胞可能参与到了肝脏的再生过程, 但由于缺乏直接跟踪指标, 因此尚需进一步证实. 在PHx+2AAF组再生肝组织中的免疫组化检测结果中还可以观察到以下的细胞标志物变化(表2): 在标志物出现过程中, Thy1.1最早出现, 随后可检出AFP, vimentin, CK19, 而Alb最后检出; 在标志物的消失过程, 则Thy1.1, Alb, CK19最早消失, 此后AFP, vimentin随之未检出. 图3F荧光染色视野中多个CK19细胞染色单阳性, 尚有1个细胞有CD34的阳性共表达比较典型反映了细胞标志物的演变. 我们结果示大鼠肝再生细胞标志物随时间的改变可能反应了大鼠肝卵圆细胞在体内从产生至消失过程中表面标志的变化过程, 与国外的体外实验的相关研究结果相似[18-21]. 但作为跟踪标志的CD34本身在卵圆细胞分化过程中也会消失, 结果亦示其与Alb, CK19等成熟肝细胞及胆管上皮细胞共表达时间较短. Thy1.1, CD45与CD34均是骨髓造血细胞的标志, 其在早期再生肝脏中表达以及骨髓中CD45, CD34细胞的相应增高可能提示骨髓造血细胞主动动员并迁移至肝脏以对肝再生过程的支持.
从所周知, 在肝脏的再生过程中, 机体有多种细胞因子的浓度显著改变, 如TNFa, HGF, TGFa, IGF-I, EGF及IL-6等[22-24]. 如HGF在术后1 h即急剧升高, 一直到72 h后降至正常水平. 既往发现HGF对体外培养的肝细胞有明显的促DNA合成与细胞分裂作用, 但新近的研究发现HGF对多种功能, 除细胞增生外, 还有细胞迁移与趋化作用[25]. 而据体内外实验, EGF可多种促进上皮组织细胞及某些成纤维细胞的增生[26]; 而IL-6对不同的靶细胞具有不同的促细胞增生, 抑制细胞分裂或促细胞分化作用, IL-6亦具有使骨髓中造血干细胞增生和分化的能力[27], 肝再生过程中这些细胞因子的浓度改变可能是骨髓中造血细胞增生的原因.
肝再生过程中的炎症可导致SDF-1水平升高, 肝损伤可激活MMP-9的活性, 这些因素可促进CXCR4的表达及SDF-1介导的造血干细胞向肝脏汇集, 而在肝损伤中升高的HGF可促使细胞突触形成, CXCR4上调及SDF-1介导的CD34+骨髓细胞的迁移, 及对干细胞因子效应的协同作用. 因此HGF, SDF-1, MMP-9等表达升高可以召集骨髓中的CD34+细胞如造血干细胞及肝分化潜能细胞定位于肝脏以有助于再生修复. 总之, 我们的研究结果反映了大鼠肝卵圆细胞在体内的分化过程, 并观察到在肝脏再生过程中存在骨髓来源细胞增生及迁移的过程, 但其在多大程度上支持肝脏的再生过程及向何种细胞分化尚需进一步研究.
编辑: 张海宁 电编: 潘伯荣
| 1. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] |
| 2. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] |
| 3. | Gao Z, McAlister VC, Williams GM. Repopulation of liver endothelium by bone-marrow- derived cells. Lance. 2001;357:932-933. [PubMed] |
| 4. | Crosby HA, Nijjar SS, de Goyet Jde V, Kelly DA, Strain AJ. Progenitor cells of the biliary epithelial cell lineage. Semin Cell Dev Biol. 2002;13:397-403. [PubMed] |
| 5. | Fujii H, Hirose T, Oe S, Yasuchika K, Azuma H, Fujikawa T, Nagao M, Yamaoka Y. Contribution of bone marrow cells to liver regeneration after partial hepatectomy in mice. J Hepatol. 2002;36:653-659. [PubMed] |
| 6. | Ferry N, Hadchouel M. Liver regeneration: with a little help from marrow. J Hepatol. 2002;36:695-697. [PubMed] |
| 7. | Wang X, Willenbring H, Akkari Y, Torimaru Y, Foster M, Al-Dhalimy M, Lagasse E, Finegold M, Olson S, Grompe M. Cell Fusion is the principal source of bone-marrow- derived hepatocytes. Nature. 2003;422:897-901. [PubMed] |
| 8. | Vassilopoulos G, Wang PR, Russell DW. Transplanted bone marrow regenerates liver by cell fusion. Nature. 2003;422:901-904. [PubMed] |
| 9. | Ng IO, Chan KL, Shek WH, Lee JM, Fong DY, Lo CM, Fan ST. High frequency of chimerism in transplanted livers. Hepatology. 2003;38:989-998. [PubMed] |
| 10. | Dahlke MH, Popp FC, Bahlmann FH, Aselmann H, Jager MD, Neipp M, Piso P, Klempnauer J, Schlitt HJ. Liver regeneration in a retrorsine/CCl4 induced acute liver failure model: do bone marrow-derived cells contribute? J Hepatol. 2003;39:365-373. [PubMed] |
| 11. | Alison MR, Vig P, Russo F, Bigger BW, Amofah E, Themis M, Forbes S. Hepatic stem cells: from inside and outside the liver? Cell Prolif. 2004;37:1-21. [PubMed] |
| 12. | Grompe M. The role of bone marrow stem cells in liver regeneration. Semin Liver Dis. 2003;23:363-72. [PubMed] |
| 13. | Zimmermann A. Liver regeneration: the emergence of new pathways. Med Sci Monit. 2002;8:53-63. [PubMed] |
| 14. | Sell S. Heterogeneity and plasticity of hepatocyte lineage cells. Hepatology. 2001;33:738-750. [PubMed] |
| 15. | Oh SH, Hatch HM, Petersen BE. Hepatic oval 'stem' cell in liver regeneration. Semin Cell Dev Biol. 2002;13:405-409. [PubMed] |
| 16. | Fausto N, Campbell JS. The role of hepatocytes and oval cells in liver regeneration and repopulation. Mech Dev. 2003;120:117-130. [PubMed] |
| 17. | Zhang Y, Bai XF, Huang CX. Hepatic stem cells: existence and origin. World J Gastroenterol. 2003;9:201-204. [PubMed] |
| 18. | Yin L, Sun M, Ilic Z, Leffert HL, Sell S. Derivation, characterization, and phenotypic variation of hepatic progenitor cell lines isolated from adult rats. Hepatology. 2002;35:315-324. [PubMed] |
| 19. | Toshihiro M. Hepatic stem cells: from bone marrow cells to hepatocytes. Biochem Biophy Res Commun. 2001;281:1-5. [PubMed] |
| 20. | He ZP, Tan WQ, Tang YF, Zhang HJ, Feng MF. Activation, isolation, identification and in vitro proliferation of oval cells from adult rat livers. Cell Prolif. 2004;37:177-187. [PubMed] |
| 21. | Qin AL, Zhou XQ, Zhang W, Yu H, Xie Q. Characterization and enrichment of hepatic progenitor cells in adult rat liver. World J Gastroenterol. 2004;10:1480-1486. [PubMed] |
| 22. | Sanz S, Pucilowska JB, Liu S, Rodriguez-Ortigosa CM, Lund PK, Brenner DA, Fuller CR, Simmons JG, Pardo A, Martinez-Chantar ML. Expression of insulin-like growth factor I by activated hepatic stellate cells reduces fibrogenesis and enhances regeneration after liver injury. Gut. 2005;54:134-141. [PubMed] |
| 23. | Serandour AL, Loyer P, Garnier D, Courselaud B, Theret N, Glaise D, Guguen-Guillouzo C, Corlu A. TNFalpha-mediated extracellular matrix remodeling is required for multiple division cycles in rat hepatocytes. Hepatology. 2005;41:478-486. [PubMed] |
| 24. | Taub R. Liver regeneration: from myth to mechanism. Nat Rev Mol Cell Biol. 2004;5:836-847. [PubMed] |
| 25. | Zarnegar R, Michalopoulos GK. The many faces of hepatocyte growth factor: from hepatopoiesis to hematopoiesis. J Cell Biol. 1995;129:11771180. [PubMed] |
| 27. | Sakamoto T, Liu Z, Murase N, Ezure T, Yokomuro S, Poli V, Demetris AJ. Mitosis and apoptosis in the liver of interleukin-6-deficient mice after partial hepatectomy. Hepatology. 1999;29:403411. [PubMed] |