修回日期: 2005-01-01
接受日期: 2005-01-14
在线出版日期: 2005-03-01
目的: 研究仔猪断奶前后胃组织中ghrelin基因表达和其对胃组织发育性变化的影响, 同时对内源性生长抑素的作用也进行了研究.
方法: 实验选取新生仔猪18窝, 随机分为实验组和对照组, 自12 d起, 对照组饲喂基础乳猪料, 实验组在基础日粮中添加120 mg半胱胺, 以耗竭内源性生长抑素, 两组仔猪均于35 d断奶. 分别于28, 35, 36.5, 38, 42和45 d随机选取实验组和对照组仔猪各6头, 屠宰, 称量胃重和体重并采集胃底和胃窦黏膜, 用RT-PCR方法, 以18S rRNA作内标, 定量分析胃底和胃窦组织中ghrelin mRNA的丰度.
结果: 胃底ghrelin mRNA的丰度明显高于胃窦部; 胃底ghrelin mRNA水平在35和36.5 d较低, 随后逐渐增加.45 d ghrelin mRNA水平显著高于35, 36.5和38 d(P<0.05); 半胱胺能提高胃底ghrelin mRNA表达, 其中35, 36.5和38 d时试验组ghrelin mRNA表达显著高于对照组(P<0.05).
结论: Ghrelin能直接或间接作用于胃组织, 调节胃的生长, 表明Ghrelin与胃的形态和功能发育具有密切的关系; 内源性生长抑素可抑制胃底ghrelin mRNA的表达.
引文著录: 杜改梅, 石志敏, 韦习会, 张磊, 赵茹茜. 断奶前后仔猪胃组织中ghrelin基因表达及内源性生长抑素的作用. 世界华人消化杂志 2005; 13(5): 604-607
Revised: January 1, 2005
Accepted: January 14, 2005
Published online: March 1, 2005
AIM: To study the expression of ghrelin mRNA in gastric tissue of weaning piglets, to investigate the correlation between relative gastric growth and fundus expression of ghrelin mRNA in weanling piglets, and to study the role of endogenous somatostatins.
METHODS: Eighteen litters of newborn piglets were divided randomly to control and treatment groups. From 12 days of age, piglets in treatment group were fed with starter diet supplemented with 120 mg cysteamine to deplete endogenous somatostatin (SS). Piglets were weaned on the 35th day of age (d35) in both groups. 6 piglets from each group were slaughtered on d28, d35, d36.5, d38, d42 and d45, respectively. A semi-quantitative RT-PCR was applied to detect the level of ghrelin mRNA in gastric fundus and antrum with 18S rRNA as an internal standard.
RESULTS: Ghrelin mRNA was detected in both fundus and antrum, which was more abundant in fundus than in antrum. Ghrelin mRNA expression in fundus exhibited a trend of increase from d38 to d45, reaching a peak on d45. Cysteamine significantly increased the level of ghrelin mRNA expression on d35, d36.5 and d38.
CONCLUSION: Ghrelin is involved in the regulation of gastric growth, and endogenous somatostatin downregulates ghrelin expression.
- Citation: Du GM, Shi ZM, Wei XH, Zhang L, Zhao RQ. Expression of ghrelin mRNA in gastric tissue of weaning piglets and the role of endogenous somatostatin. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 604-607
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/604.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.604
生长素(ghrelin)是1999年发现的一种含有28个氨基酸残基的多肽, 他主要由胃黏膜的一种内分泌细胞分泌[1]. 近年来, 许多学者用放射免疫法(RIA)、免疫组织化学法和分子生物学方法在人和大鼠上对ghrelin及其受体进行了一些研究, 发现ghrelin可以促进胃酸分泌和胃肠运动[2-3].
研究表明, 胃功能发育缓慢, 胃酸分泌不足是导致仔猪腹泻的重要原因之一[4], 那么ghrelin是否参与仔猪断奶前后胃的生长和功能发育的调节?为了研究这一问题, 首先必须对断奶前后仔猪胃组织中ghrelin基因表达的动态变化有所了解, 而迄今关于仔猪胃组织中ghrelin基因表达的研究尚未见报道. 生长抑素(SS)也是一种产生于胃泌酸区的肽类物质, 是胃酸分泌的强抑制剂, 他以旁分泌的方式抑制许多胃肠道肽类激素的分泌[5]. 半胱胺(cysteamine, CS)能破坏SS半胱氨酸残基上的二硫键, 使SS生物活性丧失[6]. 研究表明, 半胱胺(Cysteamine, CS)不仅能迅速降低大鼠下丘脑、胃和十二指肠的SS-14的免疫活性和生物活性, 而且对SS mRNA的表达也有直接或间接的抑制作用[7]. 大鼠的免疫组化实验表明, SS免疫反应细胞与ghrelin免疫反应细胞相接触, 静脉注射SS可降低血清ghrelin的浓度[8], 那么半胱胺是否可能影响断奶仔猪胃组织中ghrelin基因的表达?这个问题迄今也未见相关的研究报道. 鉴此, 我们采用相对定量RT-PCR方法, 研究仔猪断奶前后胃组织中ghrelin基因表达的发育性变化和半胱胺对ghrelin mRNA表达的影响.
反转录酶(MMLV)、DNA聚合酶(Taq)、RNA酶抑制剂(RNase inhibitor), 购自Promega公司; 18S(内标), 购自AmbionRNA公司. PCR仪(Gene Amp PCR system 9600型)为美国Perkins Elmer公司产品; 电泳凝胶成像系统(1D Electrophoresis Documentation and analysis System 120)为美国Kodak公司产品.
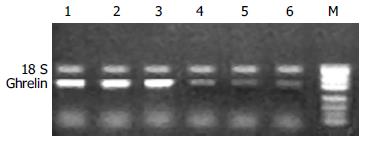
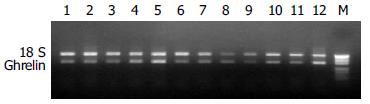
选取2或3胎次的经产新淮母猪18头, 分娩后随机分为试验组和对照组各9窝. 实验期间, 仔猪自由吮乳和饮水, 按常规程序进行免疫. 仔猪12 d开始饲喂全价乳猪料; 实验组仔猪饲料中添加120 mg半胱胺. 两组仔猪均于35 d断奶. 分别于28, 35, 36.5, 38, 42和45 d随机选取对照组和试验组仔猪各6头, 屠宰, 迅速采取胃底和胃窦黏膜组织, 置液氮速冻, -70℃冷冻保存. 采用异硫氰酸胍-酚-氯仿一步法提取胃底和胃窦黏膜组织总RNA. 用紫外分光光度计测定总RNA浓度(260 nm), 并通过变性琼脂糖凝胶电泳检验总RNA的质量. 用随机引物Random hexamer primer对所有样品的RNA进行RT, 获得各样品RNA的cDNA(RT product). RT反应总体积25 μL, 包括2 μg总RNA, 20 U RNA酶抑制剂, 100 U MMLV反转录酶, 5 μL 5×RT buffer(含250 mmol/L Tris-HCl pH 8.3, 375 mmol/L KCl, 15 mmol/L MgCl2, 50 mmol/L DTT), 0.4 mmol/L dNTP, 4 μmol/L随机引物. 先加RNA模板, dNTP和随机引物, 75℃变性5 min, 立即放在冰上冷却, 再加其余试剂37℃反应60 min, 95℃灭活5 min. ghrelin引物根据GenBank(AF308930)提供的猪preproghrelin mRNA的全序列设计. 上游引物序列为: 5'-TCCTCATGGCAGACTTGG-3', 下游引物序列为: 5'-TGGTCTCAGGGACAATCAC-3'由大连宝生物工程公司合成, 预期PCR产物长度为326 bp. 采用18S rRNA作内标, 并用混合样品(待测样品等比例混合)分别对PCR反应条件、循环圈数以及目的基因引物和18S 引物的比例等进行优化, 来建立最佳反应条件和校正不同批次间RT和PCR效率的差异. PCR反应体积25 μL, 含模板(RT产物)2 μL, 0.5 U Taq DNA聚合酶, 5 μL 10PCR Buffer(含50 mmol/L Tris-HCl pH9.0, 100 mmol/L NaCl, 1.0 mmol/L DTT, 0.1 mmol/L EDTA, 500 mL/L glycerol, 10g/L Triton X-100), 0.2 mmol/L dNTP, 1.0-2.0 mmol/L MgCl2, 0.7 μmol/L目的基因引物, 1.0-2.2 μL 18S rRNA内标. PCR扩增条件为: 94℃预变性5 min; 94℃变性30 s, 55℃复性30 s, 72℃延伸40 s, 共25个循环; 72℃延伸10 min.25个循环时, 18 s和目的基因的PCR产物均在线性扩增范围. 每个样品作2次重复, 同时用ddH2O和RNA样品分别取代RT产物作对照, 以检验是否有外源和基因组DNA污染. 取20 μL PCR产物在20 g/L的琼脂糖凝胶上电泳, EB染色. 用Kodak 1D图像分析系统分析条带灰度, 根据目的基因ghrelin和内标18S PCR 产物的灰度比, 确定样品中ghrelin mRNA表达的相对含量.
统计学处理 所有数据用平均值±标准误表示. 采用SPSS 11.0统计软件统计, 差异显著性检验采用独立样本t检验和单因子方差分析(one way ANOVA, LSD).
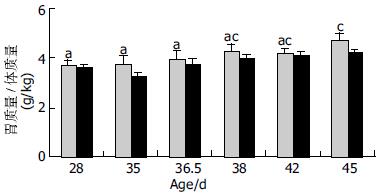
仔猪在断奶后胃的相对质量呈逐渐升高趋势, 38 d以前胃的发育均较为缓慢, 42 d后胃的发育迅速增加, 45 d时达到高峰, 此时胃的相对质量明显高于28, 35和36.5 d的胃相对质量. 与对照组相比, 日粮添加半胱胺的胃相对质量没有发生显著性变化(图1).
Ghrelin在仔猪胃底和胃窦黏膜均有分布, 且胃底黏膜Ghrelin mRNA的丰度明显高于胃窦黏膜(图2).
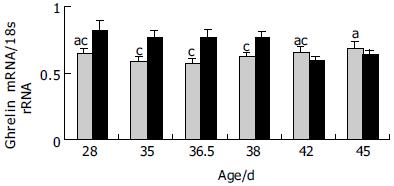
仔猪胃底ghrelin mRNA表达在断奶后呈下降趋势, 断奶后35和36.5 d时仔猪胃底ghrelin mRNA相对丰度较低, 随后逐渐上升, 45 d胃底ghrelin mRNA丰度显著高于35, 36.5和38 d(P<0.05). 与对照组相比, 日粮添加半胱胺提高了胃底ghrelin mRNA的相对丰度, 且在35, 36.5和38 d时试验组胃底ghrelin mRNA的相对丰度明显高于对照组(图3, 4).
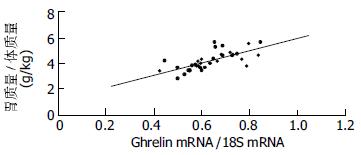
ghrelin mRNA基因表达的相关性分析胃的相对质量变化与胃底组织ghrelin mRNA表达的发育性变化相关性分析表明(图5), 胃的相对质量变化与胃底组织ghrelin mRNA表达的发育性变化呈中等正相关, 相关系数为R = 0.424(P<0.01).
Ghrelin是一种刺激摄食和促进生长激素释放的酰基化肽, 在大鼠和人中, 他主要由胃的泌酸黏膜的内分泌细胞分泌, 运用大鼠ghrelin N末端片段的多克隆抗体, 发现了奶牛和山羊胃中也有与ghrelin有免疫反应的细胞分布[9]. 运用RT-PCR方法证明, ghrelin mRNA广泛分布于人体的各种组织中, 如胃底、小肠、胃窦、胰腺、膀胱和肺脏等组织[10]. 从研究报道中发现, 目前关于ghrelin的研究主要集中在人和大鼠身上, 而对猪特别是断奶仔猪的研究较少. 我们以断奶前后的仔猪为实验对象, 运用RT-PCR方法发现ghrelin不仅分布于胃底泌酸区黏膜, 而且也分布于胃窦, 但胃窦的ghrelin mRNA丰度明显低于胃底部, 这提示ghrelin可能参与胃酸分泌的调节. 大鼠的放射免疫测定发现, ghrelin不仅分布于胃的泌酸区域, 而且也分布于胃窦和十二指肠[11]. Kojima et al[12]用原位杂交的方法证实, 表达ghrelin mRNA的细胞密集分布于胃部泌酸腺的颈部至底部. 我们的研究结果均与以上结果相一致.
目前关于Ghrelin对胃的生长和功能发育影响的研究报道较少, 并且大多集中在ghrelin对胃酸分泌和胃肠运动的研究方面. 关于ghrelin对仔猪胃组织发育性变化的影响尚未见研究报道. 我们通过RT-PCR方法检测到仔猪断奶前后胃底黏膜ghrelin mRNA的表达呈年龄依赖性变化趋势, 且ghrelin mRNA的发育性变化和胃的相对质量变化模式呈中等正相关. Ghrlein在胃肠道具有和motilin类似的促进胃排空作用. 动物实验显示, 外源性的ghrelin可以增加胃酸分泌和胃蠕动. 通过免疫组化和放射免疫法发现, 在大鼠胃中ghrelin免疫反应细胞随着年龄的变化而发生变化, 且随着胃的发育, 细胞数目不断增多, 胃腺区的ghrelin量也增加[13]. Date et al[14](2001)研究发现, ghrelin通过作用于中枢神经系统而调节胃酸分泌, 他们给予小鼠脑室内注射ghrelin, 引起小鼠剂量依赖性的胃酸分泌, 迷走神经切断或给予阿托品后, 能阻断ghrelin引起的胃酸分泌增多. 给大鼠iv ghrelin可引起剂量依赖性的胃酸分泌增多, 胃收缩增强, 胃排空加快[15]. Trudel et al[16]报道小鼠实验中ghrelin和Des[Gln(14)] ghrelin可促进胃和小肠排空, 并有效地缓解手术后引起的肠梗阻, 而在这一过程中大剂量的motilin或红霉素都无效. Sibilia et al[17]报道ghrelin具有中枢性保护胃黏膜作用. 在小鼠模型中, 使用ghrelin可有效的控制由酒精引起的胃溃疡, 并呈效量相关. 对于进食异常或手术后胃肠功能恢复缓慢的患者, ghrelin将可能成为一个有效的治疗手段. 以上研究结果表明, Ghrelin对胃的生长和功能发育有着重要的调节作用. 然而Dornonville de la Cour et al[18](2004)对大鼠的实验研究证明, ghrelin对胃酸分泌没有任何促进或抑制作用, 但静脉或脑室内注射ghrelin可促进胃排空. 可见目前关于ghrelin对胃酸分泌的作用仍存在分歧, 这可能与ghrelin的处理剂量, 给药途径以及评价胃酸分泌的方法等有关. 研究表明, 胃内生长抑素表达高的仔猪在断奶前胃酸分泌较少. 在我们的研究结果中, 断奶前后ghrelin mRNA的年龄依赖性变化趋势与血清中GH和垂体GH mRNA表达相一致; 而且ghrelin表达的发育性变化与相同日龄仔猪的胃生长抑素mRNA的表达趋势相同(未发表), 提示ghrelin可能直接或间接作用于胃组织, 调节胃的生长和胃酸分泌, 这也证明了Ghrelin与胃的形态和功能发育具有密切的关系.
Ghrelin的合成和分泌受到许多因素的调节, 那么, 内源性SS是否参与ghrelin基因表达的调节?我们采用半胱胺耗竭内源性SS, 发现断奶仔猪胃底黏膜ghrelin mRNA的表达丰度明显高于对照组. 在分离的大鼠胃中, GLP-1, Gastrin, Insulin, Somastostain和GIP等都对胃Ghrelin的分泌具有调节作用, 其中SS对ghrelin分泌的调节作用较受关注, 然而研究主要集中在外源性SS的作用, 如在给予外源性生长抑素后ghrelin诱导的GH分泌被部分阻断; 静脉注射SS可降低大鼠血清ghrelin的浓度[8]. 对大鼠的免疫组化实验表明, SS免疫反应细胞与ghrelin免疫反应细胞相接触[8]. 本研究结果提示内源性SS也具有抑制ghrelin mRNA表达的作用, 而其调节机制还有待于进一步研究.
编辑: 张海宁 电编: 潘伯荣
| 1. | De Ambrogi M, Volpe S, Tamanini C. Ghrelin: central and peripheral effects of a novel peptydil hormone. Med Sci Monit. 2003;9:RA217-RA224. [PubMed] |
| 2. | Papotti M, Cassoni P, Volante M, Deghenghi R, Muccioli G, Ghigo E. Ghrelin-producing endocrine tumors of the stomach and intestine. J Clin Endocrinol Metab. 2001;86:5052-5059. [PubMed] |
| 3. | Volante M, Allia E, Gugliotta P, Funaro A, Broglio F, Deghenghi R, Muccioli G, Ghigo E, Papotti M. Expression of ghrelin and of the GH secretagogue receptor by pancreatic islet cells and related endocrine tumors. J Clin Endocrinol Metab. 2002;87:1300-1308. [PubMed] |
| 5. | 陈 元方, Yamada T. 胃肠肽类激素基础与临床. 北京: 北京医科大学\中国协和医科大学联合出版社 1997; 257-266. |
| 7. | Papachristou DN, Liu JL, Patel YC. Cysteamine-induced reduction in tissue somatostatin immunoreactivity is associated with alterations in somatostatin mRNA. Regul Pepti. 1994;49:2372-2447. [PubMed] |
| 8. | Shimada M, Date Y, Mondal MS, Toshinai K, Shimbara T, Fukunaga K, Murakami N, Miyazato M, Kangawa K, Yoshimatsu H. Somatostatin suppresses ghrelin secretion from the rat stomach. Biochem Biophys Res Commun. 2003;302:520-525. [PubMed] |
| 9. | Hayashida T, Murakami K, Mogi K, Nishihara M, Nakazato M, Mondal MS, Horii Y, Kojima M, Kangawa K, Murakami N. Ghrelin in domestic animals: distribution in stomach and its possible role. Domest Anim Endocrinol. 2001;21:17-24. [PubMed] |
| 10. | Gnanapavan S, Kola B, Bustin SA, Morris DG, McGee P, Fairclough P, Bhattacharya S, Carpenter R, Grossman AB, Korbonits M. The tissue distribution of the mRNA of ghrelin and subtypes of its receptor, GHS-R, in humans. J Clin Endocrinol Metab. 2002;87:2988. [PubMed] |
| 11. | Dornonville dl C, Bjorkqvist M, Sandvik AK, Bakke I, Zhao CM, Chen D, Hakanson R. A-like cells in the rat stomach contain ghrelin and do not operate under gastrin control. Regul Pept. 2001;99:141-150. [PubMed] |
| 12. | Kojima M, Kangawa K. Ghrelin: a novel growth-hormone releasing peptide. Nippon Rinsho. 2001;59:1400-1407. [PubMed] |
| 13. | Gualillo O, Caminos J, Blanco M, Garcia-Caballero T, Kojima M, Kangawa K, Dieguez C, Casanueva F. Ghrelin, a novel placental-derived hormone. Endocrinology. 2001;142:788-794. [PubMed] |
| 14. | Date Y, Nakazato M, Murakami N, Kojima M, Kangawa K, Matsukura S. Ghrelin acts in the central nervous system to stimulate gastric acid secretion. Biochem Biophys Res Commun. 2001;280:904-907. [PubMed] |
| 15. | Masuda Y, Tanaka T, Inomata N, Ohnuma N, Tanaka S, Itoh Z, Hosoda H, Kojima M, Kangawa K. Ghrelin stimulates gastric acid secretion and motility in rats. Biochem Biophys Res Commun. 2000;276:905-908. [PubMed] |
| 16. | Trudel L, Tomasetto C, Rio MC, Bouin M, Plourde V, Eberling P, Poitras P. Ghrelin/motilin-related peptide is a potent prokinetic to reverse gastric postoperative ileus in rat. Am J Physiol Gastrointest Liver Physiol. 2002;282:G948-G952. [PubMed] |
| 17. | Sibilia V, Rindi G, Pagani F, Rapetti D, Locatelli V, Torsello A, Campanini N, Deghenghi R, Netti C. Ghrelin protects against ethanol-induced gastric ulcers in rats: studies on the mechanisms of action. Endocrinology. 2003;144:353-359. [PubMed] |
| 18. | Dornonville de la Cour C, Lindstrom E, Norlen P. Ghrelin stimulates gastric emptying but is without effect on acid secretion and gastric endocrine cells. Regul Pept. 2004;120:23-32. [PubMed] |