修回日期: 2005-01-07
接受日期: 2005-01-13
在线出版日期: 2005-03-01
目的: 观察口服接种过敏原基因(Der p2)重组βBCG口咽胃肠道环境对Der p2-rBCG行为的影响.
方法: 以野生BCG为对照, 给予Balb/c小鼠口服接种三种方式(分泌、胞壁和胞内)表达Der p2的rBCG1×109CFU, 连续5 d, 计数不同时间粪便、口咽淋巴组织(OLT)、消化道相关淋巴组织(GALT)以及肝脏、脾脏和肺脏中BCG的细菌数; 用PCR和内参照RT-PCR法测定由rBCG携带入各组织中的Der p2存在和表达状况.
结果: 三种rBCG均可通过口咽和胃肠道黏膜, 进入黏膜相关淋巴组织; 各淋巴组织中的rBCG仍能表达其所携带的外源基因, 并在各淋巴组织中表达外源蛋白.
结论: rBCG口服免疫后口咽胃肠道环境对rBCG生物学行为所产生的影响并不妨碍诱导理想的免疫应答.
引文著录: 史皆然, 师长宏, 吴昌归, 张金山. 口咽胃肠道环境对Der p2-rBCG行为的影响. 世界华人消化杂志 2005; 13(5): 600-603
Revised: January 7, 2005
Accepted: January 13, 2005
Published online: March 1, 2005
AIM: To investigate the influence of oral cavity and gastrointestinal tract environment on the biological behavior of recombinant Bacillus Calmette-Guerin (rBCG) that expresses with allergen Der p2 after oral inoculation.
METHODS: Four groups of 6 to 8 week old Balb/c mice were vaccinated orally with 100 μL of 109 CFU with natural BCG or three kinds of rBCGs. The BCG CFU was counted in several tissue (oral pharyngeal lymphoid tissues (OLT), gut associated lymphoid tissues (GALT), spleen, lung and liver) and feces from the inoculated Balb/c mice at different time after inoculation. The DNA and mRNA of Der p2 gene in various tissue were identified by PCR and RT-PCR, respectively.
RESULTS: All three kinds of rBCGs were observed in mucosal-associated lymphoid tissues, indicating that they could penetrate the mucosa of oral cavity and gastrointestinal tract. The Der p2 gene was expressed by rBCG in above tissues.
CONCLUSION: It is suggested that the oral cavity and gastrointestinal tract environment does not interrupt rBCG expressed Der p2 from inducing immune response after oral inoculation.
- Citation: Shi JR, Shi CH, Wu CG, Zhang JS. Influence of oral cavity and gastrointestinal tract environment on Der p2-rBCG biological behavior. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 600-603
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/600.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.600
采用BCG或rBCG调节宿主的非特异性和特异性免疫应答, 用于相关疾病的防治是国内外研究热点[1]. 我们以往的研究显示, ip接种可表达过敏原的重组BCG能诱导Balb/c小鼠产生过敏原特异性的Th1优势应答, 对过敏性疾病防治有利. 然而, 分支杆菌抗原和其菌体成分的特殊性, 使得重复注射接种会引起宿主强烈的不良反应, 给强化免疫带来困难. 口咽胃肠道作为机体开放的门户, 拥有数量和面积巨大的免疫组织, 因而免疫学潜能极大; 口服接种rBCG较注射免疫在许多方面具有优势. 鉴于此, 我们采用口服途径免疫Der p2-rBCG于Balb/c小鼠, 通过检测口咽消化道不同部位相关淋巴组织和主要脏器中rBCG的数量, 以及rBCG在各组织中表达Der p2的情况, 以评价口咽胃肠道环境对Der p2-rBCG行为的影响.
BCG D2-PB302S甲10株(Pasteur 1173属)由第四军医大学基础部微生物教研室保存; 分泌型(SEC)、胞壁型(CW)和胞内型(IC)Der p2重组BCG为作者构建[2-3]. SPF级雌性6-8周龄BALB/c小鼠32只, 由第四军医大学实验动物中心提供, 分为4组. 动物免疫前夜禁水, 次日晨分别给予100 μL(×1013CFU/L)用100 mL/L甘油混悬的胞内、胞壁和胞外分泌三种方式表达Der p2的rBCG和BCG口服接种, 随后再给予30 g/L NaHCO3 50 μL, 连续5 d. 分别接种BCG或rBCG于200 mL 7H9(含ADC)于37℃培养至A = 1.2A600U, 以大肠杆菌为参照, 用比浊法进行定量. 将适量培养物原液用100 mL/L甘油洗涤2次, 根据所测定的细菌密度, 按接种要求将各组培养物用100 mL/L甘油稀释成1013CFU/L. 分别于末次免疫后2, 14, 28和56 d处死小鼠, 无菌分离每只小鼠的口咽淋巴组织(OLT, 包括下颌下腺、腺体周淋巴结和颈淋巴结)、消化道相关淋巴组织(GALT, 包括派伊尔结、肠系膜淋巴结)、脾脏、双肺和肝脏, 一部分进行组织学检查, 另一部分放于无菌的离心管中, 称重后加入生理盐水5 mL/g. 匀浆后备用.
分别于首次免疫后1, 6, 8, 10, 14, 28和56 d收集各组小鼠粪便, 用2 g/L孔雀绿和30 g/L NaOH处理, 再用20 mL/L HCl中和, 14470 g离心后, 用生理盐水1 000 μL稀释沉淀, 取200 μL涂布于7H11琼脂平板. 涂皿的平板于37℃培养18 d后计数BCG的CFU. 另取匀浆组织液200 μL, 涂布于7H11琼脂平板. 于37℃培养18 d后计数BCG的CFU. 将上述涂皿后剩余的OLT, GALT和脾脏组织匀浆物液分成2份, 参照文献和Trizol RNA提取操作指南抽提总DNA和mRNA. 所得总DNA用RNase消化; 以所得mRNA作模板, 按AMV-RTase说明, 以OligodT18为引物进行反转录. 参照Taq酶说明以总DNA和反转录产物为模板, 用Der p2的正反向引物行PCR, 反转录系统用β-actin作内参照. 产物于15 g/L琼脂糖凝胶电泳, 溴化乙锭染色(10 mg/L). RT-PCR电泳图像用Dual wavelength Flying spot Scanner CS 9000型薄层扫描仪(岛津公司, 日本)扫描后于计算机上分析扩增后Der p2和β-actin DNA的荧光强度, 计算D/β之比.
各组小鼠口服免疫后次日即开始在粪便中出现, 5次免疫后达到高峰, 随后开始下降, 随时间延长粪便中BCG数量递减, 至首次免疫后14 d各组小鼠粪便中BCG消失(表1). 无论BCG还是三种rBCG以活菌形式从粪便种排出, 一方面说明消化道环境对BCG的生存影响不大; 另一方面提示, 从口腔到直肠整个消化道黏膜都接触到了活的BCG或rBCG, 这就有可能使BCG或rBCG与消化道的免疫组织相互作用, 使得经消化道免疫成为可能. 小鼠口服免疫后次日即可在多种组织中检测到BCG或rBCG, 14 d达高峰, 随后开始下降, 至56 d后淋巴结、脾、肺和肝脏中已 检测不到BCG或rBCG(表2). 这说明消化系统和肺脏均获得了BCG或rBCG免疫刺激作用.
| Day | BCG | Der p2-rBCG | ||
| SEC | CW | IC | ||
| 1 | 2.36±0.78 | 3.15±1.32 | 2.67±0.83 | 4.03±1.56 |
| 6 | 511.33±131.25 | 752.41±237.34 | 681.53±178.43 | 558.76±145.91 |
| 8 | 37.23±27.95 | 1.61±42.15 | 79.13±55.59 | 77.44±37.53 |
| 10 | 6.66±5.89 | 7.97±6.05 | 8.63±5.72 | 5.51±5.38 |
| 14 | 0 | 0 | 0 | 0 |
| 28 | 0 | 0 | 0 | 0 |
| 56 | 0 | 0 | 0 | 0 |
| OLT | GALT | Lung | Spleen | Liver | ||
| BCG | 2 | 10.35±3.01 | 9.52±2.13 | 4.76±1.38 | 8.07±2.19 | 3.58±0.77 |
| 14 | 74.25±8.75 | 85.39±14.76 | 63.45±8.59 | 95.86±15.73 | 43.18±5.43 | |
| 28 | 32.12±6.33 | 29.54±9.36 | 5.85±2.39 | 42.49±10.27 | 12.34±4.26 | |
| 56 | 0 | 0 | 0 | 0 | 0 | |
| rBCG-SEC | 2 | 13.26±2.43 | 8.87±1.95 | 6.48±1.92 | 11.23±3.53 | 5.77±1.12 |
| 14 | 94.16±12.35 | 71.67±11.22 | 49.37±6.58 | 93.46±10.13 | 53.39±9.84 | |
| 28 | 26.92±4.65 | 33.23±8.19 | 8.35±3.27 | 34.91±8.94 | 10.16±3.75 | |
| 56 | 0 | 0 | 0 | 0 | 0 | |
| rBCG-CW | 2 | 8.52±2.84 | 10.36±2.17 | 7.35±2.61 | 9.42±3.13 | 5.93±1.09 |
| 14 | 76.18±9.64 | 83.57±11.63 | 57.39±6.95 | 86.49±11.92 | 46.34±4.53 | |
| 28 | 36.65±8.74 | 28.18±7.83 | 9.69±3.12 | 44.67±13.85 | 9.64±3.78 | |
| 56 | 0 | 0 | 0 | 0 | 0 | |
| rBCG-IC | 2 | 6.95±2.67 | 7.56±1.43 | 5.15±1.62 | 6.56±1.38 | 5.18±1.07 |
| 14 | 73.16±8.37 | 81.66±10.34 | 54.39±6.26 | 81.32±12.62 | 47.52±4.61 | |
| 28 | 26.25±4.83 | 25.44±6.51 | 7.68±2.42 | 37.33±9.18 | 10.54±3.16 | |
| 56 | 0 | 0 | 0 | 0 | 0 |
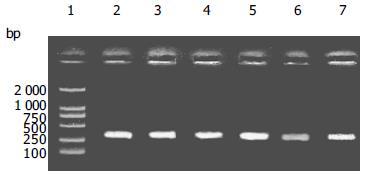
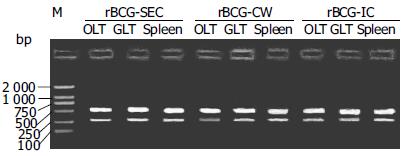
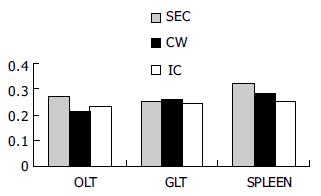
以三种重组BCG免疫14 d小鼠的OLT, GALT所抽提的DNA为模板, 用Der p2的正反向引物行PCR, 均扩增得到了约390 bp的Der p2基因(图1), 说明在这些组织中含有携带Der p2基因的BCG, 即各种BCG均能穿过黏膜上皮, 进入口咽-消化道相关淋巴组织; 此外, 在脾脏和肝脏组织中也扩增出Der p2基因, 进一步提示各种BCG完全能够通过血行途径进入全身各系统, 达到刺激全身免疫的作用. 提取各组动物三种淋巴组织(OLT, GALT和脾脏)的mRNA, 经RT-PCR均可扩增得到Der p2基因(图2), 说明携带Der p2的BCG在各组织中处于存活状态, 外源基因稳定地存在于BCG体内, 并且能够表达, 这对于诱导外源抗原特异性的免疫应答至关重要. rBCG在各组织中外源基因的表达量有所不同(图3), 一方面与rBCG在各组织中的含量有关, 另一方面在不同组织中受到免疫系统作用的强度也有所不同.
BCG作为分支杆菌的代表, 是迄今为止最安全、最稳定的疫苗之一, 因其在分子遗传学和免疫学上的许多优点而倍受重视.1990年代以来, 国内外许多学者发现, 以BCG作为载体制备外源基因重组疫苗, 既可诱发以特异性细胞毒T细胞活化为主的细胞免疫, 又可以诱发以特异性抗体产生为主的体液免疫. 根据不同的调节目的, rBCG成为各种相关疾病防治研究的重要手段, 并因此而成为热点[1-3]. 已有的研究显示其被广泛用于病毒、细菌和寄生虫感染的防治、肿瘤治疗、以及自身免疫性疾病防治等方面的研究, 取得了令人振奋的结果[4-8]. 既往我们尝试利用过敏原重组的BCG防治哮喘, 研究发现, 采用ip接种屋尘螨过敏原(Der p2)-rBCG可明显抑制Der p2诱导的Th2应答, 提示rBCG在过敏性疾病防治方面具有巨大的开发价值.
近年来, 绝大多数研究所采用的接种方式多为注射(静脉、皮下、腹腔、鼻黏膜等), 这些免疫途径所诱导的免疫应答各有不同, 为相关疾病的有效治疗提供了较多的选择[9]. 然而, 分支杆菌抗原和其菌体成分的特殊性, 使得接种后所获得的免疫保护时间较短, 而短期内重复注射具有强烈的不良反应, 给强化免疫带来困难. 鉴于BCG在调节免疫方面的优点和近年所取得的成果, 如何高效、特异地诱导重要疾病抗原的保护性免疫备受关注. 消化道黏膜面积巨大(约400 m2, 200倍于皮肤表面), 解剖学结构、免疫细胞和免疫应答分子机制与外周免疫系统迥然不同. 免疫细胞的数量比其他免疫器官的总和还要多, 因而是最大的免疫器官. 有人已经观察到rBCG经消化道接种诱导了强烈的局部和全身抗原特异性细胞免疫应答, 具有对结核[10]和人类免疫缺陷病毒(HIV)感染的防治作用[11]. 这表明, 口服摄入后, BCG本身的一些特性(抗酸、胞壁脂质含量高)使其能够穿过消化道全长, 抵抗不利因素如胃酸和酶的降解. 更重要的是, 有研究发现经消化道黏膜免疫可以抑制由纯蛋白衍生物(PPD)引起的迟发变态反应(DTH), 从而明显减少重复接种引起的不良反应[12]. 本研究表明: 三种rBCG均可通过口咽和胃肠道黏膜, 进入黏膜相关淋巴组织, 甚至在全身播散. 存在于小鼠淋巴组织和各脏器中的rBCG仍然能持续表达其所携带的外源基因, 从而提供持久的免疫刺激和佐剂作用, 对于诱导特异性T细胞应答具有重要意义. 因此, 有理由相信rBCG口服免疫后口咽胃肠道环境对其生物学行为的影响并不妨碍诱导理想的免疫应答.
编辑: 张海宁 电编: 潘伯荣
| 1. | Scanga CB, Le Gros G. Development of an asthma vaccine: research into BCG. Drugs. 2000;59:1217-1221. [PubMed] |
| 2. | Shi JR, Li Y, Qi HW, Li BH, Fan XL. Construction and identification of the E. coli-BCG shuttle vector expressing lipoprotein Der p2 on cell wall of mycobacterium vaccae. Xibao Yu Fenzi Mianyixue Zazhi. 2003;19:132-135. [PubMed] |
| 3. | 史 皆然, 李 元, 戚 好文, 李 别虎, 范 雄林. 利用Hsp基因调控元件构建胞内表达的E. coli-BCG穿梭载体. 中华微生物学和免疫学杂志. 2003;23:629-632. |
| 4. | Winter N, Lagranderie M, Gangloff S, Leclerc C, Gheorghiu M, Gicquel B. Recombinant BCG strains expressing the SIVmac251nef gene induce proliferative and CTL responses against nef synthetic peptides in mice. Vaccine. 1995;13:471-478. [PubMed] |
| 5. | Nascimento IP, Dias WO, Mazzantini RP, Miyaji EN, Gamberini M, Quintilio W, Gebara VC, Cardoso DF, Ho PL, Raw I. Recombinant Mycobacterium bovis BCG expressing pertussis toxin subunit S1 induces protection against an intracerebral challenge with live Bordetella pertussis in mice. Infect Immun. 2001;69:1976-1982. [PubMed] |
| 6. | Kremer L, Riveau G, Baulard A, Capron A, Locht C. Neutralizing antibody responses elicited in mice immunized with recombinant bacillus Calmette-Guerin producing the Schistosoma mansoni glutathione S-transferase. J Immunol. 1996;156:4309-4317. [PubMed] |
| 7. | Yamada H, Matsumoto S, Matsumoto T, Yamada T, Yamashita U. Murine IL-2 secreting recombinant Bacillus Calmette-Guerin augments macrophage-mediated cytotoxicity against murine bladder cancer MBT-2. J Urol. 2000;164:526-531. [PubMed] |
| 8. | Yasutomi Y, Koenig S, Haun SS, Stover CK, Jackson RK, Conard P, Conley AJ, Emini EA, Fuerst TR, Letvin NL. Immunization with recombinant BCG-SIV elicits SIV-specific cytotoxic T lymphocytes in rhesus monkeys. J Immunol. 1993;150:3101-3107. [PubMed] |
| 9. | Grode L, Kursar M, Fensterle J, Kaufmann SH, Hess J. Cell-mediated immunity induced by recombinant mycobacterium bovis Calmette-Guerin strains against an intracellular bacterial pathogen: importance of antigen secretion or membrane-targeted antigen display as lipoprotein for vaccine efficacy. J Immunol. 2002;168:1869-1876. [PubMed] |
| 10. | Aldwell FE, Tucker IG, de Lisle GW, Buddle BM. Oral delivery of Mycobacterium bovis BCG in a lipid formulation induces resistance to pulmonary tuberculosis in mice. Infect Immun. 2003;71:101-108. [PubMed] |
| 11. | Kawahara M, Hashimoto A, Toida I, Honda M. Oral recombinant Mycobacterium bovis bacillus Calmette-Guerin expressing HIV-1 antigens as a freeze-dried vaccine induces long-term, HIV-specific mucosal and systemic immunity. Clin Immunol. 2002;105:326-331. [PubMed] |
| 12. | Hoft DF, Brown RM, Belshe RB. Mucosal Bacilli Calmette-Guérin vaccination of humans inhibits delayed-type hypersensitivity to purified protein derivative but induces mycobacteria-specific interferon-g responses. Clin Infect Dis. 2000;30:S217222. [PubMed] |