修回日期: 2004-12-14
接受日期: 2004-12-16
在线出版日期: 2005-02-15
目的: 建立实验性肝肺综合征动物模型.
方法: Wistar♂大鼠20只随机分成正常组和模型组; 正常组给予正常饲料和自来水, 模型组以掺入胆固醇的玉米面作饲料, 胆固醇占饲料重量的5%(前2 wk的每千克饲料中含有200 g猪油), 以300 mL/L酒精作为其唯一饮料. 在实验第1 d脊背sc 5 mL/kg四氯化碳原液, 以后每隔3 d sc 400 mL/L四氯化碳(用玉米油稀释), 按3 mL/kg给予. 于8 wk末处死动物, 腹主动脉取血, 右肝和右肺用40 g/L多聚甲醛固定; 左肝950 mL/L酒精固定. 检测ALT, AST; 测定肝脏羟脯氨酸, 用氯胺T法; 肝脏HE、VG染色; 肺HE染色; 腹主动脉血氧检测; 尾静脉注射99m锝-多聚白蛋白肺脑放射活性扫描.
结果: 肝硬化形成, 肺泡-动脉氧分压差增大, 血氧含量降低, 肺血管明显扩张.
结论: 复合因素造成的模型能够作为肝肺综合征的实验动物模型.
引文著录: 王新国, 韩德五, 张慧英. 大鼠肝肺综合征模型的研究. 世界华人消化杂志 2005; 13(4): 521-523
Revised: December 14, 2004
Accepted: December 16, 2004
Published online: February 15, 2005
AIM: To establish an animal model of hepatopulmonary syndrome.
METHODS: Twenty Wistar rats were randomly divided into two groups: control group and model group. The rats in control group were fed with regular food and those in model group with food consisting of corn flour, cholesterol (5% w/w) and alcohol (300 mL/L). The model rats were then administered with 400 mL/L CCl4 (diluted by corn oil, 3 mL/kg) subcutaneously every four days. All rats were killed at the end of the eighth week. Plasma ALT and AST, liver hydroxyproline and blood oxygen of the abdominal aorta were measured. The ratio of brain-over-lung 99mTc-polymerized albumin radioactivity was calculated. Right liver and lung lobe were fixed in 40 g/L phosphate buffered formaldehyde before HE and VG staining were performed.
RESULTS: The animal model of hepatopulmonary syndrome was successfully established. Typical characteristics of cirrhosis was observed in the liver. Arterial blood oxygen content was decreased. Alveolar-arterial oxygen partial pressure difference (AaDO2) was increased. Pulmonary blood vessels were expanded markedly.
CONCLUSION: The animal cirrhotic model induced by compound factors is ideal for the study of hepatopulmonary syndrome.
- Citation: Wang XG, Han DW, Zhang HY. A rat model of hepatopulmonary syndrome. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 521-523
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.521
肝肺综合征(hepatopulmonary syndrome, HPS)是由于慢性肝病或门脉高压引起的肺内血管异常扩张、气体交换障碍和动脉血氧分压降低; 可概括为肝病-肺血管扩张-低氧血症三联征[1]. 在肝脏晚期患者中, 肝肺综合征发病率为13-47%[2], Krowka[3]发现HPS的最常见原因是肝硬化, 多见于晚期肝硬化. 由于临床上发现HPS时, 肝脏及其他脏器功能均已严重受损, 药物治疗HPS效果不好, 通过肝移植来改善低氧血症现在已成为研究的热点. 当前国内外研究肝肺综合征的动物模型多采用慢性胆总管结扎(common bile duct ligation, CBDL)复制而成. 此种方法复制的模型在病因学上来说原因较单一, 操作上具有创伤性. 我们对利用复合因素复制的肝硬化模型能否作为肝肺综合征发病机制研究的试验模型作如下研究.
Wistar ♂大鼠20只, 质量230-250 g, 由山西医科大学动物中心提供. 四氯化碳(分析纯, 天津市科赛欧科技有限公司)、玉米油、胆固醇(生物试剂, 天津市化学试剂公司分公司)、玉米面、猪油、300 mL/L酒精.
大鼠随机分成正常组和模型组; 正常组给予正常饲料和自来水, 模型组给予掺入胆固醇的玉米面作饲料, 胆固醇占饲料重量的5%(前2 wk的每千克饲料中含有200 g猪油), 以300 mL/L酒精作为其唯一饮料. 在实验第1 d脊背sc 5 mL/kg四氯化碳原液, 以后每隔3 d sc 400 mL/L四氯化碳(用玉米油稀释), 按3 mL/kg给予. 于8 wk末处死动物, 无菌腹主动脉取血, 右肝和右肺用40 g/L多聚甲醛固定; 左肝950 mL/L酒精固定. 检测ALT, AST; 测定肝脏羟脯氨酸, 用氯胺T法; 肝脏HE、VG染色; 肺HE染色; 腹主动脉血氧检测; 尾静脉注射99m锝-多聚白蛋白肺脑放射活性扫描.
统计学处理 SPSS10.0软件, 方差分析t检验.
实验过程中除2只正常鼠丢失外, 其余大鼠活动灵敏, 反应敏捷, 毛发光滑, 大便黑硬, 小便淡黄. 模型组2只分别在1 wk和3 wk死亡, 尸检发现肝脏大片坏死出血, 其余动物在整个过程中, 毛发蓬松, 毛发浅黄, 发质脆; 精神萎靡, 整日蜷缩, 食欲不振; 呼吸浅数, 大便黄较正常软, 小便少黄. 8 wk时动物体形消瘦, 步态不稳. 模型组ALT(1 402±219 vs 621±116 nkat/L, t = 3.141, P<0.01), AST(3 104±531 vs 1 145±223 nkat/L, t = 2.934, P<0.01)明显高于正常组, 均有显著意义, 提示有肝功损伤.
模型组羟脯氨酸含量明显高于正常组; 提示肝脏胶原纤维含量明显增加, 肝纤维化肝硬化程度较重(表1).
模型组动物动脉血氧分压和二氧化碳分压较正常组无明显差异, 但肺泡-动脉血氧分压差增加(表1).
99m锝-多聚白蛋白是大分子物质, 其直径大于正常的毛细血管腔, 当其流经毛细血管时被毛细血管扣留. 正常组大鼠在尾静脉注射99m锝-多聚白蛋白后, 放射区域主要聚集在肺, 大脑与其他组织中未见有放射性物质. 模型组动物的肺组织中放射性物质的含量很少, 而大脑中含量明显增加, 这说明肺血管明显扩张. 根据放射强度来推断肺血管扩张程度及分流程度(表1).
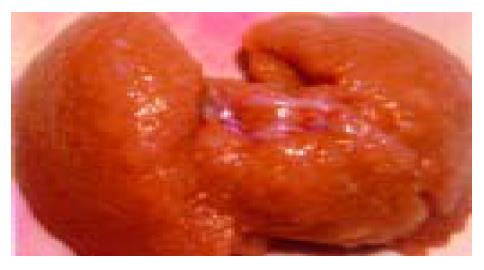
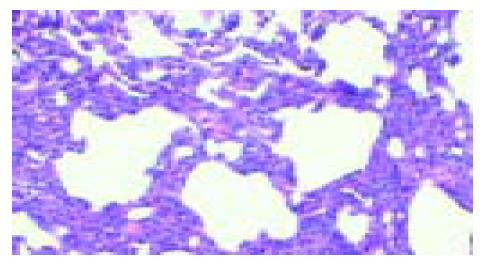
2.4 肝肺形态学改变 肝脏体积缩小、白陶土色, 有些可见咖啡色区域, 表面有米粒大小不等的颗粒(图1). 光镜下肝细胞空泡样改变, 肝纤维化增生明显, 假小叶形成. VG染色显示: 胶原纤维主要分布在汇管区. 肺体积增大, 充血水肿. HE染色显示肺外带肺泡腔减小, 肺间隔增宽, 肺间隔细胞数增多, 以巨噬细胞为主, 毛细血管增多(图2).
HPS实际上是基础肝病-肺血管扩张-动脉血氧化合功能障碍构成的三联征, 但目前对肝肺综合征的诊断尚缺乏统一标准. Rodriguez-Roisin et al[4]提出4条诊断标准: (1)有慢性肝病或严重肝病存在, 伴有或无严重肝功能不全; (2)无原发性心肺疾病, 胸片正常或有间质结节状阴影; (3)肺气体交换异常, 有或无低氧血症, 但肺泡-动脉氧梯度增大, 超过2.0 kPa; (4)肺内放射核素标记物或二维超声心动图提示肺内血管异常扩张. 张宏博 et al[5]观察99m锝-多聚白蛋白动态肺灌注扫描在肝肺综合征早期改变, 发现99m锝-多聚白蛋白动态肺灌注是反映HPS早期的较敏感的监测指标. 我们发现, 8 wk后模型组动物100%形成肝硬化, 腹主动脉血氧含量低, 肺泡-动脉氧梯度增加, 尾静脉注射99m锝-多聚白蛋白肺脑放射扫描结果提示肺血管扩张. 同时, 此模型肝脏病理改变典型, 肺部的改变与倪醒之et al[6]用四氯化碳诱导门脉高压所复制动物模型和Schraufnagel et al[7]胆总管结扎造成的胆汁性肝硬化所伴有的肺毛细血管以及巨噬细胞增多等病理改变大体一致. 按照Fallon et al[8]和Abrams et al[9]诊断程序, 我们认为, 此模型可以作为肝肺综合征动物模型.
一个理想的动物模型条件是: 与人类疾病特征相似, 病变有一定的发展过程, 形成率高, 死亡率低, 重复性好, 造模简便易行[10]. 复合因素造成的肝硬化模型自1972年建立以来, 经过多年实践证实, 肝硬化形成率高, 重复性好, 肝脏病理阶段性变化分明[11]; 与目前比较通用的慢性胆总管结扎造模(CBDL)相比, 用复合因素造模具有以下特点: (1)从临床肝硬化形成的病因来看, 复合因素导致肝脏病变更贴近临床, CBDL则是单纯胆总管结扎, 造成胆汁淤积性肝硬化; (2)复合因素是利用四氯化碳慢性中毒, 低蛋白和胆碱等营养因素致成肝细胞坏死-脂肪变-肝纤维化-肝硬化, 符合肝硬化的发生发展各阶段; (3)复合因素所致模型可以应用于多种因素引起的肝硬化及肝硬化基础上出现的肝肺综合征的发病机制研究; (4)从死亡率来看, 复合因素死亡率低, CCBDL则较高[12]. 根据倪醒之et al[6]对CCl4是否在肝肺综合征的形成过程中对肺组织有损坏作用研究, 我们排除了低氧血症是由CCl4对肺损伤造成的. 因此, 本实验应用复合因素所致的肝硬化模型是研究肝肺综合征较为理想的动物模型.
编辑: 潘伯荣 审读:张海宁
| 2. | Hopkins WE, Waggoner AD, Barzilai B. Frequency and significance of intrapulmonary right-to-left shunting inend-stage hepatic disease. Am J Cardiol. 1992;70:516-519. [PubMed] [DOI] |
| 3. | Krowka MJ. Clinical management of hepatopulmonary syndrome. Semin Liver Dis. 1993;13:414-422. [PubMed] [DOI] |
| 4. | Rodriguez-Roisin R, Agusti A, Roca J. The hepatopulmonary syndrome: new name, old complexities. Thorax. 1992;47:879-902. [PubMed] [DOI] |
| 5. | 张 宏博, 柏 长青, 汪 静, 韩 国宏, 郭 学刚, 周 新民, 吴 开春, 丁 杰, 樊 代明. 99m锝-多聚白蛋白动态肺灌注扫描 在肝肺综合征早期诊断中的意义. 中华肝脏病杂志. 2001;9:331-333. |
| 7. | Schraufnagel DE, Patel KR. Sphincters in pulmonary veins. An anatomic study in rats. Am Rev Respir Dis. 1990;141:721-726. [PubMed] [DOI] |
| 8. | Fallon MB, Abrams GA. Pulmonary dysfunction in chronic liver disease. Hepatology. 2000;32:859-865. [PubMed] [DOI] |
| 9. | Abrams G, Nanda N, Dubovsky EV, Krowka MJ, Fallon MB. Use of macroaggregated albumin lung perfusion scanto diagnose hepatopulmonary syndrome: a new approach. Gastroenterology. 1998;114:305-310. [PubMed] [DOI] |