修回日期: 2004-12-19
接受日期: 2004-12-21
在线出版日期: 2005-02-15
目的: 探索Wistar大鼠胃Cajal间质细胞(ICC)的分离和培养方法, 为进一步研究其起搏机制提供条件.
方法: 取出Wistar大鼠的胃组织, 采用胶原酶酶解法分离细胞, 将细胞悬液接种于含干细胞因子的平滑肌细胞培养基中, 进行培养, 隔日换液. 用c-Kit特异性抗体标记细胞, 证实细胞类型.
结果: 培养后的ICC保持其固有特征, 多突起, 核大, 相互之间连接形成网络, c-Kit抗体荧光染色证实细胞培养成功.
结论: 酶解法分离Wistar大鼠胃ICC并培养成功.
引文著录: 刘勇, 齐清会. 大鼠胃Cajal间质细胞的分离和培养. 世界华人消化杂志 2005; 13(4): 495-498
Revised: December 19, 2004
Accepted: December 21, 2004
Published online: February 15, 2005
AIM: In order to investigate the pacing mechanism of the interstitial cells of Cajal (ICC), the method for isolation and culture of ICC from the Wistar rat stomach was explored.
METHODS: The gastric tissue of Wistar rat was dissected. Collagenase was used to isolate ICC. The cells were suspended in smooth muscle cell medium containing stem cell factor. The medium was changed every other day until the cells were used. The c-Kit antibody was applied to label ICC to distinguish them from smooth muscle cells.
RESULTS: ICC in culture maintained the intrinsic characteristics: multiple processes, large nuclei, and intercellular network. Fluorescent staining with c-Kit antibody confirmed that the culture ICC was successful.
CONCLUSION: ICC has been isolated by enzyme digestion method from Wistar rat stomach and cultured successfully.
- Citation: Liu Y, Qi QH. Isolation and Culture of Rat Gastric Interstitial Cells of Cajal. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 495-498
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/495.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.495
Cajal间质细胞(interstitial cells of Cajal, ICC)作为胃肠运动的起搏细胞, 越来越受到关注, 多种胃肠运动障碍疾病均与之相关. 目前对其起搏机制还缺乏十分明确的认识. 因此, 从细胞学角度进行深入研究, 有助于了解ICC的起搏机制及信号传导途径, 有利于更深入地掌握疾病本质, 制定合理有效地防治措施. 目前国外学者只对Balb/c小鼠的胃肠ICC成功进行了分离和培养, 国内外尚未见对Wistar大鼠胃肠道ICC进行分离和培养的报道. 我们尝试进行了Wistar大鼠胃ICC的分离和培养, 并取得成功.
Wistar大鼠3-4月龄, 体质量160-200 g, 雌雄兼有, 禁食不禁水48 h, CO2吸入麻醉后, 断颈处死. 腹部正中切口打开腹腔, 自贲门和幽门处离断组织, 取出胃(包括胃底、胃体和幽门)置于冷KRB液(Krebs-Ringer bicarbonate solution: (mmol/L)Na+ 137.4, K+ 5.9, Ca2+ 2.5, Mg2+ 1.2, Cl- 134, HCO3- 15.5, H2PO4- 1.2, 葡萄糖 11.5, 37.5±0.5 ℃, pH 7.3-7.4, 970-30 m/L CO2冒泡)中. 小心去除系膜, 沿小弯缘剪开胃, 洗净内容物. 将胃组织钉固于蜡板上, 锐性去除黏膜和黏膜下层. 将分离出的肌肉组织剪成约1-2 mm3小块.
新鲜分离的肌条小块在酶解液中37 ℃孵育60 min, 轻微搅拌. 酶解液包括: DMEM(Dulbecco's modified Eagle's medium, Gibco公司, USA), 1.0 g/L II型胶原酶(Sigma公司, USA).30 min更换1次酶解液, 吸出的上清酶液置于离心管内4 ℃保存. 消化结束后, 将组织和前面的上清液一同经过100目筛网过滤. 收集滤液, 1 000 r/min离心10 min, 弃上清, 加入含200 g/L胎牛血清(Hycloue, USA)的SMGM(Smooth Muscle Grown Medium, Clonetics, Cambrex Bio Science Walkersville, USA)5 mL, 吹打沉淀, 使细胞悬浮. 混悬液置于培养瓶中, 37 ℃贴壁1 h. 再加入7 mL含200 g/L胎牛血清的SMGM, 加入20 g/L抗菌素(青霉素G钠200 kU/L, 硫酸链霉素200 g/L, 两性霉素B 0.5 g/L)、2 mmol/L谷氨酰氨、5 mg/L SCF(stem cell factor from mouse, Sigma, USA), 吹打均匀, 轻轻吸取出上清, 平均加到带有圆形盖玻片的无菌六孔培养板(Corning, USA)中. 在37 ℃、50 mL/LCO2培养箱(Jouan SA, France)中孵育. 48 h后, 培养基换为含有SCF的SMGM, 加入20 g/L抗菌素和2 mmol/L谷氨酰胺. 培养基隔日更换. 取贴壁良好的细胞玻片, 弃去培养基, 用40 g/L多聚甲醛(PBS稀释)溶液4 ℃固定30 min. 固定后, 标本在PBS液(0.01 mol/L pH 7.4)中冲洗45 min(315 min). 在含100 mL/L山羊血清(北京中山试剂公司)的PBS液中室温(21-24 ℃)孵育60 min, 减少非特异性抗体的结合. 标本中加入兔抗大鼠c-Kit蛋白多克隆IgG抗体(c-19, Santa Cruz, USA, 1: 200, PBS稀释)37 ℃ 温箱孵育1 h, 4 ℃冰箱孵育过夜. 用PBS液冲洗(35 min), 加入次级抗体FITC结合山羊抗兔IgG抗体(Sigma, USA, 1:50, PBS稀释)37 ℃温箱避光孵育60 min. 阴性对照不加一抗, 只用PBS, 余操作步骤相同. 将玻片置于Chamber Slide(Molecular probes, USA)上, 采用Olympus倒置显微镜(CK40型, Japan)和Bio-Rad Radiance 2000激光扫描共聚焦显微镜(USA)观察结果并采集图像.
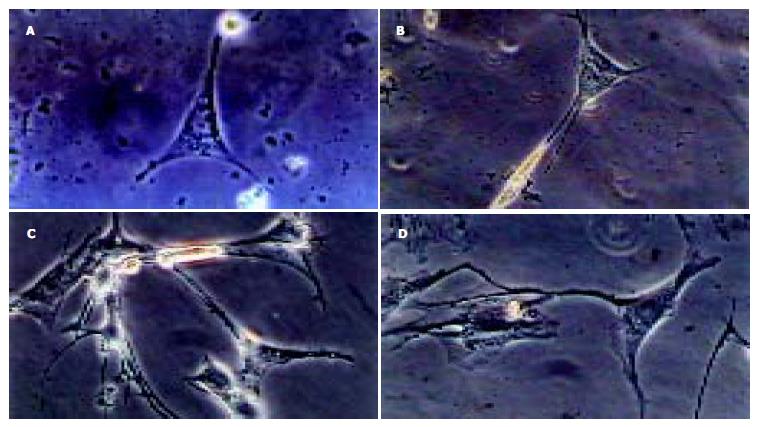
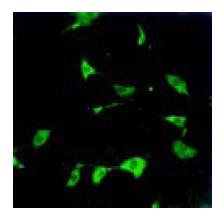
培养3 d后, 可分辨出ICC形态, 胞体呈三角形, 可见大的细胞核, 核周胞质少, 突起伸展, 与平滑肌有显著不同(图1A). 培养5 d后, ICC形态更加清晰, 大的胞核很清楚, 自胞体发出的突起向周围伸长; 相邻的平滑肌细胞呈梭形, 二者从形态上很容易区分(图1B). 培养7 d后, 相邻ICC突起间有连接形成, 部分ICC的细胞突起与邻近平滑肌细胞也形成连接(图1C). 培养9 d后, ICC细胞突起向各方向伸出, 在初级分支上还可见二级分支, 与相邻ICC和平滑肌细胞间形成连接, ICC突起交织, 形成小的、较为分散的网络(图1D). 在共聚焦显微镜下观察, 可见ICC c-Kit免疫荧光染色呈阳性(图2), 细胞间相互联系, 突起交织, 呈网络状. 同时培养的平滑肌细胞c-Kit染色为阴性.
ICC的分离很困难. 他们与许多类型的细胞之间紧密相连, 如平滑肌细胞和神经纤维束. 同时, 成年动物的胃肠道ICC包埋在致密的结缔组织基质中, 尤其是胶原纤维[1]. 有关犬结肠、小鼠和豚鼠胃肠道的ICC分离、培养至今已有报道, 但对Wistar大鼠胃肠道ICC细胞的分离、培养还未见报道. 我们参照Koh et al[2]方法, 适当改进, 首次进行大鼠胃ICC的分离和培养. 实验只选用Ⅱ型胶原酶进行酶解, 因为胶原酶具有很好的活性, 且对细胞损害最小[3]. 细胞培养2-3 d后ICC的突起伸展出来, 胞体呈三角形或梭形, 核大而明显, 伴少量核周胞质, 可与平滑肌细胞明显区分. 细胞培养4-5 d, 可见ICC的突起明显, 向周围的细胞伸展, 个别细胞与ICC或平滑肌细胞有接触. 细胞培养7 d后, 可见ICC相互之间及与平滑肌细胞之间有连接, 部分ICC形成小的网络状结构. 文献报道[4-7], 培养2-3 d即可见到明显ICC网络或细胞团簇, 培养ICC的同时也会有平滑肌细胞生长, 二者很容易区分. 本实验的ICC生长缓慢, 平滑肌细胞生长较好, 3-5 d即可见成团的平滑肌细胞, 其中间或有ICC. 研究表明[8-10]干细胞因子(stem cell factor, SCF)是ICC生长和发育所必需的, 也与c-kit基因表达密切相关. 实验中ICC浓度较低, 生长缓慢可能是由于培养中加入的干细胞因子(stem cell factor, SCF)是小鼠源性, 与实验大鼠有一定的种属差别, 导致ICC生长发育缓慢. 其次, 由于ICC对缺氧十分敏感, 我们实验的温箱环境与文献[2,11]不太一致, 氧浓度不足可能也是ICC生长发育迟缓的原因之一.
为取得良好的细胞分离和培养结果, 实验中应注意: (1)在清洗组织、去除胃黏膜和黏膜下层过程中, 避免过度牵拉肌组织, 尽可能使用较小的机械性拉力, 使获得的ICC数量增加; (2)在混悬细胞时, 快速吸取或吹打, 且使用的吸管口径偏小, 可降低随后培养细胞的成功率; (3)由于ICC的细胞间连接紧密, 适宜的酶解浓度可有效使细胞分散, 且避免大量细胞因酶浓度过高而破裂; (4)分散细胞尽量采用轻微振荡, 避免剧烈操作; (5)酶消化时间应适中, 自剪切成肌条小块到最后接种培养的时间尽量缩短; (6)尽可能选取鼠龄较短的大鼠作为实验对象, 细胞生长较快. 因为刚酶解后的ICC形态变圆, 突起消失, 失去了c-Kit免疫活性[12], 在细胞悬液内难以与其他细胞区分出来. ICC在培养3-5 d后, 具备了典型的细胞形态, 有利于在相差显微镜下与平滑肌细胞相区分; 且c-Kit免疫活性在培养24 h后恢复, 更利于标记和区分[2]. 在培养细胞团和细胞网络中, 为了较好的区分出ICC, 特异性免疫标记就更重要.
胃肠道中, c-Kit 免疫活性只在ICC中表达[13]. 目前c-Kit抗体的免疫组化检测, 作为一种特异的ICC染色法, 用于研究ICC分布、密度、ICC之间和ICC与其他类型细胞的关系及变化[14-15].c-kit基因为原癌基因, 位于5号染色体W位点上, 编码具有酪氨酸激酶的细胞表面跨膜受体c-Kit, 后者对ICC的发育和功能维持至关重要[15-18]. 根据ICC的特性, 我们采用c-Kit抗体标记, 进行免疫荧光染色, 确定培养细胞的类型. 发现c-Kit免疫活性仍为ICC所特有, 平滑肌细胞无着色. 荧光显微镜下可见ICC细胞突起向各个方向伸展, 相互联系, 交织成网络状; 细胞呈梭形或三角形, 核大、核周胞质较少; 相差显微镜下可见ICC突起与平滑肌细胞之间也有联系. 分离的ICC需2-3 d培养才伸出分支, 且ICC在培养条件下有很高的形成网络特性[2-3].ICC之间以及与平滑肌细胞的相互连接是ICC发育的基础, 保持这些细胞类型之间的相互作用可维持ICC的正常功能. 我们采用的分离和培养方法简便易行, 操作并不复杂, 所需试剂也易于购置. 实验所得ICC细胞形态完整, 数量较多, 可以进行常规各种细胞学和细胞电生理研究. 大鼠胃ICC分离培养的成功有利于今后不断深入研究ICC的起搏机制, 发现和阐明各种离子通道和信号传导途径, 进一步研究ICC在各种胃肠运动功能障碍疾病中的作用机制和相关药物治疗作用的靶位点. ICC的分离和培养方法日臻完善, 对其进行深入研究已成为可能.
编辑: 潘伯荣 审读:张海宁
| 1. | Faussone-Pellegrini MS. Histogenesis, structure and relationships of interstitial cells of Cajal (ICC): from morphologyto functional interpretation. Eur J Morphol. 1992;30:137148. [PubMed] |
| 2. | Koh SD, Sanders KM, Ward SM. Spontaneous electrical rhythmicity in cultured interstitial cells of cajal from themurine small intestine. J Physiol. 1998;513:203213. [PubMed] |
| 3. | Lee JC, Thuneberg L, Berezin I, Huizinga JD. Generation of slow waves in membrane potential is an intrinsic propertyof interstitial cells of Cajal. Am J Physiol. 1999;277:G409-423. [PubMed] |
| 4. | Torihashi S, Fujimoto T, Trost C, Nakayama S. Calcium oscillation linked to pacemaking of interstitial cells of Cajal:requirement of calcium influx and localization of TRP4 in caveolae. J Biol Chem. 2002;277:19191-19197. [PubMed] [DOI] |
| 5. | Kim YC, Koh SD, Sanders KM. Voltage-dependent inward currents of interstitial cells of Cajal from murine colon andsmall intestine. J Physiol. 2002;541:797810. [PubMed] |
| 6. | Kim TW, Koh SD, Ordog T, Ward SM, Sanders KM. Muscarinic regulation of pacemaker frequency in murinegastric interstitial cells of Cajal. J Physiol. 2003;546:415-425. [PubMed] [DOI] |
| 7. | Zhu Y, Golden CM, Ye J, Wang XY, Akbarali HI, Huizinga JD. ERG K+ currents regulate pacemaker activity in ICC. Am J Physiol Gastrointest Liver Physiol. 2003;285:G1249-1258. [PubMed] [DOI] |
| 8. | Mikkelsen HB, Malysz J, Huizinga JD, Thuneberg L. Action potential generation, Kit receptor immunohistochemistryand morphology of steel-Dickie(Sl/Sld)mutant mouse small intestine. Neurogastroenterol Motil. 1998;10:1126. [PubMed] [DOI] |
| 9. | Ordog T, Ward SM, Sanders KM. Interstitial cells of cajal generate electrical slow waves in the murine stomach. J Physiol. 1999;518:257269. [PubMed] |
| 10. | Rich A, Miller SM, Gibbons SJ, Malysz J, Szurszewski JH, Farrugia G. Local presentation of Steel factor increasesexpression of c-kit immunoreactive interstitial cells of Cajal in culture. Am J Physiol Gastrointest Liver Physiol. 2003;284:G313-320. [PubMed] [DOI] |
| 11. | Jun JY, Choi S, Chang IY, Yoon CK, Jeong HG, Kong ID, So I, Kim KW, You HJ. Deoxycholic acid inhibits pacemakercurrents by activating ATP-dependent K+ channels through prostaglandin E2 in interstitial cells of Cajal from themurine small intestine. Br J Pharmacol. 2004;29:1-10. [PubMed] |
| 12. | Epperson A, Hatton WJ, Callaghan B, Doherty P, Walker RL, Sanders KM, Ward SM, Horowitz B. Molecular markersexpressed in cultured and freshly isolated interstitial cells of Cajal. Am J Physiol Cell Physiol. 2000;279:C529-359. [PubMed] |
| 13. | Takaki M. Gut pacemaker cells: the interstitial cells of Cajal(ICC). J Smooth Muscle Res. 2003;39:137-161. [PubMed] [DOI] |
| 14. | Vannucchi MG. Receptors in interstitial cells of Cajal: identification and possible physiological roles. Microsc Res Tech. 1999;47:325-335. [PubMed] [DOI] |
| 15. | Pluja L, Alberti E, Fernandez E, Mikkelsen HB, Thuneberg L, Jimenez M. Evidence supporting presence of twopacemakers in rat colon. Am J Physiol Gastrointest Liver Physiol. 2001;281:G255-266. [PubMed] |
| 16. | Wester T, Eriksson L, Olsson Y, Olsen L. Interstitial cells of Cajal in the human fetal small bowel as shown by c-kitimmunohistochemistry. Gut. 1999;44:65-71. [PubMed] [DOI] |
| 17. | Hirst GD, Ward SM. Interstitial cells: involvement in rhythmicity and neural control of gut smooth muscle. J Physiol. 2003;550:337-346. [PubMed] [DOI] |
| 18. | Daigo Y, Takayama I, Ponder BA, Caldas C, Ward SM, Sanders KM, Fujino MA. Differential gene expression profile inthe small intestines of mice lacking pacemaker interstitial cells of Cajal. BMC Gastroenterol. 2003;3:17. [PubMed] [DOI] |