Copyright
©The Author(s) 2005. Published by Baishideng Publishing Group Inc. All rights reserved.
MSG-肝再生-大鼠再生肝组织基因表达谱分析
李瀚旻, 高翔, 周密思
李瀚旻, 周密思, 高 翔, 湖北中医学院附属医院肝病研究所 湖北省武汉市 430061
李瀚旻, 男, 1956-05-17生, 湖北利川市人, 土家族, 1992年湖北中医学院硕士研究生毕业, 2000年湖北中医学院博士研究生毕业, 副主任医师, 主要从事肝再生的基础与临床研究.
ORCID number: $[AuthorORCIDs]
基金项目: 国家自然科学基金资助项目, No. 30271562; 湖北省自然科学基金资助项目, No. 2001ABB171.
电话: 027-88929180
收稿日期: 2004-11-16
修回日期: 2004-12-02
接受日期: 2004-12-09
在线出版日期: 2005-02-15
目的: 通过对MSG-肝再生-大鼠再生肝组织基因表达谱的分析, 探讨MSG-肝再生-大鼠肝再生紊乱的分子机制.
方法: 正常大鼠和MSG-大鼠均于出生后6 wk行肝大部切除(约占全肝的68%), 前者为肝再生-大鼠模型(对照组), 后者为MSG-肝再生-大鼠(模型组). 于术后5 d处死实验动物, 取再生肝组织液氮冻存. 选用1176条与细胞分化增生相关的基因表达谱芯片, 提取各组大鼠再生肝组织mRNA, 进行RT-PCR并掺入33P标记合成cDNA探针, 将探针与表达谱芯片杂交以观察再生肝组织基因表达谱的变化, 所得数据用Microsoft Access、Microsoft Excel软件处理, 筛选样本之间杂交信号比值有差异表达的基因并分类.
结果: 在所检测的1176条基因中, 模型组相对于对照组的差异表达基因有256条(上调表达40条, 下调表达216条), 其中有10条基因的表达产物与细胞受体相关、有15条基因与转录相关、有9条基因与细胞黏附受体相关、有98条基因与细胞新陈代谢相关、有9条基因与翻译后修饰相关、有11条基因与蛋白质翻折有关.
结论: MSG-肝再生-大鼠再生肝组织的基因表达谱相对于肝再生-大鼠模型有显著改变, 细胞分化增生相关的基因表达失调是MSG-肝再生-大鼠肝再生紊乱的重要分子机制.
关键词: 肝再生; MSG; 基因芯片
引文著录: 李瀚旻, 高翔, 周密思. MSG-肝再生-大鼠再生肝组织基因表达谱分析. 世界华人消化杂志 2005; 13(4): 448-451
Gene expression profile of liver regeneration induced by monosodium L-glutamate in rat
Han-Min Li, Xiang Gao, Mi-Si Zhou
Han-Min Li, Xiang Gao, Mi-Si Zhou, Hepatology Research Institute, Affiliated Hospital of Hubei Traditional Chinese Medicine College, Wuhan 430061, Hubei Province, China
Supported by: The Natural Science Foundation of China, No. 30271562 and the Natural Science Foundation of Hubei Province, No.2001ABB1717.
Correspondence to: Dr. Han-Min Li, Hepatology Research Institute, Affiliated Hospital of Hubei Traditional Chinese Medicine College, Wuhan 430061, Hubei Province, China. lihanmin@public.wh.hb.cn
Received: November 16, 2004
Revised: December 2, 2004
Accepted: December 9, 2004
Published online: February 15, 2005
AIM: By analyzing the gene expression profile in the regenerated liver tissue, to study the molecular mechanism of liver regeneration disturbance induced by monosodium L-glutamate (MSG) in rat.
METHODS: Both rats (control group) and MSG-rats (model group) were operated to excise the left and middle lobes of liver (about 68% of all the liver) 6 weeks after birth. The rats were executed at 5th day after operation, and the regenerated liver tissues were frozen by liquid nitrogen. A gene chip with 1176 genes was used to detect the differentially expressed genes in the regenerated liver tissue. mRNAs were extracted from the regenerated liver tissue and 33P labeled cDNA probes were prepared by RT-PCR. The probes were hybridized with the gene chip. The data were analyzed with Microsoft Access and Excel to determine the differentially expressed genes.
RESULTS: In the 1176 examined genes, there were 256 differentially expressed genes in model group in contrast with control group, with 40 genes up-regulated and 216 gene down-regulated. Among them, there were 10 genes associated with cell receptors, 15 genes associated with transcription, 9 genes associated with cell adhesion receptor, 98 genes associated with metabolism, 9 genes associated with post-translational modification/protein folding, and 11 genes associated with protein turnover.
CONCLUSION: The gene expression profile of the MSG-indcued liver regeneration is significantly different from partial hepatectomy-induced liver regeneration in rat.
Key Words: Liver regeneration; Monosodium L-glutamate; Gene chip
0 引言
MSG-肝再生-大鼠模型的神经-内分泌-免疫网络功能紊乱, 下丘脑-垂体-肾上腺轴功能亢进, 肝再生过程紊乱[1-5]. 肝再生过程错综复杂, 与多个基因的表达和调控密切相关, 我们利用基因芯片技术对MSG-肝再生-大鼠再生肝的基因表达谱进行分析, 探讨MSG-肝再生-大鼠肝再生紊乱的分子机制.
1 材料和方法
1.1 材料
Wistar新生大鼠, ♂, 由湖北省医学科学院动物实验中心提供; 动物饲料由湖北省医学实验动物中心饲料加工厂提供. 左旋谷氨酸单钠(monosodium L-glutamate, MSG)购自美国Sigma公司. Trizol购自Gibco公司. Oligotex mRNA midi Kit购自Qiagen公司.
1.2 方法
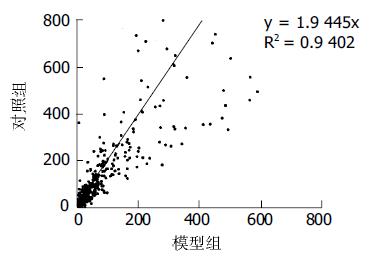
将实验大鼠分成2组, MSG-肝再生-大鼠(模型组)、肝再生-大鼠(对照组). 模型组大鼠于出生后2, 4, 6, 8, 10 d sc MSG, 每次4 g/kg体重(用生理盐水溶解), 对照组sc等体积生理盐水. 28 d后离乳, 分笼饲养, 光照时间12 h(08: 00-20: 00), 温度24 ℃左右, 动物自由饮水摄食. 8 wk实验大鼠在乙醚麻醉下, 按肝标准切除法, 切除肝的左叶和中叶(约占全肝的68%), 然后缝合伤口. 手术均为清洁手术, 均于8: 00-12: 00进行手术, 避免昼夜节律对肝再生的影响. 动物自由饮水摄食. 手术后5 d处死动物, 取再生肝组织标本液氮冻存待测. 选择1176条与细胞分化增生相关的基因制作cDNA芯片, 所用的1176个靶基因cDNA克隆由中科开瑞生物芯片公司提供. 按常规方法提取实验大鼠再生肝组织Totol RNA, 用Oligotex mRNA midi Kit(Qiagen公司)从Total RNA中分离poly+(A)mRNA. 取分离得到的mRNA 1 mg, 加入随机引物(8个碱基)3 mL, 用RNase-free Water定溶至10 mL.70 ℃水浴3 min后冰上骤冷, 依次加入M-MLV5碆uffer 6 mL、RNase Inhibitor 1 mL、dNTP(A-)1 mL、dATP 1 mL、M-MLV酶 2 mL、[a-33P]dATP 10 mL混匀. 37 ℃水浴30 min后, 再42 ℃水浴1.5 h. 水浴结束后加10 mol/L NaOH 1.5 mL, 沸水浴5-7 min, 取出冰上冷却3 min后离心机轻甩. 依次加入冰醋酸0.9 mL、醋酸钠6.5 mL, 混匀后再加入2.5倍体积无水乙醇, 彻底混匀, 冰浴30 min后15 000 g离心10 min. 弃上清, 向沉淀中加入DNase-free水40 mL溶解, 放置待用. 经预杂交与杂交后, 测量膜正面Counts, 根据Counts确定压屏时间和扫描时间, 用Fujifilm公司BAS-MS 2340磷屏、FLA 3000扫描仪压屏、扫描. 将杂交膜上的信号灰度定量为数值, 消除背景信号对实验信号的干扰, 进行均一化处理以使结果具有可比性. 所得数据利用Microsoft Access、Microsoft Excel软件处理, 从而获得样本之间杂交信号比值(Ratio值)有差异表达(Ratio值大于2为该基因上调表达, Ratio值小于0.5为该基因下调表达)的基因及其分类, 并用散点图体现样本之间的基因表达差异.
2 结果
MSG-肝再生-大鼠和肝再生-大鼠再生肝组织的基因芯片的杂交膜图像显著不同(图1, 2), 散点图反映二者之间差异表达基因的分布情况(图3). 在所检测的1176条与细胞分化增生相关的基因中, 模型组相对于对照组的差异表达基因有256条, 其中上调的基因有40条, 下调的基因有216条. 在上调的40条基因中, 有12条基因的表达产物与转录相关; 有2条基因与细胞黏附受体相关, 分别为基质黏附受体和细胞间黏附受体; 有3条基因与细胞新陈代谢相关; 有9条基因的表达产物与翻译后修饰、蛋白质折叠相关; 有2条基因表达产物与DNA翻译相关, 为翻译因子; 有2条基因表达产物与RNA加工、翻折和转运相关; 有2条基因表达产物与DNA结合、染色质蛋白相关; 有8条基因表达产物与细胞受体(含配体)相关; 有1条是衔接子和受体相关蛋白基因. 从亚细胞定位来看, 有11条基因表达产物为质膜蛋白, 9条为细胞质蛋白, 2条为细胞外隐匿蛋白, 3条基因表达产物位于高尔基复合体, 15条为核蛋白. 在下调的216条基因中, 有1条基因的表达产物是细胞表面抗原; 有3条基因表达产物与转录相关; 有7条基因表达产物是细胞黏附受体; 有4条基因表达产物是免疫系统蛋白; 有4条基因表达产物为细胞外传输、运载蛋白; 有1条基因的表达产物为张力反应蛋白, 并与新陈代谢相关; 有7条基因的表达产物为膜通道和传输蛋白; 有4条基因表达产物为细胞外基质蛋白; 有37条基因表达产物为运输、打靶蛋白; 有95条基因表达产物与新陈代谢有关; 有1条基因表达产物与RNA加工、翻折和转运有关; 有2条基因表达产物为细胞信号系统、细胞外联络蛋白; 有9条基因表达产物为细胞内传感器/感受器/调制器; 有11条基因表达产物与蛋白质翻折有关; 有2条基因表达产物为细胞受体; 有5条基因表达产物为细胞骨架/动力蛋白. 从亚细胞定位来看, 有31条基因的表达产物属于质膜蛋白, 其中1条基因表达产物尚定位于高尔基复合体及微粒体蛋白; 有98条基因表达产物属于细胞质蛋白, 其中尚有4条基因定位于质膜蛋白, 有2条定位于细胞外隐匿蛋白, 有1条定位于高尔基复合体, 有1条定位于细胞骨架蛋白, 有1条定位于线粒体蛋白, 有3条定位于核蛋白, 有1条定位于核内体蛋白; 有4条基因表达产物定位于内质网, 其中有2条尚分别属于质膜蛋白和细胞质蛋白; 有18条基因表达产物属于细胞外隐匿蛋白; 有6条基因表达产物定位于高尔基复合体, 其中尚有1条属于细胞质蛋白; 有5条基因表达产物属于细胞骨架蛋白; 有3条基因的表达产物属于溶酶体蛋白, 其中1条基因还定位于核内体蛋白和质膜蛋白; 有19条基因表达产物属于线粒体蛋白, 其中2条尚分别定位于细胞质蛋白和过氧化物酶蛋白; 有8条基因表达产物属于核蛋白; 有5条基因表达产物属于过氧化物酶蛋白; 有5条基因表达产物属于微粒体蛋白, 其中1条还属于质膜蛋白; 有3条基因表达产物属于细胞外基质蛋白; 有3条基因的表达产物定位于核膜、核质和核孔.
图3 MSG-肝再生-大鼠和肝再生-大鼠再生肝组织差异表达基因散点图分布.
3 讨论
MSG-肝再生-大鼠是神经-内分泌-免疫网络功能紊乱状态下的肝再生模型, 肝再生过程严重失调, 表现为初期(术后1 d)肝再生较快, 中晚期肝再生过程则受到显著抑制, 最终在肝再生度、肝细胞分裂指数和肝重/体重比值等方面均不能恢复到正常水平[1]. 实验表明, MSG-肝再生-大鼠的神经-内分泌-免疫网络功能紊乱可能是其肝再生过程严重失调的重要机制. 进一步用电镜、原位末端标记技术和免疫组织化学方法对MSG-肝再生-大鼠下丘脑弓状核神经细胞凋亡状态及凋亡相关基因转化生长因子(transforming growth factor, TGF)b1的表达进行研究后发现, MSG-肝再生-大鼠弓状核神经细胞凋亡可能是其神经-内分泌-免疫网络功能紊乱的重要机制之一, 随着弓状核神经细胞凋亡指数增高, 其TGF-β1表达亦相应增强. 提示神经元胞质钙离子过度负荷和TGF-β1 蛋白共同参与了MSG-肝再生-大鼠弓状核神经细胞凋亡的调控[2-5]. 本结果表明, MSG-肝再生-大鼠再生肝组织基因表达谱的变化规律是与细胞分化增生相关的基因以表达下调为主, 在所检测的1176条基因中, 差异表达基因有256条, 其中下调的基因有216条, 上调的基因仅40条, 下调表达是上调表达的5倍多. 上调表达的基因中, 以细胞受体为主, 如生长激素释放受体、降钙素受体样受体、白介素9受体、外激素受体、孕酮受体、白血病抑制因子受体、促生长激素神经肽受体、细胞黏附受体等基因. 这些受体高表达提示在MSG-肝再生-大鼠再生肝组织中生长激素释放激素(growth hormone releasing hormone, GHRH)、降钙素(calcitonin, CT)、孕酮、促生长激素神经肽等激素及激素样物质分泌可能减少, 导致其受体病理性增加, 而这些激素及激素样物质分泌减少可导致MSG-肝再生-大鼠肝再生受到抑制. 下调表达的基因中, 见于一些已知与肝再生相关的基因, 如代谢酶(Ⅱ、Ⅲ碘甲腺原氨酸、雌激素转磺酶、胰高血糖素、辅酶Q、葡糖激酶、甲状腺过氧化物酶、25-羟基维生素D3 1a-羟化酶等)及LPS诱导的肿瘤坏死因子(tumor necrosis factor, TNF)a等基因也表达下调, 这些基因表达下调可能是MSG-肝再生-大鼠肝再生受抑制的重要分子机制.
三碘甲腺原氨酸(T3)是甲状腺激素的主要活性成分, 其主要生理作用为促进机体的生长发育, 增加代谢率和氧耗量. 研究证明, T3为肝细胞的促分裂剂, 通过参与肝细胞的增生和凋亡过程, 使肝细胞的增生功能增强[6-7].Oren et al[8] 用T3注射给肝部分切除后的大鼠, 发现可使组蛋白3 mRNA和细胞周期素依赖性激酶-2的表达增加, 二者均为肝再生的标志. Knopp et al[9]还发现大鼠肝部分切除后蛋白S14的基因表达下降, 而T3作为蛋白S14基因的强诱导剂可使蛋白S14基因的抑制状态逆转. TNF-α能激活DNA结合蛋白包括核转录因子kB(NF-κB)、信号转导子激活转录子(STAT)蛋白和CCAAT/增强子结合蛋白(C/EBP), 调节多种肝细胞特异基因转录, 诱导肝细胞基因表达, 增加正向急性期蛋白合成, 抑制负向急性期蛋白, 改变肝细胞与生长有关的基因表达[10-17].Yamada et al[18-19]研究发现TNF-αⅠ型受体缺乏小鼠肝大部切除后DNA合成严重受损, STAT3及NF-κB无增加, 但抑制中性粒细胞的激活, 当注入白介素(interleukin, IL)-6后能够纠正TNF-αⅠ型受体的缺陷作用, 表明TNF-α通过调节IL-6分泌而参与肝再生的过程. IL-6由Kupffer细胞分泌, 由TNF-α调节其分泌, 是肝细胞急性期反应蛋白合成的主要刺激信号[20-28], PH后血浆IL-6浓度增加, 24 h达高峰, 纯合型IL-6基因缺失小鼠PH后肝细胞DNA合成受到抑制, myc、cyclin D及STAT3活性显著降低, 应用IL-6后能够纠正IL-6基因缺陷引起的负面效应[29-30], 表明IL-6亦是参与早期肝再生信号的细胞因子之一. 其中一些上调或下调表达的基因与肝再生关系尚不十分清楚, 尚待进一步研究.