修回日期: 2004-12-21
接受日期: 2005-01-08
在线出版日期: 2005-02-15
HBx对宿主细胞基因存在着广泛而深刻的影响. 虽然其致癌机制仍不很明确, 但其在HCC发病中的作用却是肯定的. HBx能影响肝细胞的生长、转化、迁移和凋亡等重要细胞过程以及DNA的修复过程, 并能促进肿瘤新生血管的形成. HBx的这些重要作用为HCC治疗新靶点的选择提供了依据. 本文在此基础上, 进一步提出了HCC生物学治疗的新策略.
引文著录: 刘亮明, 罗文, 刘晶美, 张吉翔. HBx在原发性肝癌发病中的作用及其生物治疗策略. 世界华人消化杂志 2005; 13(4): 432-439
Revised: December 21, 2004
Accepted: January 8, 2005
Published online: February 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 432-439
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/432.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.432
HBV的慢性感染与原发性肝细胞癌(HCC)的发生存在密切关系已为众多实验证实. 据估计全世界HBV携带者达总人口的6%, 而在病毒流行区, 有HBV感染史者已超过总人口的60%[1]. 全世界每年新增HCC病例超过400 000, 5年生存率小于3%[3]. 全球HCC病例的60%, 流行地区该病例的70%被认为是由HBV引起[2]. 已知HBV的基因组有4个开放阅读框(ORF), 分别编码HBsAg、HBcAg、DNAP和HBx.HBsAg被认为是影响HCC性别差异(HCC在男性多发)的因素[4], 而小分子多肽HBx则在HCC的形成中起主导作用. 转基因鼠实验证实, HBx的表达(1)能干扰正常肝细胞的生长, 使肝癌的发生率至少增加10倍[5]; (2)增加了促癌剂致肝癌的形成率[6]; (3)缩短了HCC发生的潜伏期[7]. 人群调查发现, 85% HCC患者的肝组织中含有特异性的HBx蛋白[8]. 这充分说明HBx在HBV相关性HCC的发生中起重要作用. 但HBx的致癌机制仍不是十分明确. HBx对重要的细胞过程如细胞生长、转化和细胞凋亡的影响仍存在不少争论. 然而, HBx作为一种致癌剂已渐为人们所认同. 因为HBx除对肝细胞的生长和凋亡通路产生影响外, 也影响到肝肿瘤细胞的迁移能力和新生血管的形成能力, 并对肝细胞DNA的修复产生不利影响. 随着HBx的致肝癌机制的深入研究, 对肝细胞生长、转化起重要作用的关键分子不断被发现, 这为HCC的治疗提供了新的靶点, 为肿瘤治疗新药的开发提供了新的戚机.
研究表明, HBx不仅出现于细胞质, 也见于细胞核内. 其作用方式并不是直接与DNA结合, 而是通过蛋白质-蛋白质作用, 反式激活(transactivate)宿主细胞和病毒基因的启动子, 对病毒基因启动子的激活有助于感染的持续和播散. 而HBx对宿主细胞基因的影响则要广泛而深刻得多.
HBx可激活众多的细胞癌基因, 如c-myc[9]、Src[10]、Ras[11]和Rb[12]等. HBx对这些癌基因的激活必将对肝细胞的生长、转化产生重要影响. 同时, 个别癌基因被激活后, 也将对其下游与细胞生长有密切关系的靶基因产生激活作用, 从而使其生物效应放大. 例如, Src酪氨酸激酶被HBx激活后, 可进一步影响下列信号和效应分子: (1)激活PI-3K[13]; (2)激活STATs[14]; (3)激活β-catenin[15]; (4)抑制cadherin的表达和功能[16].
HBx除对癌基因有激活作用外, 还对抑癌基因p53产生多环节的抑制作用: (1)通过蛋白质-蛋白质作用阻断p53的功能[17]; (2)强烈抑制p53的转录[18]; (3)HBx的羧基端可与p53的羧基端结合, 造成p53的胞质隐匿(cytoplasmic sequestration)[19]. 野生型和裂解变异的HBx蛋白均保留有抑制p53的能力[20].
p53被HBx抑制后可造成: (1)肝细胞的损伤DNA在G1期不经修复直接进入S期, 使DNA损伤累积增加; (2)HBx与p53的结合抑制了p53与DNA修复蛋白XPB、XPD的结合[21]. (3)下游靶基因PTEN[22]、p16[23]、p21cip1/wap1、Bax和Fas[24]等受抑. 其中p21cip1/wap1是细胞周期检查点的重要分子, 他能抑制各种Cyclin-CDK复合物而使细胞停滞于G1期.
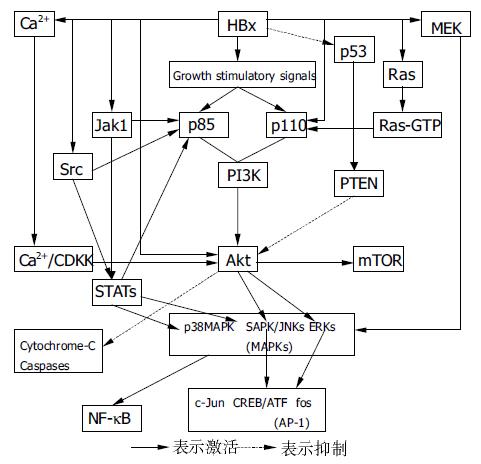
HBx可对肝细胞内多种信号级联通路产生多环节的刺激性影响, 如PI3K-Akt[25]、Jak1-STAT[26]、SAPK/JNK[27]、MAPK[11]、Wnt/β-catenin[15]等信号通路. 这些通路为HBx激活后又相互影响, 从而组成了一个极其复杂的信号分子网络, 使HBx的促细胞生长、转化效应可以逐级放大, 最终引起HCC的形成(图1).
该网络中起中心作用的信号通路是PI3K-Akt. 其中, Akt(又名PKB)是网络中最重要的枢纽分子之一. HBx可通过下列途径激活Akt: (1)HBx直接[25]或通过激活PI3K的p110亚基[28]逐级激活Akt; (2)受HBx激活的Src[10]、Ras[11]和Jak1-STATs[26]通过PI3K激活Akt; (3)HBx对p53的抑制作用, 使得PTEN抑制Akt的能力减弱[29]; (4)HBx可作用于线粒体Ca2+通道, 引起线粒体Ca2+外流和胞质Ca2+动员[30]. 胞质Ca2+的升高通过Ca2+/CDKK(calmodulin-dependent kinase kinase)作用方式, 直接使Akt的Thr308磷酸化而激活之[31].
Akt的活化将对下列分子产生重要影响: (1)激活MAPKs[32-33].MAPK家族由ERK1/2、SAPK/JNK和p38MAPK组成. HBx除通过提高MEK的表达来激活MAPKs外, 活化的Akt也对ERK1/2和SAPK/JNK存在重要的刺激作用. MAPKs是肝细胞生存和增生中极其重要的分子, 他起着整合细胞内信号诱导通路的信息, 并将胞质信号与基因表达程序偶联在一起的作用. 其对肝细胞的影响有: (a)加快肝细胞进入S期[34]; (b)促进肝细胞转化[27]; (c)促进肝癌细胞的转移[32]; (d)促进HIF-1α的转录[35]; (e)激活NF-κB和AP-1[32]. (2)激活AP-1[32-33].AP-1家族有c-Jun、fos和CREB/ATF三个成员. Akt对ERK1/2和SAPK/JNK的激活, 可进一步使AP-1激活. AP-1是重要的转录因子, 他调控着细胞内许多基因的表达, 对细胞间信息的交换、细胞的增生以及原始病理信号的传播都有重要影响. 同时, AP-1还能启动和加速肿瘤的形成, 并促进HCC细胞的迁移和转移能力[32]. (3)激活mTOR[36].mTOR是一种丝/苏氨酸激酶, 对细胞内蛋白质的翻译起重要的调控作用. 其活性的增强有助于促进mRNA的翻译. (4)抑制caspase-3、-9的表达和线粒体cytochrome-C的释放, 从而抑制了肝细胞的凋亡[25,37-38].
在核内, NF-κB作为DNA结合蛋白与相应靶基因的启动子结合, 促进靶基因的转录表达, 从而调控着细胞内许多生物反应过程. 这包括参与细胞周期的调控[39]. 乙肝病毒HBx蛋白对NF-κB有明显的激活作用, 他能活化NF-κB家族的所有5个成员, 包括RelA(p65)、c-Rel、p52、p50和p105[40]. 另外, HBx还能抑制内源性I-kBmRNA的表达[41], 从而减小I-κB对NF-κB的抑制作用.
NF-κB的活化对肝细胞存在两方面的影响: (1)抑制细胞凋亡, 促进肝细胞存活. NF-κB可抑制下列细胞凋亡通路: (a)Fas杀伤(Fas killing)作用[41]; (b)TNF-α诱导的肝细胞凋亡[42]; (c)TGF-β1诱导的肝细胞凋亡[43]. 最近的研究提示[44], HBx可通过使肝癌细胞上调TGF-β1及下调a2-巨球蛋白的表达而促进TGF-β1的活性. TGF-β1是众所周知的正常肝细胞的凋亡因子, 但TGF-β1在HCC细胞的表达却促进肿瘤细胞自身的增生、转移和侵袭能力[45]; (2)促进肝癌细胞的侵袭能力. NF-κB通过激活uPA促进HCC细胞的转移[46].
肿瘤细胞的侵袭和转移特性与多种因素有关. 其中细胞外基质(ECM)的降解和细胞表面黏附分子的改变是最重要的原因. HBx可以通过下列途径促进HCC细胞的侵袭能力: (1)促进基质金属蛋白酶(matrix metalloproteinase, MMPs)的表达: ECM的降解是肿瘤转移的关键性步骤, 而MMPs在ECM的降解中起重要作用. 实验证实, HBx可使MT1-MMP[47]、MMP-2[48]和MMP-9[32]表达上调, 促进了HCC的侵袭和转移. (2)使尿激酶血纤维蛋白溶解酶原激活物(uPA)表达上调[46]: uPA是NF-κB的下游靶基因, 他可降解ECM中的纤维蛋白, 与肿瘤细胞的侵袭和转移能力密切相关. HBx可激活NF-κB而使uPA的表达上调. (3)抑制integrins的表达[49]: HBx抑制了integrin a5和b1亚基的表达, 使肝细胞对纤维连结蛋白(fibronectin)的黏附能力降低, 打破了细胞的黏附-去黏附平衡(adhesion-deadhesion balance), 使细胞易于迁移. (4)抑制cadherin的功能[16]: cadherin是一种黏附分子. cadherin依赖的黏附有助于防止细胞的迁移和侵袭表型. 因为肌动蛋白细胞骨架与caderin复合物之间的联系是细胞间维持黏附性的基础. 然而在HBx存在的情况下, 这种联系可被破坏. (5)诱导CD44的表达: CD44是透明质酸受体, 也是一种黏附分子. 其表达并在细胞表面聚集可引起细胞伪足形成和细胞骨架的重排. Lara-Pezzi et al[50]的实验证实, HBx诱导了CD44的表达, 从而使HCC细胞的运动能力增强.
HBx不仅能促进肝细胞生长, 并抑制其凋亡, 而且最近有实验提示HBx还具有细胞前凋亡活性, 即引起肝细胞的凋亡[51-52].Kim et al[53]研究表明, 全序列HBx的表达增加了细胞对凋亡诱导者TNF-α和抗-Fas抗体的敏感性, 使细胞内caspase-8和caspase-3水平升高, 同时使c-FLIP的凋亡抑制功能失活. 已证实在病毒复制期间, 病毒全序列基因的转录完成需到达HBx ORF poly(A)信号的下游才能实现, 即第1 789位的UAUAAA模体(motif)处. 但已在染色体整合的DNA通常并不出现全序列的转录. 这使HBx频繁出现3'端区段裂解(truncation).Gao et al[54]也证实HBV DNA主要以不完整的DNA片段整合入染色体, HBx的整合最重要, 单纯游离而不整合的HBx在HCC患者所占比例很小. Tu et al[55]的实验表明, 全序列的HBx能抑制ras和myc诱导的病灶形成, 而裂解形式的HBx则使其转化能力增强.
现在认为, HBx的前凋亡活性不仅有利于HBV感染的建立和复制的完成, 而且在HCC的形成和发展中也起重要作用: (1)引起肝细胞损伤、死亡并诱导肝细胞再生, 最终发展为HCC[56]; (2)对肝细胞的增生产生旁分泌抑制效应[57]. 这有利于增生性和凋亡抵抗性细胞的出现; (3)促进肿瘤细胞的免疫逃逸. HBx可通过使Egr活性增强而显著激活T细胞FasL的启动子, 进一步使含有Fas的T细胞凋亡[58]. 除有功能的T细胞凋亡外, HBx抗原的T细胞和B细胞抗原决定簇可频繁出现变异, 从而逃避其免疫攻击[59]. 另外, HBx的表达可诱导Nur77的活性[60], 而Nur77在FasL的表达中起重要作用, 这将进一步清除表达Fas的淋巴细胞.
HBx的致癌作用须与环境因素协同, 单纯HBx在肝细胞的表达并不显著增加DNA的变异率(mutation frequency, MF)[61], 但他可使黄曲霉毒素B1(AFB1)、UV射线和DEN引起的DNA损伤累积. 即HBx抑制了损伤DNA的修复. Madden et al[62]证实, HBx的表达使肝细胞DNA的总体变异率仅增加24%, 而在AFB1处理后, G/C T/A的转换率升高达将近2倍.
损伤DNA的修复既有不依赖p53的转录偶联修复(transcription-coupled repair)[63], 也有依赖p53的球形(global)核苷切除修复(nucleotide excision repair, NER). 在暴露于UV射线或AFB1的情况下, HBx对NER的抑制与抑制NER的组份即损伤DNA结合蛋白(damaged DNA-binding protein, DDB)有关. 在核内, DDB的两个亚基DDB1、DDB2组成的复合物结合损伤的DNA, 并进一步激活NER[64].HBx能与DDB1结合, 对损伤DNA修复产生不良影响[65]. 直接与DNA修复有关的蛋白质为转录修复因子TFⅡH.
TFⅡH中最重要的两个亚基是XPB和XPD.XPB和XPD在NER期间分别有3'-5'和5'-3'ATP依赖的螺旋酶活性. 这种双向的螺旋酶活性, 在切开损伤的DNA链前具有解开损伤周围DNA双螺旋的作用[66].HBx可抑制XPB和XPD的内源性表达. HBx通过结合转录因子SP1, 减弱了SP1对XPB、XPD启动子的激活作用, 从而引起了XPB、XPD转录下降[67].
肿瘤的发生经历最初的快速增长和随后由于氧和营养物质缺乏的缓慢生长阶段. 如果仍得不到氧和营养物质的供应, 肿瘤将趋向死亡. 但在活体内, 这种情况常不会自然发生. 因为肿瘤细胞能通过各种机制适应缺氧的应激(hypoxic stress). 其中最重要的适应机制是肿瘤细胞分泌血管内皮生长因子(VEGF). 已知VEGF是肿瘤新生血管形成的中心调控者, 他能诱导内皮细胞的增生和迁移, 是肿瘤细胞获得氧和营养物质的基础. 在HCC, HBx可加强肿瘤细胞的这种适应过程. Tao et al[68]的实验发现, HBx蛋白可激活HCC细胞VEGF的表达.
VEGF受缺氧诱导因子1(hypoxia-inducible factor1, HIF-1)的调控. HBx对HIF-1最重要的亚基HIF-1α存在多方面的影响: (1)增强HIF-1α蛋白质稳定性以及与CBP/p300的联系, 从而使其对VEGF的作用得以加强[35]; (2)激活MAPK, 促进HIF-1α的转录[35]; (3)削弱了von Hippel-Lindau(VHL)对HIF-1α的抑制作用[35]; (4)激活PI3K、mTOR, 增强了HIF-1α蛋白的稳定性和功能[69].
鉴于HBx对核内基因有着广泛的影响, 且有多方面的致癌活性, 许多研究者期望通过抑制或清除HBx的方式来达到治疗HCC的目的. (1)过继免疫治疗: 体液免疫对HBx并不起明显的清除作用, 且抗-HBx抗体在HBV相关性HCC患者血清中出现率很低[70]. 细胞免疫在病毒HBx蛋白的清除中起主要作用. 但由于HBx抗原决定簇的变异, 自身的T、B细胞往往不能对其起到免疫监视和细胞毒作用. 于是, Chun et al[71]采用HBx特异性CTLs进行过继免疫治疗. 他们发现, 当HBx52-60氨基酸特异性CTL克隆LC-46细胞被过继注入荷瘤(HBx相关性HCC)祼鼠体内后, 肿瘤逐渐消失. 这充分说明, HBx的清除在HCC的治疗中的重要性. (2)核酶的应用: 过继免疫可以清除HBx蛋白, 锤头型核酶则可通过其剪切作用破坏HBx mRNA, 从而减少HBx的表达. Kim et al[72]设计了两种锤头型核酶RzA和RzB, 他们分别剪切HBx ORF靶位点核苷酸114和309. 他们在体外的剪切率分别为52%和75%, 使HBx mRNA表达水平分别降低40%和57%.同时HBx的反式激活活性也被显著抑制. Weinberg et al[73]也证实核酶表达载体能抑制HBx mRNA和功能蛋白的表达, 并抑制了HBV的复制. (3)RNA干涉(RNAi): RNAi的目的是通过双链RNA来诱导目的基因的沉寂. 近年来已迅速成为阻断基因活性的标准实验技术. 小干涉RNA(small interfering RNA, siRNA)由约20个碱基对组成, 可使特定的RNA降解. siRNA在RNA沉寂中扮演中心角色. Hung et al[74]构建了针对HBx ORF的小发夹RNA(shRNA)表达载体, 这种重组体在COS-1细胞中的表达抑制了HBx表达, 且呈现剂量依赖的抑制效应, 同时其同源基因的反式激活作用也被阻断.
虽然HBx在HCC的发生发展中起重要作用, 但单纯清除HBx有时并不能达到对HCC治疗的目的, 特别是对进展期HCC, 效果可能不很理想. 因为转化肝细胞的癌变过程一旦启动, 其后续过程并不完全依赖于HBx的表达, 而是表现为多种信号级联反应. 在这些级联反应中起关键作用的分子已成为我们治疗HCC的靶点. 目前研究的热点是针对靶分子mTOR的抑制剂rapamycin及其衍生物, 其他关键分子的抑制剂尚处于实验研究阶段.
rapamycin是一种链霉菌的衍生物, 因其能直接抑制T、B淋巴细胞的增生[75], 最初被广泛用于器官移植受者的免疫抑制治疗. 后来发现, rapamycin可阻断丝/苏氨酸激酶-mTOR的活性, 对肿瘤细胞的细胞周期进程起抑制作用, 使细胞停滞于G1期, 并能诱导肿瘤细胞的凋亡[76-77]. 所以近来rapamycin已被当作一种前景光明的新抗癌剂[78]. 这在HCC患者的治疗中显得尤为重要[79], 因为对这种患者, 肝移植是唯一有望治愈肿瘤的方法. 手术后单纯慢性免疫抑制药物的使用, 不仅可能引起HCC复发, 而且可能引发其他实体性和血液系恶性病变. 因此, 在解决器官移植后恶性疾病发生和复发方面, rapamycin有着明显的优势. 然而实际工作中, 大多数肿瘤患者并不适于器官移植, 于是近年合成了无免疫抑制作用的rapamycin衍生物CCI-779. 在临床前动物模型中, mTOR抑制剂抑制了肿瘤的生长, 并诱导了肿瘤细胞的凋亡[80]. 随后的Ⅰ期和Ⅱ期临床试验[81-82]证实CCI-779有明显的抗肿瘤活性. Raymond et al[81]实验提示CCI-779无免疫抑制效应, 患者有很好的耐受性.
其他的网络分子抑制剂有: PI3K抑制剂wortmanin和ERK抑制剂U0126能使HBx相关性HCC细胞MMP-9的转录下降, 从而抑制了肿瘤的侵袭能力[32]; 胞质Ca2+抑制剂BAPTA-AM和线粒体Ca2+通道阻滞剂cyclosprine A可使Chang细胞HBx诱导的AP-1反式激活作用受抑[30]; 其他如SB203580和SB202190可阻断p38MAPK活性, PD98059阻断MEK而三羟异黄酮和herbimycin A则能抑制酪氨酸激酶的活性. 然而这些抑制剂仍仅限于在实验中作为定点阻断某个信号分子的研究工具. 由于其毒性较大, 并不能用于临床研究. 所以开发针对这些信号分子起抑制作用的低毒化合物是非常必要而且是切实可行的.
可通过下列方法来达到抑制癌基因的目的 (1)使癌基因沉默: 可采用反义基因、siRNA和显性负变异体等方法沉默癌基因. 如Wang et al[95]应用myc反义基因使两个HCC细胞系myc蛋白的水平减少95%和80%, 软琼脂集落形成能力减少92%和88%, 裸鼠接种后肿瘤形成困难. Hung et al[74]利用siRNA使c-myc的表达水平出现剂量依赖的特异性抑制效应, 且能与HBx的siRNA作用累加; (2)癌基因产物抑制剂: 该抑制剂有抑制HCC细胞进一步增生和诱导细胞凋亡的作用. Shih et al[13]证实, Src家族激酶抑制剂PP2和Csk(c-terminal Src kinase)能减轻HBx介导的PI3K活性, 增加细胞对TGF-β1诱导凋亡的敏感性.
单纯封闭癌基因有时并不能达到治疗肿瘤的目的, 所以近年加强了抑癌基因治疗肿瘤的研究. 其中研究最多、应用最广的抑癌基因当属p53.p53虽然在某些肿瘤特别是肺癌治疗中取得了令人鼓舞的效果, 但对HCC的疗效却乏善可陈. 原因之一就是HCC患者体内的HBx可结合p53的羧基端而使之失活. 最近发现的p53家族的新成员p73, 其氨基酸序列与p53高度同源, 也能激活p53下游靶基因, 如p21cip1/wap1、PTEN等, 且其激活作用较p53要强烈. p73的另一个优势就是其羧基端与p53不同源[83], 这使得HBx不能与p73结合而抑制其活性. 因此, 在HCC的治疗方面, p73有更大的优势. 作者所在实验室目前正致力于p73的研究, 现已成功克隆出人p73全长序列p73α亚型, 我们期望其能在HCC的治疗中一展身手.
肿瘤细胞凋亡是抗癌治疗有效反应的主要指标, 对凋亡的抵抗是肿瘤治疗失效的重要机制. 无论是放、化疗、还是抗肿瘤细胞因子如TNF-α的使用, 均可能激活凋亡抑制因子NF-κB, 从而引起肿瘤细胞对传统内科治疗方法失敏感. 因此, 抑制NF-κB的活性在肿瘤的治疗特别是药物抵抗性肿瘤的治疗中占有重要地位.
下列方法可抑制NF-κB的活性, 并可用于HCC的治疗: (1)特异性抑制物I-kB的应用: Wang et al[84]用腺病毒作载体将I-kBa导入肿瘤细胞内. 由于NF-κB的抑制, 使化学抵抗性(chemoresistant)肿瘤变得对凋亡敏感, 在应用化疗药CPT-11和TNF-α后, 肿瘤迅速消退; (2)化学合成抑制剂: sulindac能阻断NF-κB通路并增强TNF-α介导的肿瘤细胞凋亡. Sulindac与TNF-α的联用可显著地抑制肿瘤的生长[85].pentoxifylline(PTX)和N-乙酰-L-半胱氨酸(NAC)也能抑制NF-κB的活性, 虽然其单独应用并不能对HCC的发生和分化过程产生有效影响, 但却能显著抑制大鼠HCC的肺转移[86]; (3)天然产物: 某些天然产物具有化学治疗活性, 可抑制NF-κB的作用. 这些物质有: apigenin、epigallocatechin-3-gallate、curcumin、inoditol hexaphosphate、PC-SPES、selenium、zinc、genistein、silibinin和indole-3-carbinol等. 其中, silibinin在浓度低至10 mmol/L时就能抑制NF-κB的活性[87], 经口服后对人肝脏疾病有明显的治疗效应[88], 并能减轻裸鼠负荷肿瘤的生长[89].
HCC是高度恶性的肿瘤, 其倍增时间极短. 为维持肿瘤细胞极快的生长速率, 必须有不断新生的血管为其提供丰富的氧和营养物质. HCC患者VEGF的超高表达为肿瘤新生血管的形成提供了物质基础. 研究表明, 测定患者血清VEGF的水平能准确预测HCC的侵袭能力和预后[90]. 所以, 抑制HCC细胞VEGF的分泌及其功能, 将有重要的现实意义. 以往的体内实验提示(1)抗-VEGF抗体[91], (2)显性负变异(dominant negative)VEGF受体的表达[92]和(3)反义VEGF基因[93]能明显地抑制肿瘤的生长. 作者所在实验室曾利用反义寡核苷酸(ASODN)来抑制HCC细胞VEGF的表达, 发现与VEGFmRNA帽子部位结合的ASODN抑制效果最好, 其次为与翻译起始部位结合的ASODN[94]. 目前正在进行裸鼠成瘤实验.
目前我们已经成功克隆了人类XPB和XPD基因, 并已转染入人HCC细胞, 试验结果令人鼓舞.
实际上, 肿瘤的形成不可能是由某个基因在短期内完成的, 他是一个影响多个基因(包括癌基因和抑癌基因)的多步骤、多环节的慢性变异过程. 所以, 仅靠封闭某个癌基因或导入某一个抑癌基因, 在多数情况下并不能解决根本问题. 于是我们开始考虑利用联合基因的方法来治疗HCC. 迄今, 我们已设计并构建p53, p16和XPB, XPD融合基因, 不久将可用于HCC细胞的处理.
HBx对肝细胞内众多基因存在不同程度的影响. 细胞内大多数已知的癌基因均可被HBx激活, 而抑癌基因如p53则受到HBx的强烈抑制. 按常理推论, HBx应该是强致癌剂. 但令人疑惑的是, HBx的致癌活性并不高, 其致癌性需要有环境因素的协同才能实现. 在这一点上似乎HBx的前凋亡活性在起作用. 然而在细胞水平的实验中这种情形并没有发现. 由于实验者使用的细胞类型和表达系统的不同, 出现的实验结果有时截然相反. 即在某些细胞系或表达系统中HBx促进细胞生长, 而在另一些细胞系或表达系统中则表现为细胞凋亡作用. 因为缺乏研究资料, HBx在活体内特别是人体内的情形目前还不清楚. 但我们完全有理由作出猜测, 即游离的全长序列HBx的前凋亡活性与整合后变异的HBx的促生长作用可能达到某种平衡状态, 使细胞趋于稳定. 当这种平衡状态被外界环境或内部因素打破, 甚或HBx的前凋亡活性与促生长作用协同之后, 可能引起肿瘤形成. 目前对HBx相关性HCC生物治疗的研究才刚刚起步, 随着HBx致癌机制研究的不断深入, HCC的治疗将会有一个重大的突破. 我们目前要做的事情是找到一个使治疗真正有效的方法作为切入点, 进行深入的研究. 我们相信对HCC治疗的研究也将会对其他肿瘤的治疗提供信息和借鉴.
编辑: 张海宁
| 1. | Mahoney FJ. Update on diagnosis, management, and prevention of hepatitis B virus infection. Clin Microbiol Rev. 1999;12:351-366. [PubMed] |
| 2. | Stuver SO. Towards global control of liver cancer? Semin Cancer Biol. 1998;8:299-306. [PubMed] [DOI] |
| 3. | Parkin DM. The global burden of cancer. Semin Cancer Biol. 1998;8:219-235. [PubMed] [DOI] |
| 4. | Wang Y, Cui F, Lv Y, Li C, Xu X, Deng C, Wang D, Sun Y, Hu G, Lang Z. HBsAg and HBx knocked into the p21 locus causes hepatocellular carcinoma in mice. Hepatology. 2004;39:318-324. [PubMed] [DOI] |
| 5. | Koike K, Moriya K, Iino S, Yotsuyanagi H, Endo Y, Miyamura T, Kurokawa K. High-level expression of hepatitis B virus HBx gene and hepatocarcinogenesis in transgenic mice. Hepatology. 1994;19:810-819. [PubMed] [DOI] |
| 6. | Slagle BL, Lee TH, Medina D, Finegold MJ, Butel JS. Increased sensitivity to the hepatocarcinogen diethylnitrosamine in transgenic mice carrying the hepatitis B virus X gene. Mol Carcinog. 1996;15:261-269. [PubMed] [DOI] |
| 7. | Terradillos O, Billet O, Renard CA, Levy R, Molina T, Briand P, Buendia MA. The hepatitis B virus X gene potentiates c-myc-induced liver oncogenesis in transgenic mice. Oncogene. 1997;14:395-404. [PubMed] [DOI] |
| 8. | Hwang GY, Lin CY, Huang LM, Wang YH, Wang JC, Hsu CT, Yang SS, Wu CC. Detection of the hepatitis B virus X protein (HBx) antigen and anti-HBx antibodies in cases of human hepatocellular carcinoma. J Clin Microbiol. 2003;41:5598-5603. [PubMed] [DOI] |
| 9. | Balsano C, Avantaggiati ML, Natoli G, De Marzio E, Will H, Perricaudet M, Levrero M. Full-length and truncated versions of the hepatitis B virus (HBV) X protein (pX) transactivate the cmyc protooncogene at the transcriptional level. Biochem Biophys Res Commun. 1991;176:985-992. [PubMed] [DOI] |
| 10. | Klein NP, Schneider RJ. Activation of Src family kinases by hepatitis B virus HBx protein and coupled signaling to Ras. Mol Cell Biol. 1997;17:6427-6436. [PubMed] [DOI] |
| 11. | Benn J, Schneider RJ. Hepatitis B virus HBx protein activates Ras-GTP complex formation and establishes a Ras, Raf, MAP kinase signaling cascade. Proc Natl Acad Sci USA. 1994;91:10350-10354. [PubMed] [DOI] |
| 12. | Farshid M, Nedjar S, Mitchell F, Biswas R. Effect of hepatitis B virus X protein on the expression of retinoblastoma gene product. Acta Virol. 1997;41:125-129. [PubMed] |
| 13. | Shih WL, Kuo ML, Chuang SE, Cheng AL, Doong SL. Hepatitis B virus X protein activates a survival signaling by linking SRC to phosphatidylinositol 3-kinase. J Biol Chem. 2003;278:31807-31813. [PubMed] [DOI] |
| 14. | Danial NN, Pernis A, Rothman PB. Jak-STAT signaling induced by the v-abl oncogene. Science. 1995;269:1875-1877. [PubMed] [DOI] |
| 15. | Cha MY, Kim CM, Park YM, Ryu WS. Hepatitis B virus X protein is essential for the activation of Wnt/beta-catenin signaling in hepatoma cells. Hepatology. 2004;39:1683-1693. [PubMed] [DOI] |
| 16. | Lara-Pezzi E, Roche S, Andrisani OM, Sánchez-Madrid F, López-Cabrera M. The hepatitis B virus HBx protein induces adherens junction disruption in a src-dependent manner. Oncogene. 2001;20:3323-3331. [PubMed] [DOI] |
| 17. | Wang XW, Forrester K, Yeh H, Feitelson MA, Gu JR, Harris CC. Hepatitis B virus X protein inhibits p53 sequence-specific DNA binding, transcriptional activity, and association with transcription factor ERCC3. Proc Natl Acad Sci USA. 1994;91:2230-2234. [PubMed] [DOI] |
| 18. | Lee SG, Rho HM. Transcriptional repression of the human p53 gene by hepatitis B viral X protein. Oncogene. 2000;19:468-471. [PubMed] [DOI] |
| 19. | Elmore LW, Hancock AR, Chang SF, Wang XW, Chang S, Callahan CP, Geller DA, Will H, Harris CC. Hepatitis B virusx protein and p53 tumor suppressor interactions in the modulation of apoptosis. PNAS. 1997;94:14707-14712. [PubMed] [DOI] |
| 20. | Huo TI, Wang XW, Forgues M, Wu CG, Spillare EA, Giannini C, Brechot C, Harris CC. Hepatitis B virus X mutants derived from human hepatocellular carcinoma retain the ability to abrogate p53-induced apoptosis. Oncogene. 2001;20:3620-3628. [PubMed] [DOI] |
| 21. | Wang XW, Vermeulen W, Coursen JD, Gibson M, Lupold SE, Forrester K, Xu G, Elmore L, Yeh H, Hoeijmakers JH. The XPB and XPD DNA helicases are components of the p53-mediated apoptosis pathway. Genes Dev. 1996;10:1219-1232. [PubMed] [DOI] |
| 22. | Chung TW, Lee YC, Ko JH, Kim CH. Hepatitis B Virus X protein modulates the expression of PTEN by inhibiting the function of p53, a transcriptional activator in liver cells. Cancer Res. 2003;63:3453-3458. [PubMed] |
| 23. | Ueda H, Ullrich SJ, Gangemi JD, Kappel CA, Ngo L, Feitelson MA, Jay G. Functional inactivation but not structural mutation of p53 causes liver cancer. Nat Genet. 1995;9:41-47. [PubMed] [DOI] |
| 24. | Wang XW, Gibson MK, Vermeulen W, Yeh H, Forrester K, Stürzbecher HW, Hoeijmakers JH, Harris CC. Abrogation of p53-induced apoptosis by the hepatitis B virus X gene. Cancer Res. 1995;55:6012-6016. [PubMed] |
| 25. | Lee YI, Kang-Park S, Do SI, Lee YI. The hepatitis B virus-X protein activates a phosphatidylinositol 3-kinase-dependent survival signaling cascade. J Biol Chem. 2001;276:16969-16977. [PubMed] [DOI] |
| 26. | Lee YH, Yun Y. HBx protein of hepatitis B virus activates Jak1-STAT signaling. J Biol Chem. 1998;273:25510-25515. [PubMed] [DOI] |
| 27. | Tarn C, Lee S, Hu Y, Ashendel C, Andrisani OM. Hepatitis B virus X protein differentially activates RAS-RAF-MAPK and JNK pathways in X-transforming versus non-transforming AML12 hepatocytes. J Biol Chem. 2001;276:34671-34680. [PubMed] [DOI] |
| 28. | Shih WL, Kuo ML, Chuang SE, Cheng AL, Doong SL. Hepatitis B virus X protein inhibits transforming growth factor-beta -induced apoptosis through the activation of phosphatidylinositol 3-kinase pathway. J Biol Chem. 2000;275:25858-25864. [PubMed] [DOI] |
| 29. | Sansal I, Sellers WR. The biology and clinical relevance of the PTEN tumor suppressor pathway. J Clin Oncol. 2004;22:2954-2963. [PubMed] [DOI] |
| 30. | Oh JC, Jeong DL, Kim IK, Oh SH. Activation of calcium signaling by hepatitis B virus-X protein in liver cells. Exp Mol Med. 2003;35:301-309. [PubMed] [DOI] |
| 31. | Chen BC, Wu WT, Ho FM, Lin WW. Inhibition of interleukin-1beta -induced NF-kappa B activation by calcium/calmodulin-dependent protein kinase kinase occurs through Akt activation associated with interleukin-1 receptor-associated kinase phosphorylation and uncoupling of MyD88. J Biol Chem. 2002;277:24169-24179. [PubMed] [DOI] |
| 32. | Chung TW, Lee YC, Kim CH. Hepatitis B viral HBx induces matrix metalloproteinase-9 gene expression through activation of ERK and PI-3K/AKT pathways: involvement of invasive potential. FASEB J. 2004;18:1123-1125. [PubMed] |
| 33. | Li J, Chen H, Tang MS, Shi X, Amin S, Desai D, Costa M, Huang C. PI-3K and Akt are mediators of AP-1 induction by 5-MCDE in mouse epidermal Cl41 cells. J Cell Biol. 2004;165:77-86. [PubMed] [DOI] |
| 34. | Benn J, Schneider RJ. Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls. Proc Natl Acad Sci USA. 1995;92:11215-11219. [PubMed] |
| 35. | Yoo YG, Oh SH, Park ES, Cho H, Lee N, Park H, Kim DK, Yu DY, Seong JK, Lee MO. Hepatitis B virus X protein enhances transcriptional activity of hypoxia-inducible factor-1alpha through activation of mitogen-activated protein kinase pathway. J Biol Chem. 2003;278:39076-39084. [PubMed] [DOI] |
| 36. | Scheid MP, Woodgett JR. PKB/AKT: functional insights from genetic models. Nat Rev Mol Cell Biol. 2001;2:760-768. [PubMed] [DOI] |
| 37. | Kennedy SG, Kandel ES, Cross TK, Hay N. Akt/Protein kinase B inhibits cell death by preventing the release of cytochrome c from mitochondria. Mol Cell Biol. 1999;19:5800-5810. [PubMed] [DOI] |
| 38. | Fujita E, Jinbo A, Matuzaki H, Konishi H, Kikkawa U, Momoi T. Akt phosphorylation site found in human caspase-9 is absent in mouse caspase-9. Biochem Biophys Res Commun. 1999;264:550-555. [PubMed] [DOI] |
| 40. | Weil R, Sirma H, Giannini C, Kremsdorf D, Bessia C, Dargemont C, Bréchot C, Israël A. Direct association and nuclear import of the hepatitis B virus X protein with the NF-kappaB inhibitor IkappaBalpha. Mol Cell Biol. 1999;19:6345-6354. [PubMed] [DOI] |
| 41. | Pan J, Duan LX, Sun BS, Feitelson MA. Hepatitis B virus X protein protects against anti-Fas-mediated apoptosis in human liver cells by inducing NF-kappa B. J Gen Virol. 2001;82:171-182. [PubMed] [DOI] |
| 42. | Beg AA, Baltimore D. An essential role for NF-kappaB in preventing TNF-αlpha-induced cell death. Science. 1996;274:782-784. [PubMed] [DOI] |
| 43. | Bellas RE, FitzGerald MJ, Fausto N, Sonenshein GE. Inhibition of NF-kappa B activity induces apoptosis in murine hepatocytes. Am J Pathol. 1997;151:891-896. [PubMed] |
| 44. | Pan J, Clayton M, Feitelson MA. Hepatitis B virus X antigen promotes transforming growth factor-beta1 (TGF-βeta1) activity by up-regulation of TGF-βeta1 and down-regulation of alpha2-macroglobulin. J Gen Virol. 2004;85:275-282. [PubMed] [DOI] |
| 46. | Chan CF, Yau TO, Jin DY, Wong CM, Fan ST, Ng IO. Evaluation of nuclear factor-kappaB, urokinase-type plasminogen activator, and HBx and their clinicopathological significance in hepatocellular carcinoma. Clin Cancer Res. 2004;10:4140-4149. [PubMed] [DOI] |
| 47. | Lara-Pezzi E, Gómez-Gaviro MV, Gálvez BG, Mira E, Iñiguez MA, Fresno M, Martínez-A C, Arroyo AG, López-Cabrera M. The hepatitis B virus X protein promotes tumor cell invasion by inducing membrane-type matrix metalloproteinase-1 and cyclooxygenase-2 expression. J Clin Invest. 2002;110:1831-1838. [PubMed] [DOI] |
| 48. | Werb Z. ECM and cell surface proteolysis: regulating cellular ecology. Cell. 1997;91:439-442. [PubMed] [DOI] |
| 49. | Lara-Pezzi E, Majano PL, Yáñez-Mó M, Gómez-Gonzalo M, Carretero M, Moreno-Otero R, Sánchez-Madrid F, López-Cabrera M. Effect of the hepatitis B virus HBx protein on integrin-mediated adhesion to and migration on extracellular matrix. J Hepatol. 2001;34:409-415. [PubMed] [DOI] |
| 50. | Lara-Pezzi E, Serrador JM, Montoya MC, Zamora D, Yáñez-Mó M, Carretero M, Furthmayr H, Sánchez-Madrid F, López-Cabrera M. The hepatitis B virus X protein (HBx) induces a migratory phenotype in a CD44-dependent manner: possible role of HBx in invasion and metastasis. Hepatology. 2001;33:1270-1281. [PubMed] [DOI] |
| 51. | Shintani Y, Yotsuyanagi H, Moriya K, Fujie H, Tsutsumi T, Kanegae Y, Kimura S, Saito I, Koike K. Induction of apoptosis after switch-on of the hepatitis B virus X gene mediated by the Cre/loxP recombination system. J Gen Virol. 1999;80:3257-3265. [PubMed] [DOI] |
| 52. | Kim H, Lee H, Yun Y. X-gene product of hepatitis B virus induces apoptosis in liver cells. J Biol Chem. 1998;273:381-385. [PubMed] [DOI] |
| 53. | Kim KH, Seong BL. Pro-apoptotic function of HBV X protein is mediated by interaction with c-FLIP and enhancement of death-inducing signal. EMBO J. 2003;22:2104-2116. [PubMed] [DOI] |
| 54. | Gao FG, Sun WS, Cao YL, Zhang LN, Song J, Li HF, Yan SK. HBx-DNA probe preparation and its application in study of hepatocarcinogenesis. World J Gastroenterol. 1998;4:320-322. [PubMed] [DOI] |
| 55. | Tu H, Bonura C, Giannini C, Mouly H, Soussan P, Kew M, Paterlini-Bréchot P, Bréchot C, Kremsdorf D. Biological impact of natural COOH-terminal deletions of hepatitis B virus X protein in hepatocellular carcinoma tissues. Cancer Res. 2001;61:7803-7810. [PubMed] |
| 56. | Chisari FV, Klopchin K, Moriyama T, Pasquinelli C, Dunsford HA, Sell S, Pinkert CA, Brinster RL, Palmiter RD. Molecular pathogenesis of hepatocellular carcinoma in hepatitis B virus transgenic mice. Cell. 1989;59:1145-1156. [PubMed] [DOI] |
| 57. | Tralhao JG, Roudier J, Morosan S, Giannini C, Tu H, Goulenok C, Carnot F, Zavala F, Joulin V, Kremsdorf D. Paracrine in vivo inhibitory effects of hepatitis B virus X protein (HBx) on liver cell proliferation: an alternative mechanism of HBx-related pathogenesis. Proc Natl Acad Sci USA. 2002;99:6991-6996. [PubMed] [DOI] |
| 58. | Yoo YG, Lee MO. Hepatitis B virus X protein induces expression of Fas ligand gene through enhancing transcriptional activity of early growth response factor. J Biol Chem. 2004;279:36242-36249. [PubMed] [DOI] |
| 59. | Hwang GY, Huang CJ, Lin CY, Wu CC. Dominant mutations of hepatitis B virus variants in hepatoma accumulate in B-cell and T-cell epitopes of the HBx antigen. Virus Res. 2003;92:157-164. [PubMed] [DOI] |
| 60. | Lee MO, Kang HJ, Cho H, Shin EC, Park JH, Kim SJ. Hepatitis B virus X protein induced expression of the Nur77 gene. Biochem Biophys Res Commun. 2001;288:1162-1168. [PubMed] [DOI] |
| 61. | Madden CR, Finegold MJ, Slagle BL. Hepatitis B virus X protein acts as a tumor promoter in development of diethylnitrosamine-induced preneoplastic lesions. J Virol. 2001;75:3851-3858. [PubMed] [DOI] |
| 62. | Madden CR, Finegold MJ, Slagle BL. Altered DNA mutation spectrum in aflatoxin b1-treated transgenic mice that express the hepatitis B virus x protein. J Virol. 2002;76:11770-11774. [PubMed] [DOI] |
| 63. | Prost S, Ford JM, Taylor C, Doig J, Harrison DJ. Hepatitis B x protein inhibits p53-dependent DNA repair in primary mouse hepatocytes. J Biol Chem. 1998;273:33327-33332. [PubMed] [DOI] |
| 64. | Wakasugi M, Kawashima A, Morioka H, Linn S, Sancar A, Mori T, Nikaido O, Matsunaga T. DDB accumulates at DNA damage sites immediately after UV irradiation and directly stimulates nucleotide excision repair. J Biol Chem. 2002;277:1637-1640. [PubMed] [DOI] |
| 65. | Leupin O, Bontron S, Strubin M. Hepatitis B virus X protein and simian virus 5 V protein exhibit similar UV-DDB1 binding properties to mediate distinct activities. J Virol. 2003;77:6274-6283. [PubMed] [DOI] |
| 66. | Marinoni JC, Roy R, Vermeulen W, Miniou P, Lutz Y, Weeda G, Seroz T, Gomez DM, Hoeijmakers JH, Egly JM. Cloning and characterization of p52, the fifth subunit of the core of the transcription/DNA repair factor TFIIH. EMBO J. 1997;16:1093-1102. [PubMed] [DOI] |
| 67. | Jaitovich-Groisman I, Benlimame N, Slagle BL, Perez MH, Alpert L, Song DJ, Fotouhi-Ardakani N, Galipeau J, Alaoui-Jamali MA. Transcriptional regulation of the TFIIH transcription repair components XPB and XPD by the hepatitis B virus x protein in liver cells and transgenic liver tissue. J Biol Chem. 2001;276:14124-14132. [PubMed] |
| 68. | Tao X, Shen D, Ren H, Zhang X, Zhang D, Ye J, Gu B. Hepatitis B virus X protein activates expression of IGF-IR and VEGF in hepatocellular carcinoma cells. Zhonghua Gan Zang Bing Za Zhi. 2000;8:161-163. [PubMed] |
| 69. | Hudson CC, Liu M, Chiang GG, Otterness DM, Loomis DC, Kaper F, Giaccia AJ, Abraham RT. Regulation of hypoxia-inducible factor 1alpha expression and function by the mammalian target of rapamycin. Mol Cell Biol. 2002;22:7004-7014. [PubMed] [DOI] |
| 70. | Liang XH, Stemler M, Will H, Braun R, Tang ZY, Schröder CH. Low incidence and high titers of antibodies to hepatitis B virus X-protein in sera of Chinese patients with hepatocellular carcinoma. J Med Virol. 1988;25:329-337. [PubMed] [DOI] |
| 71. | Chun E, Lee J, Cheong HS, Lee KY. Tumor eradication by hepatitis B virus X antigen-specific CD8+ T cells in xenografted nude mice. J Immunol. 2003;170:1183-1190. [PubMed] [DOI] |
| 72. | Kim YK, Junn E, Park I, Lee Y, Kang C, Ahn JK. Repression of hepatitis B virus X gene expression by hammerhead ribozymes. Biochem Biophys Res Commun. 1999;257:759-765. [PubMed] [DOI] |
| 73. | Weinberg M, Passman M, Kew M, Arbuthnot P. Hammerhead ribozyme-mediated inhibition of hepatitis B virus X gene expression in cultured cells. J Hepatol. 2000;33:142-151. [PubMed] [DOI] |
| 74. | Hung L, Kumar V. Specific inhibition of gene expression and transactivation functions of hepatitis B virus X protein and c-myc by small interfering RNAs. FEBS Lett. 2004;560:210-214. [PubMed] [DOI] |
| 75. | Sievers TM. New antiproliferative immunosuppressive agents. J Pharm Pract. 2003;16:401-413. [DOI] |
| 76. | Decker T, Hipp S, Ringshausen I, Bogner C, Oelsner M, Schneller F, Peschel C. Rapamycin-induced G1 arrest in cycling B-CLL cells is associated with reduced expression of cyclin D3, cyclin E, cyclin A, and survivin. Blood. 2003;101:278-285. [PubMed] [DOI] |
| 77. | Dutcher JP. Mammalian target of rapamycin inhibition. Clin Cancer Res. 2004;10:6382S-6387S. [PubMed] [DOI] |
| 78. | Garber K. Rapamycin's resurrection: a new way to target the cancer cell cycle. J Natl Cancer Inst. 2001;93:1517-1519. [PubMed] [DOI] |
| 79. | Guba M, Löhe F. [Transplantation in cancer disease, and tumors in organ transplantation: current aspects and future prospects]. MMW Fortschr Med. 2004;146:32-34. [PubMed] |
| 80. | Huang S, Bjornsti MA, Houghton PJ. Rapamycins: mechanism of action and cellular resistance. Cancer Biol Ther. 2003;2:222-232. [PubMed] [DOI] |
| 81. | Raymond E, Alexandre J, Faivre S, Vera K, Materman E, Boni J, Leister C, Korth-Bradley J, Hanauske A, Armand JP. Safety and pharmacokinetics of escalated doses of weekly intravenous infusion of CCI-779, a novel mTOR inhibitor, in patients with cancer. J Clin Oncol. 2004;22:2336-2347. [PubMed] [DOI] |
| 82. | Atkins MB, Hidalgo M, Stadler WM, Logan TF, Dutcher JP, Hudes GR, Park Y, Liou SH, Marshall B, Boni JP. Randomized phase II study of multiple dose levels of CCI-779, a novel mammalian target of rapamycin kinase inhibitor, in patients with advanced refractory renal cell carcinoma. J Clin Oncol. 2004;22:909-918. [PubMed] [DOI] |
| 83. | Kaghad M, Bonnet H, Yang A, Creancier L, Biscan JC, Valent A, Minty A, Chalon P, Lelias JM, Dumont X. Monoallelically expressed gene related to p53 at 1p36, a region frequently deleted in neuroblastoma and other human cancers. Cell. 1997;90:809-819. [PubMed] [DOI] |
| 84. | Wang CY, Cusack JC, Liu R, Baldwin AS. Control of inducible chemoresistance: enhanced anti-tumor therapy through increased apoptosis by inhibition of NF-kappaB. Nat Med. 1999;5:412-417. [PubMed] [DOI] |
| 85. | Yasui H, Adachi M, Imai K. Combination of tumor necrosis factor-alpha with sulindac augments its apoptotic potential and suppresses tumor growth of human carcinoma cells in nude mice. Cancer. 2003;97:1412-1420. [PubMed] [DOI] |
| 86. | Futakuchi M, Ogawa K, Tamano S, Takahashi S, Shirai T. Suppression of metastasis by nuclear factor kappaB inhibitors in an in vivo lung metastasis model of chemically induced hepatocellular carcinoma. Cancer Sci. 2004;95:18-24. [PubMed] [DOI] |
| 87. | Dhanalakshmi S, Singh RP, Agarwal C, Agarwal R. Silibinin inhibits constitutive and TNFalpha-induced activation of NF-kappaB and sensitizes human prostate carcinoma DU145 cells to TNFalpha-induced apoptosis. Oncogene. 2002;21:1759-1767. [PubMed] [DOI] |
| 88. | Saller R, Meier R, Brignoli R. The use of silymarin in the treatment of liver diseases. Drugs. 2001;61:2035-2063. [PubMed] [DOI] |
| 89. | Singh RP, Sharma G, Dhanalakshmi S, Agarwal C, Agarwal R. Suppression of advanced human prostate tumor growth in athymic mice by silibinin feeding is associated with reduced cell proliferation, increased apoptosis, and inhibition of angiogenesis. Cancer Epidemiol Biomarkers Prev. 2003;12:933-939. [PubMed] |
| 90. | Poon RT, Ng IO, Lau C, Zhu LX, Yu WC, Lo CM, Fan ST, Wong J. Serum vascular endothelial growth factor predicts venous invasion in hepatocellular carcinoma: a prospective study. Ann Surg. 2001;233:227-235. [PubMed] [DOI] |
| 91. | Warren RS, Yuan H, Matli MR, Gillett NA, Ferrara N. Regulation by vascular endothelial growth factor of human colon cancer tumorigenesis in a mouse model of experimental liver metastasis. J Clin Invest. 1995;95:1789-1797. [PubMed] [DOI] |
| 92. | Millauer B, Shawver LK, Plate KH, Risau W, Ullrich A. Glioblastoma growth inhibited in vivo by a dominant-negative Flk-1 mutant. Nature. 1994;367:576-579. [PubMed] [DOI] |
| 93. | Saleh M, Stacker SA, Wilks AF. Inhibition of growth of C6 glioma cells in vivo by expression of antisense vascular endothelial growth factor sequence. Cancer Res. 1996;56:393-401. [PubMed] |