修回日期: 2004-12-02
接受日期: 2004-12-16
在线出版日期: 2005-02-01
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)作为非酒精性脂肪性肝病(non-alcoholic fatty liver diseases, NAFLD)关键性的中间阶段, 其发病机制的探讨可为临床治疗提供重要依据. 大量研究认为胰岛素抵抗、氧应激、细胞因子是发病环节中的重要因素, 目前有前景的治疗方案多数围绕NASH的关键性致病因子及发生环节展开.
引文著录: 丁效蕙, 赵景民. 非酒精性脂肪性肝炎的发病机制及治疗的研究进展. 世界华人消化杂志 2005; 13(3): 371-375
Revised: December 2, 2004
Accepted: December 16, 2004
Published online: February 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 371-375
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/371.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.371
非酒精性脂肪性肝病(non-alcoholic fatty liver diseases, NAFLD)是指由肝细胞脂肪变性发展到炎症、纤维化的一组疾病谱. 单纯性脂肪肝是良性的、相对静止的状态, 而非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)则能发展成肝纤维化、肝硬化, 二者在临床和影像学上难以分辨, 目前尚无一种敏感的无创性检查方法可区分他们, 肝活检是明确诊断及判断预后的必要手段. 1980年病理学家Ludwig[1]发现在无固定饮酒史及其他肝病的患者身上出现了类似酒精性脂肪性肝炎的肝损伤表现, 非酒精性脂肪性肝炎由此得以命名. NASH成为继丙型肝炎、原发性胆汁性肝硬化之后隐源性肝硬化的重要原因之一. 有研究表明, 50%的NASH会发展成肝纤维化, 15-30%发展成肝硬化, 而3%将发展成肝功能衰竭[2]. 大多数NASH病例发生于脂肪过剩、高脂血症、高血糖患者, 胰岛素抵抗可能是其发病的核心因素. 针对NASH目前尚无明显有效的治疗方法, 因此发病机制的阐述有望是治疗突破的关键所在.
1.1.1 胰岛素抵抗(insulin resistance, IR): 有研究表明, 几乎所有的NAFLD患者都存在肝脏和脂肪组织的胰岛素抵抗, 而且并非皆伴有糖耐量异常和肥胖, 胰岛素抵抗的严重程度与NAFLD的病情进展有关[3]. 1988年关于NAFLD发病机制的"二次打击假说"提出, 第一次打击是脂肪贮积, 第二次打击是氧应激和异常细胞因子作用导致肝脏坏死性炎症和纤维化, 而近年来研究发现, 胰岛素抵抗可能才是真正的"第一次打击"[4]. IR使血清中游离脂肪酸(free fatty acids, FFAs)增多, 当过量的FFA超出肝脏通过线粒体氧化反应及低密度脂蛋白形式排放入血的代谢能力时, 将导致肝细胞脂肪变性. 有学者认为脂肪积聚一方面来源于基因缺陷, 另一方面主要来源于IR、卡路里的过量摄入、内脏性肥胖以及脂肪细胞因子如TNF-α、瘦素、脂联素等的作用[5]. IR可被看作肥胖和非胰岛素依赖型糖尿病的背景. 也有很多学者认为NASH是胰岛素抵抗代谢综合征(X综合征)的临床表现之一.
1.1.2 胰岛素抵抗的分子细胞学基础和脂肪组织的作用: 脂肪组织是调节胰岛素敏感性的细胞因子TNF-α的重要来源, 而TNF-α能抑制调节脂肪酸代谢的蛋白质的表达如脂肪酸结合蛋白aP5、胰岛素应答性转糖载体-4(GLUT4), 从而影响胰岛素效应, TNF-α尚能通过下调维持胰岛素敏感性的过氧化物酶体增生物活化受体(PPARg)促进胰岛素抵抗[6-8]. 实验证明, TNF-α mRNA在NASH患者的脂肪组织和肝组织内表达, 与IR相关的TNF-α等位基因(TNF-α allele)表达明显上调[9]. Hirano et al[10]研究发现TNF-α能诱导NF-κB的活化及RANTES的表达, 在肝细胞损伤中发挥重要作用. NF-κB(neuclear factor kB)是一种具有转录激活功能的蛋白质, 激活后进入细胞核启动基因转录, 导致大量炎症递质产生, 引发炎症反应. 有研究发现抑制枯否氏细胞中的NF-κB激活, 可下调TNF-α等炎症递质基因的表达, 进而抑制肝脏的炎症反应[11]. 此外, 一种脂肪细胞来源的激素-瘦素(Leptin)经证明是通过消弱胰岛素受体底物1(IRS-1)的酪氨酸磷酸化作用来抑制胰岛素活动, 当瘦素水平升高时, IR和脂肪变性开始加重. 瘦素还能增强枯否氏细胞对TNF-α、IL-6、IL-12等细胞因子的分泌, 促进肝细胞的变性坏死. Faggioni et al[12]人的实验证明瘦素缺乏可减少TNF-α的生成. 新近发现的脂肪细胞因子-脂联素(adiponectin)是由脂肪细胞特异性分泌的具有类似胶原结构的蛋白, 经研究发现在IR、肥胖、2型糖尿病及动脉粥样硬化的患者浓度明显下降, 被认为是IR和动脉粥样硬化的保护因子, 受胰岛素、TNF-α、肾上腺激素调节[13-15]. Fasshauer et al[16]研究发现胰岛素可能通过激活P42/44、MAPK、P13、P7056激酶对adiponectin起时间、剂量依赖性的抑制作用. 另有研究表明交感神经系统兴奋性增加儿茶酚胺分泌增多是发生胰岛素抵抗的重要因素, 而b-肾上腺素可能通过G(S)蛋白PKA途径抑制adiponectin基因的表达[17]. 其他脂肪组织来源的细胞因子如IL-6在IR中的作用还不明确, 然而在肥胖病例中被认为关系密切.
1.2.1 氧应激(oxidative stress): 研究显示从脂肪肝到脂肪性肝炎的进展过程是前炎症因子与抗炎症因子失平衡触发氧应激和脂质过氧化反应的结果[5]. 氧应激在NAFLD中起重要作用, 不断增强的氧应激及前炎症因子(TNF-α)的介入导致NAFLD发病的"第二次打击".其机制是胰岛素抵抗和腹内型肥胖使血清FFA增多, 肝脏对FFA摄取增加, 线粒体b氧化速度代偿性增加, 进而增加反应氧的产出. 反应氧与膜磷脂的不饱和脂肪酸反应形成脂质过氧化物(LPO), 引起线粒体DNA损伤、前炎症因子(如TNF-α)释放、肝内抗氧化酶不断消耗等并形成恶性循环. 当肝抗氧化能力不足时, 线粒体功能失常和TNF-α将导致炎症和纤维化. CYP2E1和CYP4A表达增强是氧应激另一来源. CYP2E1(cytochrome P450 2E1)是肝细胞微粒体酒精氧化系统的主要成分, 在酒精性肝病的发病机制中起关键作用, 能产生一些超氧离子、羟自由基并参与脂肪酸在微粒体的w氧化. CYP2E1表达的调节非常复杂, 部分依赖于胰岛素的负调节, 有人猜测CYP2E1在NASH患者中过表达由于IR使肝细胞对胰岛素敏感性下降[18]. 此外, 有研究发现CYP2E1能诱导枯否氏细胞, 导致枯否氏细胞激活和炎症因子(包括TNF-α)的释放[19].
1.2.2 铁负荷(iron overload): Bacon et al[20]首次发现许多NAFLD患者存在血清铁升高、铁负荷现象, 也有研究显示铁负荷并非NAFLD的危险因素. HFE基因突变可能是NAFLD患者铁负荷增加的主要原因, 有报道NASH患者中, C282Y、H63D等位基因与转氨酶水平及肝组织病理学改变严重程度有关[21]. 铁负荷通过催化羟自由基产生、激活枯否氏细胞诱导氧应激和脂质过氧化. Tsukamoto et al[22]研究认为, 不断增加的肝内铁沉积还能激活巨噬细胞内的NF-κB和TNF-α表达.
1.2.3 内毒素、内源性酒精、枯否氏细胞和细胞因子: 几项研究显示NASH可被抗生素逆转, Wigg et al[23]进一步证实NASH患者存在着小肠内细菌过繁殖, 小肠内细菌过繁殖在NASH的发病机制中可能发挥一定的作用. Cope et al[24]在NASH动物模型中发现胃肠源性酒精, 因此考虑小肠内微生物通过产生酒精发挥效应. 内毒素或内源性酒精使枯否氏细胞被激活产生大量中间产物如前列腺素、反应氧、细胞因子、NO及各种蛋白酶诱导一系列类似于酒精性肝病的表现. 然而还没有证据表明小肠细菌过繁殖与血内毒素、TNF-α水平存在关系.
肝星形细胞(hepatic stellate cell, HSC)位于内皮细胞和肝细胞之间的Disse隙中, 通过产生细胞因子、生长因子及表达细胞因子受体相互联系, 活化后产生大量细胞外基质(extracellular matrix, ECM)成分, 是肝纤维化发展过程中的关键细胞. 实验证明活化的HSC与肝纤维化程度有关[25]. 激活HSC的因素有氧应激、转化生长因子b1(transforming growth factorb1, TGF-β1)、结缔组织生长因子(connective tissue growth factor, CTGF)等. 有研究发现活化的HSC与CYP2E1、CYP2A、CYP4A的表达部位同位于肝腺泡3带, 表明CYP2E1可能与HSC的活化有关[26]. Nieto et al[27]的研究也证明CPY2E1抑制剂的应用能阻止HSC的活化. TGF-β1来源于HSC和激活的枯否氏细胞, 是HSC和纤维母细胞的生长因子并是促使HSC活化的最强有力因子, 介导静止型HSC转化成肌成纤维细胞, 产生大量包括Ⅰ型胶原在内的细胞外基质, 调节ECM代谢水解酶如基质金属蛋白酶及其组织抑制物的产生和活性, 是肝纤维化发病机制中最重要的细胞因子. Hasegawa et al[28]在NASH患者与单纯性脂肪肝患者血清TGF-β1水平比较的研究证明TGF-β1与纤维化发病机制关系密切. 此外, 有研究发现在HSC早期激活阶段, 转录因子NF-κB参与了HSC的基因调控和活化, 并通过触发或加剧炎症基因转录细胞因子TGF-β1进一步激活HSC, 并维持HSC的持续活化[29]. CTGF在TGF-β1的诱导下由HSC、成纤维细胞等间质细胞产生, 又介导TGF-β1对HSC促进其增生及细胞外基质合成的作用. Paradis et al[30]观察到CTGF在NASH患者的肝组织内的过表达, 并与纤维化有关. 用葡萄糖或胰岛素孵育HSC能够上调CTGF mRNA及蛋白质的水平表明胰岛素能直接影响纤维化的发展. 另一项实验室研究发现TNF-α能诱导HSC中CTGF的表达[31].
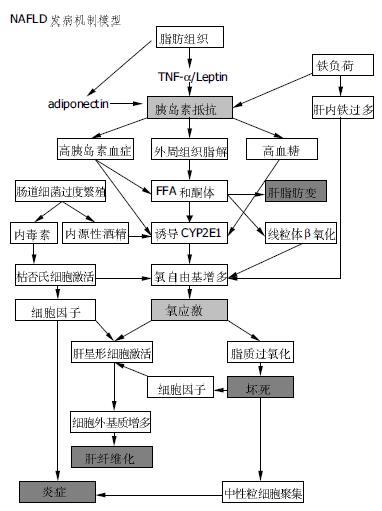
此外, Ikejima et al[32]在动物模型中发现由活化HSC产生的瘦素能促进肝的炎性坏死和纤维化, 可能的机制是通过JAK-STAT信号系统, 增加了TGF-β1的表达, 激活HSC从而增强了肝纤维化, 因此瘦素在肝纤维化的进展中起重要作用. 泛素-蛋白酶体(ubiquitin proteasome)途径是一种清除氧应激产生的有害蛋白质的细胞保护机制. 泛素(Ubiquitin)作为分子配体在细胞间基质的降解中发挥重要作用. Riley[33]的研究认为细胞角蛋白及其他各种蛋白的沉积构成Mallory小体是由于Ubiquitin蛋白酶降解途径的中断, 热休克蛋白也被认为参与这一途径. Savas et al[34]在NASH患者的研究中发现, 血清Ubiquitin水平能预示组织细胞针对氧应激作出的保护性反应的程度而非肝损伤程度(图1).
关于NAFLD的治疗问题目前尚无明确有效的治疗方法. 治疗主要针对NASH的致病危险因素以及应用护肝药物. 肝脏生化指标的改善可通过降低体重、锻炼、健康减肥、医学控制血糖及降脂药物的应用等. 近年来, 建立在发病机制的基础上改善胰岛素敏感性及氧应激的治疗越来越受到重视.
2.1.1 控制体重是当前惟一公认的NASH的治疗方法: 缓慢持续的体重降低可逆转NAFLD患者(即使已有肝硬化的存在)的脂肪变性, 其机制是改善IR及糖耐量异常, 增加糖利用, 并能减轻氧应激和脂质过氧化[35]. 快速的降低体重可导致脂肪性肝炎进展, 炎症、纤维化程度加重; 此外空-回肠旁路术后不宜降低体重-有可能导致"急性"NASH和肝功能衰竭.
2.1.2 有氧锻炼: Bergasa et al[36]研究发现有氧锻炼可改善慢性肝病患者疲劳症状及NASH的进展. 其机制是通过肾上腺素能系统影响内脏脂肪的分解, 下丘脑-垂体-肾上腺轴的激活、氢化可的松、儿茶酚胺等激素的释放与IR密切相关, 内脏脂肪的积聚(中心性肥胖)可作为胰岛素抵抗独立相关因素.
2.2.1 二甲双胍(metformin): 主要用于非胰岛素依赖型糖尿病的治疗, 能有效的降低血糖, 在NASH的治疗中也是一种胰岛素增效剂. 有研究发现二甲双胍能改善NASH患者的胰岛素抵抗、脂肪变性及肝功能异常, 但应慎用于进展型肝病, 以防引起高乳酸血症[37].
2.2.2 TZDs(thiazolidinedions): 是一种PPAR-g配体, 通过激活PPAR-g增加糖利用和促进脂质代谢, 减少FFA和TNF-α的释放, 改善胰岛素敏感性和脂肪变性, 用做胰岛素增效剂. 其中Troglitazone由于其严重的肝毒性已不提倡使用, 而Resiglitazone和Pioglitazone则相当安全, 少有肝毒性报道, 即使有也是轻微可逆的[38]. Kawaguchi et al[39]在NASH动物模型中研究发现, 用TZDs类药物治疗后能阻止HSC活化、明显降低Ⅰ型胶原、MMP-2、TIMP-1、TIMP-2 mRNA的表达, 对于改善肝细胞脂肪变性、阻止肝纤维化、减少癌前病变的发生有积极疗效, 提出TZDs对于NASH的治疗非常有利. 此外, Maeda et al[40]的研究发现TZDs可增加adiponectin mRNA的表达并抑制TNF-α减少adiponectin表达的作用.
2.2.3 治疗高甘油三酯血症: 以Fibrate类药物为主. 常用Bezafibrate、Fenofibrate. 机制是作为PPAR-g受体激活物, 改善线粒体b氧化, 降低肝酶及甘油三酯水平. 此外有研究发现Fibrate能降低TNF-α诱导的NF-κB活化和RANTES表达, 因而认为Fibrate可能是RANTES诱导的炎细胞迁移的抑制因素[10].
2.3.1 抗氧化剂: 维生素E又称a-生育酚(a-Tocopherol)功能主要是清除生物膜上的氧自由基, 并对心肌保护起一定作用. 在Hasegawa et al[28]的研究发现, NASH患者经用a-Tocopherol治疗, 血清转氨酶及TGF-β1水平均明显降低, 推断其作用机制可能在于影响TGF-β1的作用.
2.3.2 甜菜碱(betaines): 其机制是作为甲基供体构成VLDL的前体物质, 而VLDL是肝细胞输出脂质的重要形式, 从而降低肝内脂质积聚. Abdelmalek et al[41]实验发现, Betaines能有效的改善转氨酶水平及肝细胞脂肪变性、坏死性炎症、纤维化.
具有细胞保护、修复细胞膜、拮抗氧应激/脂质过氧化损伤、免疫调节等作用, 提高单纯性脂肪肝防范"二次打击"的能力, 减轻NASH时肝细胞损伤和炎症坏死程度, 持续长期使用可改善肝脂肪变性[42]. 当前的研究表明UDCA防治NAFLD的前景最好, 在基础治疗的同时加用UDCA可改善NAFLD患者的临床症状以及血清生化和纤维化指标.
是一种a糖苷酶抑制剂. Lieber et al[43]研究发现, 阿卡波糖在NASH动物模型中的应用能明显降低TNF-αmRNA及其蛋白质的表达, 以及CYP2E1和前胶原mRNA的表达, 改善脂肪变性和炎症.
国外学者认为NAFLD有可能成为欧美等发达国家第一大肝病, 并且儿童及青少年NAFLD/NASH发病率亦呈快速递增趋势, NASH青少年肝纤维化的发生率为70%, 并有部分发生肝硬化[45]. 虽然迄今我国尚无NASH的流行病学调查资料, 但近年来随着我国肥胖群体的迅速增长, NASH发病率不容乐观. 当前NASH诊治方面仍有许多问题, NASH发病机制的研究亟待进一步的突破. 研究表明胰岛素抵抗与NAFLD关系密切, 然而关于胰岛素信号通路与NAFLD之间的关系值得研究, 细胞因子在NAFLD发生进展中的作用和地位、氧应激与细胞损伤和肝纤维化的关系以及如何检测和预测NASH进展性肝纤维化皆为亟待解决的重要课题, 上述问题的解决, 无疑将对NAFLD的防治发挥重要的推动作用.
编辑: 张海宁
| 1. | Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980;55:434-438. |
| 2. | Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology. 1999;30:1356-1362. |
| 3. | Marchesini G, Brizi M, Bianchi G, Tomassetti S, Bugianesi E, Lenzi M, McCullough AJ, Natale S, Forlani G, Melchionda N. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. Diabetes. 2001;50:1844-1850. |
| 4. | Te Sligte K, Bourass I, Sels JP, Driessen A, Stockbrugger RW, Koek GH. Non-alcoholic steatohepatitis: review of a growing medical problem. Eur J Intern Med. 2004;15:10-21. |
| 5. | Bugianesi E, Zannoni C, Vanni E, Marzocchi R, Marchesini G. Non-alcoholic fatty liver and insulin resistance: a cause-effect relationship? Dig Liver Dis. 2004;36:165-173. |
| 6. | Hotamisligil GS, Johnson RS, Distel RJ, Ellis R, Papaioannou VE, Spiegelman BM. Uncoupling of obesity from insulin resistance through a targeted mutation in aP2, the adipocyte fatty acid binding protein. Science. 1996;274:1377-1379. |
| 7. | Stephens JM, Pekala PH. Transcriptional repression of the C/EBP-alpha and GLUT4 genes in 3T3-L1 adipocytes by tumor necrosis factor-alpha. Regulations is coordinate and independent of protein synthesis. J Biol Chem. 1992;267:13580-13584. |
| 8. | Zhang B, Berger J, Hu E, Szalkowski D, White-Carrington S, Spiegelman BM, Moller DE. Negative regulation of peroxisome proliferator-activated receptor-gamma gene expression contributes to the antiadipogenic effects of tumor necrosis factor-alpha. Mol Endocrinol. 1996;10:1457-1466. |
| 9. | Crespo J, Cayon A, Fernandez-Gil P, Hernandez-Guerra M, Mayorga M, Dominguez-Diez A, Fernandez-Escalante JC, Pons-Romero F. Gene expression of tumor necrosis factor alpha and TNF-receptors, p55 and p75, in nonalcoholic steatohepatitis patients. Hepatology. 2001;34:1158-1163. |
| 10. | Hirano F, Kobayashi A, Makino I. Inhibition of TNF-αlpha-induced RANTES expression in human hepatocyte-derived cells by fibrates, the hypolipidemic drugs. Int Immunopharmacol. 2003;3:225-232. |
| 11. | Shimohashi N, Nakamuta M, Uchimura K, Sugimoto R, Iwamoto H, Enjoji M, Nawata H. Selenoorganic compound, ebselen, inhibits nitric oxide and tumor necrosis factor-alpha production by the modulation of jun-N-terminal kinase and the NF-kappab signaling pathway in rat Kupffer cells. J Cell Biochem. 2000;78:595-606. |
| 12. | Faggioni R, Jones-Carson J, Reed DA, Dinarello CA, Feingold KR, Grunfeld C, Fantuzzi G. Leptin-deficient(ob/ob)mice are protected from T cell-mediated hepatotoxicity: role of tumor necrosis factor alpha and IL-18. Proc Natl Acad Sci USA. 2000;97:2367-2372. |
| 13. | Hotta K, Funahashi T, Arita Y, Takahashi M, Matsuda M, Okamoto Y, Iwahashi H, Kuriyama H, Ouchi N, Maeda K. Plasma concentrations of a novel, adipose-specific protein, adiponectin, in type 2 diabetic patients. Arterioscler Thromb Vasc Biol. 2000;20:1595-1599. |
| 14. | Yang WS, Lee WJ, Funahashi T, Tanaka S, Matsuzawa Y, Chao CL, Chen CL, Tai TY, Chuang LM. Plasma adiponectin levels in overweight and obese Asians. Obes Res. 2002;10:1104-1110. |
| 15. | Hotta K, Funahashi T, Bodkin NL, Ortmeyer HK, Arita Y, Hansen BC, Matsuzawa Y. Circulating concentrations of the adipocyte protein adiponectin are decreased in parallel with reduced insulin sensitivity during the progression to type 2 diabetes in rhesus monkeys. Diabetes. 2001;50:1126-1133. |
| 16. | Fasshauer M, Klein J, Neumann S, Eszlinger M, Paschke R. Hormonal regulation of adiponectin gene expression in 3T3-L1 adipocytes. Biochem Biophys Res Commun. 2002;290:1084-1089. |
| 17. | Fasshauer M, Klein J, Neumann S, Eszlinger M, Paschke R. Adiponectin gene expression is inhibited by beta-adrenergic stimulation via protein kinase A in 3T3-L1 adipocytes. FEBS Lett. 2001;507:142-146. |
| 18. | Woodcroft KJ, Hafner MS, Novak RF. Insulin signaling in the transcriptional and posttranscriptional regulation of CYP2E1 expression. Hepatology. 2002;35:263-273. |
| 19. | Lieber CS. New concepts of the pathogenesis of alcoholic liver disease lead to novel treatments. Curr Gastroenterol Rep. 2004;6:60-65. |
| 20. | Bacon BR, Farahvash MJ, Janney CG, Neuschwander-Tetri BA. Nonalcoholic steatohepatitis: an expanded clinical entity. Gastroenterology. 1994;107:1103-1109. |
| 21. | Bonkovsky HL, Jawaid Q, Tortorelli K, LeClair P, Cobb J, Lambrecht RW, Banner BF. Non-alcoholic steatohepatitis and iron: increased prevalence of mutations of the HFE gene in non-alcoholic steatohepatitis. J Hepatol. 1999;31:421-429. |
| 22. | Tsukamoto H. Iron regulation of hepatic macrophage TNFalpha expression. Free Radic Biol Med. 2002;32:309-313. |
| 23. | Wigg AJ, Roberts-Thomson IC, Dymock RB, McCarthy PJ, Grose RH, Cummins AG. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis. Gut. 2001;48:206-211. |
| 24. | Cope K, Risby T, Diehl AM. Increased gastrointestinal ethanol production in obese mice: implications for fatty liver disease pathogenesis. Gastroenterology. 2000;119:1340-1347. |
| 25. | Washington K, Wright K, Shyr Y, Hunter EB, Olson S, Raiford DS. Hepatic stellate cell activation in nonalcoholic steatohepatitis and fatty liver. Hum Pathol. 2000;31:822-828. |
| 26. | MacDonald GA, Bridle KR, Ward PJ, Walker NI, Houglum K, George DK, Smith JL, Powell LW, Crawford DH, Ramm GA. Lipid peroxidation in hepatic steatosis in humans is associated with hepatic fibrosis and occurs predominately in acinar zone 3. J Gastroenterol Hepatol. 2001;16:599-606. |
| 27. | Nieto N, Friedman SL, Cederbaum AI. Stimulation and proliferation of primary rat hepatic stellate cells by cytochrome P450 2E1-derived reactive oxygen species. Hepatology. 2002;35:62-73. |
| 28. | Hasegawa T, Yoneda M, Nakamura K, Makino I, Terano A. Plasma transforming growth factor-beta1 level and efficacy of alpha-tocopherol in patients with non-alcoholic steatohepatitis: a pilot study. Aliment Pharmacol Ther. 2001;15:1667-1672. |
| 29. | Schwabe RF, Schnabl B, Kweon YO, Brenner DA. CD40 activates NF-kappa B and c-Jun N-terminal kinase and enhances chemokine secretion on activated human hepatic stellate cells. J Immunol. 2001;166:6812-6819. |
| 30. | Paradis V, Perlemuter G, Bonvoust F, Dargere D, Parfait B, Vidaud M, Conti M, Huet S, Ba N, Buffet C. High glucose and hyperinsulinemia stimulate connective tissue growth factor expression: a potential mechanism involved in progression to fibrosis in nonalcoholic steatohepatitis. Hepatology. 2001;34:738-744. |
| 31. | Liu X, Wu H, Liu F, Huang M, Qiang O, Huang S. Effects of tumor necrosis factor alpha on the expression of connective tissue growth factor in hepatic stellate cells. Zhonghua Ganzangbing Zazhi. 2001;9:15-17. |
| 32. | Ikejima K, Takei Y, Honda H, Hirose M, Yoshikawa M, Zhang YJ, Lang T, Fukuda T, Yamashina S, Kitamura T. Leptin receptor-mediated signaling regulates hepatic fibrogenesis and remodeling of extracellular matrix in the rat. Gastroenterology. 2002;122:1399-1410. |
| 33. | Riley NE, Li J, McPhaul LW, Bardag-Gorce F, Lue YH, French SW. Heat shock proteins are present in mallory bodies (cytokeratin aggresomes)in human liver biopsy specimens. Exp Mol Pathol. 2003;74:168-172. |
| 34. | Savas MC, Koruk M, Pirim I, Yilmaz O, Karakok M, Taysi S, Yilmaz A. Serum ubiquitin levels in patients with nonalcoholic steatohepatitis. Hepatogastroenterology. 2003;50:738-741. |
| 35. | Luyckx FH, Lefebvre PJ, Scheen AJ. Non-alcoholic steatohepatitis: association with obesity and insulin resistance, and influence of weight loss. Diabetes Metab. 2000;26:98-106. |
| 36. | Bergasa NV, Mehlman J, Bir K. Aerobic exercise: a potential therapeutic intervention for patients with liver disease. Med Hypotheses. 2004;62:935-941. |
| 37. | Uygun A, Kadayifci A, Isik AT, Ozgurtas T, Deveci S, Tuzun A, Yesilova Z, Gulsen M, Dagalp K. Metformin in the treatment of patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2004;19:537-544. |
| 38. | Isley WL. Hepatotoxicity of thiazolidinediones. Expert Opin Drug Saf. 2003;2:581-586. |
| 39. | Kawaguchi K, Sakaida I, Tsuchiya M, Omori K, Takami T, Okita K. Pioglitazone prevents hepatic steatosis, fibrosis, and enzyme-altered lesions in rat liver cirrhosis induced by a choline-deficient L-amino acid-defined diet. Biochem Biophys Res Commun. 2004;315:187-195. |
| 40. | Maeda N, Takahashi M, Funahashi T, Kihara S, Nishizawa H, Kishida K, Nagaretani H, Matsuda M, Komuro R, Ouchi N. PPARgamma ligands increase expression and plasma concentrations of adiponectin, an adipose-derived protein. Diabetes. 2001;50:2094-2099. |
| 41. | Abdelmalek MF, Angulo P, Jorgensen RA, Sylvestre PB, Lindor KD. Betaine, a promising new agent for patients with nonalcoholic steatohepatitis: results of a pilot study. Am J Gastroenterol. 2001;96:2711-2717. |
| 42. | Bernal-Reyes R, Escudero RB. Treatment of non-alcoholic steatohepatitis(NASH). A comparative study of ursodeoxycholic acid and alpha-tocopherol. A preliminary report. Rev Gastroenterol Mex. 2002;67:70-75. |
| 43. | Lieber CS, Leo MA, Mak KM, Xu Y, Cao Q, Ren C, Ponomarenko A, DeCarli LM. Acarbose attenuates experimental non-alcoholic steatohepatitis. Biochem Biophys Res Commun. 2004;315:699-703. |
| 44. | Contos MJ, Cales W, Sterling RK, Luketic VA, Shiffman ML, Mills AS, Fisher RA, Ham J, Sanyal AJ. Development of nonalcoholic fatty liver disease after orthotopic liver transplantation for cryptogenic cirrhosis. Liver Transpl. 2001;7:363-373. |
| 45. | Burke A, Lucey MR. Non-alcoholic fatty liver disease, non-alcoholic steatohepatitis and orthotopic liver transplantation. Am J Transplant. 2004;4:686-693. |