修回日期: 2004-11-20
接受日期: 2004-11-25
在线出版日期: 2005-02-01
目的: 黄嘌呤氧化还原酶 (xanthine oxidoreductase, XOR) 可催化亚硝酸盐 (nitrite, NO2-) 还原生成一氧化氮 (nitric oxide, NO·). 研究XOR催化NO2-生成的NO·能否保护肝脏对抗缺血再灌注 (ischemia-reperfusion, I/R) 损伤.
方法: Wistar鼠分别予以生理盐水、一氧化氮合酶 (nitric oxide synthase, NOS) 抑制剂Nw-硝基- L-精氨酸甲基酯 (Nw-nitro-L-arginine-methyl ester, L-NAME), XOR抑制剂别嘌呤醇 (allopurinol)、L-NAME + allopurinol以及NO·清除剂carboxy-PTIO预处理 (每组动物12只), 然后行全肝缺血40 min接着再灌注. 再灌注3 h后取血液标本及肝组织用作分析, 并作生存研究.
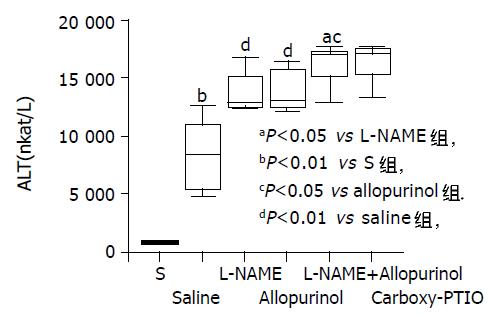
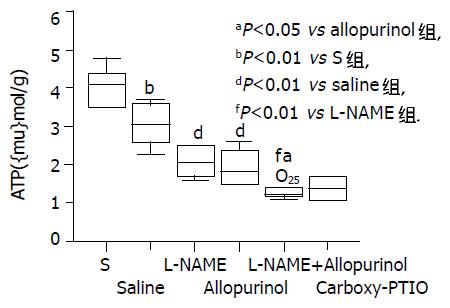
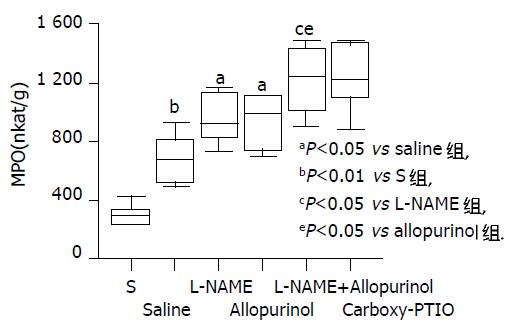
结果: Allopurinol预处理动物与生理盐水预处理动物相比, I/R后血清ALT水平及肝脏髓过氧化物酶(myeloperoxidase, MPO)活性进一步升高, 而肝脏ATP含量进一步降低 (13 845±1 805 vs 8 432±3 071 nkat/L, 942±184 vs 692170 nkat/g及1.93±0.47vs 3.05±0.55 mmol/g; t = -3.722, -2.443及3.802; P<0.01, 0.05及0.01), 肝细胞损伤进一步加剧而整体生存率显著降低 (t = -2.474, Log Rank = 4.15; P<0.05). L-NAME和allopurinol联合预处理动物比L-NAME或allopurinol单独预处理动物表现出更严重的肝脏损伤(t = 2.488和-4.194或t = 2.883和-3.68; P<0.05和0.01)及进一步降低的整体生存率(Log Rank = 5.23或4.26; P<0.05), 但与carboxy-PTIO预处理动物无明显差异.
结论: XOR催化NO2-生成的NO·能保护肝脏对抗I/R损伤.
引文著录: 吕平, 刘芳, 王春友, 姚忠, 陈道达, 田源, 张锦辉, 吴毅华. 亚硝酸盐还原成一氧化氮保护肝脏对抗缺血再灌注损伤. 世界华人消化杂志 2005; 13(3): 346-350
Revised: November 20, 2004
Accepted: November 25, 2004
Published online: February 1, 2005
AIM: Xanthine oxidoreductase (XOR) catalyzes the reduction of nitrite (NO2-) to nitric oxide (NO·). This study was designed to determine whether NO2--derived NO· by XOR protects against hepatic ischemia/reperfusion (I/R) injury.
METHODS: Wistar rats pretreated with saline, nitric oxide synthase (NOS) inhibitor Nw-nitro-L-arginine-methyl ester (L-NAME), XOR inhibitor allopurinol, L-NAME + allopurinol or NO· scavenger carboxy-PTIO (12 animals per group) were subjected to total liver ischemia for 40 min followed by reperfusion. Blood samples and liver tissues were obtained for analysis after 3 h of reperfusion. Survival was also investigated.
RESULTS: In comparison with saline-treated controls, allopurinol-treated mice exhibited further increased serum ALT levels and liver myeloperoxidase (MPO) activities, but further decreased liver ATPstores after I/R (13 845±1 805 vs 8 432±3 071 nkat/L, t = -3.722, P<0.01; 942±184 vs 692±170 nkat/g, t = -2.443, P<0.05; 1.93±0.47 vs 3.05±0.55 mmol/g, t = 3.802, P<0.01; respectively). The hepatocyte injury was further exacerbated and the survival rate was significantly decreased in allopurinol-treated mice (t = -2.474 and Log Rank = 4.15; P<0.05). The animals co-treated with L-NAME and allopurinol showed more severe liver injury (t = 2.488 and -4.194 or t = 2.883 and -3.68; P<0.05 and 0.01) and even lower survival rate (Log Rank = 5.23 or 4.26; P<0.05) than those treated with L-NAME or allopurinol alone. There was no significant difference between carboxy-PTIO treated and L-NAME/allopurinol co-treated mice.
CONCLUSION: NO2--derived NO by XOR protects against liver I/R injury.
- Citation: Lv P, Liu F, Wang CY, Yao Z, Chen DD, Tian Y, Zhang JH, Wu YH. Nitrite reduction to nitric oxide protects against hepatic ischemia/reperfusion injury. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 346-350
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.346
非依赖一氧化氮合酶(nitric oxide synthase, NOS)的一氧化氮(nitric oxide, NO·)生成机制, 可能在常规NO·生成受损的情况下起作用[1-2]. 研究表明有氧存在的情况下, NO·被氧化而迅速生成无机的亚硝酸盐(nitrite, NO2-)[3]. 然而在酸性条件下, NO2-能被化学还原成NO·[4], 目前发现这种反应在低氧条件下也可依赖于黄嘌呤氧化还原酶(xanthine oxidoreductase, XOR)的催化[5-6].
最近有研究表明在心肌缺血过程中XOR以一种pH及浓度依赖的方式催化NO2-生成NO·, 并且这种NO·保护隔离的鼠心脏对抗缺血再灌注(ischemia-reperfusion, I/R)损伤效应[7]. 肝脏是XOR浓度最高的器官之一[8], 然而在肝脏I/R所导致的低氧及酸化环境中XOR能否催化NO2-生成NO·却不知晓. 本研究表明, 由XOR催化NO2-生成的NO·可保护肝脏对抗I/R损伤.
正常♂和♀Wistar鼠, 质量290-350 g, 购于华中科技大学同济医学院实验动物中心. 亚硝酸钠, Nw-硝基-L-精氨酸甲基酯(Nw-nitro-L-arginine-methyl ester, L-NAME)及别嘌呤醇 (allopurinol)(均购自Sigma公司). 2-(4-羧基苯基)-4, 4, 5, 5-四甲基咪唑-1-氧自由基 3-氧化物(carboxy-PTIO)(Cayman化学公司). 采用全肝缺血再灌注模型[9]. 缺血40 min后移除血管夹开始再灌注. 假手术对照鼠除不夹闭血管外处理方式相同. 关闭腹腔, 待动物恢复并自由饮食. 接着对鼠每天进行观察至术后7 d以评价生存或术后3 h处死并获取肝组织和血液样本进行分析. 肝I/R损伤指标血清ALT用商业试剂(Sigma)检测. 另外肝组织切除后, 称质量后迅速冻存于液氮中, 然后保存于-70 ℃用于髓过氧化物酶(myeloperoxidase, MPO)活性(PMN浸润的准确和客观指标)和ATP检测, 或者保存于40 g/L PBS缓冲甲醛中用于病理组织学评估.
动物随机分为6个实验组(每组12只动物). 为了轻微提高动物NO2-水平, 所有鼠在开腹前45 min予以腹腔注射2 mg/kg亚硝酸钠(溶于0.2 mL生理盐水). 除假手术动物外, 所有鼠进行缺血再灌注. 所有实验组在剖腹前45 min(除特别说明外)接受不同处理. 实验组组成如下: 1组, 假手术动物, 2 mL生理盐水静脉注射(S组); 2组, 2 mL生理盐水静脉注射(saline组); 3组, NOS抑制剂L-NAME(10 mg/kg)溶于2 mL生理盐水, 静脉注射 (L-NAME组); 4组, XOR抑制剂别嘌呤醇(1.5 mg/kg)开腹前4 h口服 + 2 mL生理盐水静脉注射(allopurinol组); 5组, L-NAME(10 mg/kg)溶于2 mL生理盐水, 静脉注射 + 别嘌呤醇(1.5 mg/kg)开腹前4 h口服(L-NAME + allopurinol组); 及6组, NO·清除剂carboxy-PTIO(0.6 mg/kg)溶于2 mL生理盐水, 静脉注射(carboxy-PTIO组). 每组中半数动物(6只动物)用于生存分析, 剩余6只动物再灌注3 h后取肝组织和血液标本用于分析. 肝组织在10 g/L HTAB缓冲液中匀浆, 超声裂解并用15 000 g离心. 上清(5 mL)与1.6 mmol/L的四甲基氨基联苯(溶于DMSO)1.5 mL、3 mmol/L稀释于80 mmol/L磷酸盐缓冲液的过氧化氢(pH 5.4)孵育. 结果用中性粒细胞MPO(Sigma公司)校准并以蛋白含量进行标准化. 取整块肝组织在冰上用冰冷的高氯酸匀浆, ATP含量用商业试剂盒(Sigma)按厂商说明书以发光光度计测量. 切除的肝标本固定于40 g/L甲醛并包埋于石蜡. 苏木精-曙红染色切片(5 mm)在放大200倍下采用点计数法以顺序等级评价肝损伤严重程度[10](n = 4). 肝损伤严重程度由轻到重分为0, 1, 2和3级.
统计学处理 数据以mean±SD表示, 两组参数之间的显著性差异评价采用非配对Student's t 检验. 生存分析采用Kaplan-Meier方法, 整体生存率的差异评价采用Log Rank检验. P<0.05被认为有统计学差异.
中位生存时间分别为S组>7 d, saline组6 d, L-NAME组2 d, allopurinol组2.5 d, L-NAME + allopurinol组1 d及carboxy-PTIO组1 d. 与S组相比, saline组肝脏I/R后整体生存率显著下降(Log Rank = 5.45; P<0.05). 与saline组相比, L-NAME或allopurinol组行L-NAME或别嘌呤醇预处理进一步降低I/R后整体生存率(Log Rank = 6.34或4.15; P<0.05). L-NAME组和allopurinol组整体生存率相似. L-NAME和别嘌呤醇联合处理动物整体生存率较L-NAME或别嘌呤醇单独处理动物进一步降低(Log Rank = 5.23或4.26; P<0.05), 但与carboxy-PTIO处理动物相似. S组肝结构保存良好, 肝细胞形态正常具有典型的盘状外观. I/R后肝脏病理组织学表现与血清ALT水平及肝脏MPO活性相关性较好(用顺序等级点计数法决定, 表1).
Saline组I/R后血清ALT水平及肝脏MPO活性较S组显著升高(8 432±3 071 vs 881±145 nkat/L及692±170 vs 317±71 nkat/g; t = -6.017及-4.982; P<0.01), 而肝脏ATP含量较S组显著降低(3.05±0.55 vs 4.05± 0.51mmol/g; t = 3.279; P<0.01). 与Saline组生理盐水处理的鼠相比, NOS抑制剂L-NAME或XOR抑制剂别嘌呤醇预处理的鼠肝I/R后血清ALT水平及肝脏MPO活性进一步升高(13 770±1 835或13 845±1 805 vs 8 432±3 071 nkat/L及953±175或942±184 vs 692±170 nkat/g; t = -3.655或-3.722及t = -2.615或-2.443; P<0.01及0.05), 而肝ATP含量进一步降低(2.07±0.38或1.93±0.47 vs3.05±0.55 mmol/g; t = 3.608或3.802; P<0.01). Allopurinol组与L-NAME组血清ALT水平、肝脏MPO活性及肝ATP含量无统计学差异. 我们还发现L-NAME和别嘌呤醇联合处理动物I/R后血清ALT水平及肝脏MPO活性显著高于L-NAME或别嘌呤醇单独处理的动物(16 201±1 834 vs 13 770±1 835或13 845±1 805 nkat/L及1 217±229 vs 953±175或942±184 nkat/g; t = -2.295或-2.243及t = -2.243或-2.297; P<0.05), 而肝ATP水平显著低于L-NAME或别嘌呤醇单独处理动物(1.32±0.26 vs 2.07±0.38或1.93±0.47mmol/g; t = 3.987或2.833; P<0.01或0.05). 另外我们观测到NO·清除剂carboxy-PTIO预处理动物I/R后血清ALT、肝脏MPO活性及ATP含量与L-NAME + allopurinol预处理动物相比无显著性差异(图1-3).
我们证明NOS抑制剂L-NAME和XOR抑制剂别嘌呤醇联合处理的动物全肝I/R后肝损伤较L-NAME或别嘌呤醇单独处理的动物更严重, 但与NO·清除剂carboxy-PTIO处理的动物相似. 在鼠心脏I/R模型中, Webb et al[7]研究表明缺血期间NO2-还原成NO·并对抗I/R损伤, 并且NO·产生的量随NO2-浓度的增加、酸化(pH降低)及低氧而增加. 这种NO·产生增加是由XOR催化的简单化学酸化的结果. 上述结果表明XOR催化NO2-生成的NO·可对抗I/R损伤. 最近报道, XOR在无氧条件下有NADH或黄嘌呤作为还原底物时, 能催化NO2-还原生成NO·[5]. 尽管NO·可在氧化条件下产生, 研究表明有氧NO·产生率仅为无氧水平的15-30%(pH 5.5时)[7]. 在常规结构型eNOS活性受损时, 无氧条件下黄嘌呤氧化酶(xanthine oxidase, XO)催化NO2-还原可能是NO·的重要来源, 可扮演一个"救护兵"以维持NO·水平.
一般认为常规结构型eNOS来源NO·在多种疾病中起保护作用[11-15]. 在肝脏缺血再灌注(ischemia-reperfusion, I/R)早期没有诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)信使的表达, 而结构表达的内皮细胞一氧化氮合酶(endothelial cell nitric oxide synthase, eNOS)对限制活体全肝I/R模型肝I/R损伤起重要作用[9,16]. NOS抑制剂L-NAME预处理可进一步加剧动物I/R后肝脏损伤并降低整体生存率. 我们观察到别嘌呤醇处理的动物较生理盐水处理的动物I/R后肝脏损伤加重且生存率降低, 但与L-NAME处理的动物无显著差别. 这样看来似乎肝脏I/R期间XOR催化NO2-生成的NO·对限制肝脏损伤的重要作用不亚于eNOS来源的NO·, 后者在这一过程中被削弱. 我们还发现与L-NAME或别嘌呤醇单独处理的动物相比, 当eNOS和NO2-来源的NO·大部分被L-NAME和别嘌呤醇联合处理抑制时, 动物在肝脏I/R后表现出更严重的肝脏损伤以及升高的死亡率. 我们的结果暗示着XOR催化NO2-生成的NO·将补偿肝脏I/R早期受损的eNOS来源的NO·以保护肝脏对抗I/R损伤. 为了进一步证实eNOS和NO2-来源的NO·对限制肝脏I/R损伤的保护效应, 我们还用NO·清除剂carboxy-PTIO预处理动物. 研究表明应用carboxy-PTIO进一步增加了肝脏损伤和死亡率, 其程度与联合应用L-NAME和别嘌呤醇所增加的程度相当. 这提供了进一步的证据表明eNOS和NO2-来源的NO·在肝脏I/R期间介导保护效应对抗肝脏损伤. 另外需要特别指出的是, Webb et al[7]是在离体的鼠心脏灌注系统(Langendorff preparation)中采用特殊的装置来采集生成的NO进行检测, 而我们采用的是活体鼠肝缺血再灌注模型(Pringle's maneuver), 无法直接实时检测在体肝脏所产生的NO含量, 这也正是本实验的不足所在. 或许以后我们或者其他研究者也可以先采用离体的鼠肝灌注系统来进行进一步的研究.
尽管对低浓度NO·起保护作用这一概念有相当多的支持, 但NO·保护动物避免I/R损伤效应的确切机制有待确定. 一个可能的机制可能与NO·的抗氧化特性有关[17]. 现在普遍认为肝脏I/R损伤初期的特征是库否细胞激活并释放反应性氧自由基(reactive oxygen species, ROS). 已知NO·可抑制活性氧基团(reactive oxygen species, ROS)-介导的反应, 并且NO·对诸如O2-、OH-和/或高铁血红蛋白ROS的解毒能力被认为是各种情况下保护效应的原因[18]. 另有研究认为, NO·通过与呼吸链特定的复合体相互作用而致细胞ATP浓度改变来调整线粒体呼吸以提供保护[19-20]. 这可能是本研究中当eNOS和/或NO2-来源的NO·因L-NAME和/或别嘌呤醇预处理而受损时, 肝脏I/R后肝脏ATP水平为什么进一步降低的主要原因之一.
我们在开腹前45 min对所有动物进行腹腔注射2 mg/kg的亚硝酸钠(溶于0.2 mL生理盐水). 我们这里所使用的亚硝酸钠剂量仅是一次常规静脉注射剂量的1/6至1/3, 在我们的预实验中该剂量未发现给鼠带来任何异常反应. 本发现表明如果有NO2-作为不同的底物, XOR在I/R中的最终效应并不预先就确定是损伤的. 总之, 本研究结果表明在肝脏I/R导致的低氧及酸化环境中XOR催化NO2-生成的NO·可对抗肝脏I/R损伤.
编辑: 潘伯荣 审读:张海宁
| 1. | Bjorne H H, Petersson J, Phillipson M, Weitzberg E, Holm L, Lundberg JO. Nitrite in saliva increases gastric mucosalblood flow and mucus thickness. J Clin Invest. 2004;113:106-114. [PubMed] [DOI] |
| 2. | Cosby K, Partovi KS, Crawford JH, Patel RP, Reiter CD, Martyr S, Yang BK, Waclawiw MA, Zalos G, Xu X. Nitrite reduction to nitric oxide bydeoxyhemoglobin vasodilates the human circulation. Nat Med. 2003;9:1498-1505. [PubMed] [DOI] |
| 3. | Lauer T, Preik M, Rassaf T, Strauer BE, Deussen A, Feelisch M, Kelm M. Plasma nitrite rather than nitrate reflectsregional endothelial nitric oxide synthase activity but lacks intrinsic vasodilator action. Proc Natl Acad Sci USA. 2001;98:12814-12819. [PubMed] [DOI] |
| 4. | Gabel SA, Cross HR, London RE, Steenbergen C, Murphy E. Decreased intracellular pH is not due to increased H+extrusion in preconditioned rat hearts. Am J Physiol. 1997;273:H2257-H2262. [PubMed] |
| 5. | Li H, Samouilov A, Liu X, Zweier JL. Characterization of the magnitude and kinetics of xanthine oxidase-catalyzednitrite reduction. Evaluation of its role in nitric oxide generation in anoxic tissues. J Biol Chem. 2001;276:24482-24489. [PubMed] [DOI] |
| 6. | Godber BL, Doel JJ, Sapkota GP, Blake DR, Stevens CR, Eisenthal R, Harrison R. Reduction of nitrite to nitric oxidecatalyzed by xanthine oxidoreductase. J Biol Chem. 2000;275:7757-7763. [PubMed] [DOI] |
| 7. | Banerjee S, Paul P, Talib VJ. Serum prolactin in seizure disorders. Indian Pediatr. 2004;41:827-831. [PubMed] |
| 8. | Harrison R. Structure and function of xanthine oxidoreductase: where are we now? Free Radic Biol Med. 2002;33:774-797. [PubMed] [DOI] |
| 10. | Camargo CA Jr, Madden JF, Gao W, Selvan RS, Clavien PA. Interleukin-6 protects liver against warmischemia/reperfusion injury and promotes hepatocyte proliferation in the rodent. Hepatology. 1997;26:1513-1520. [PubMed] [DOI] |
| 11. | Varadarajan R, Golden-Mason L, Young L, McLoughlin P, Nolan N, McEntee G, Traynor O, Geoghegan J, Hegarty JE, O'Farrelly C. Nitric oxide in early ischaemia reperfusion injury during human orthotopic liver transplantation. Transplantation. 2004;78:250-256. [PubMed] [DOI] |
| 12. | Gong JP, Tu B, Wang W, Peng Y, Li SB, Yan LN. Protective effect of nitric oxide induced by ischemic preconditioningon reperfusion injury of rat liver graft. World J Gastroenterol. 2004;10:73-76. [PubMed] |
| 13. | Albrecht EW, Stegeman CA, Heeringa P, Henning RH, van Goor H. Protective role of endothelial nitric oxide synthase. J Pathol. 2003;199:8-17. [PubMed] [DOI] |
| 14. | 宁 守斌, 张 忠兵, 沈 茜, 谢 渭芬, 杨 秀疆, 赵 新, 信 栓力. 胃肠道平滑肌细胞作为eNOS基因转移靶细胞的研究. 世界华人消化杂志. 2003;11:986-989. [DOI] |
| 16. | Kawachi S, Hines IN, Laroux FS, Hoffman J, Bharwani S, Gray L, Leffer D, Grisham MB. Nitric oxide synthase andpostischemic liver injury. Biochem Biophys Res Commun. 2000;276:851-854. [PubMed] [DOI] |
| 17. | Wink DA, Miranda KM, Espey MG, Pluta RM, Hewett SJ, Colton C, Vitek M, Feelisch M, Grisham MB. Mechanisms ofthe antioxidant effects of nitric oxide. Antioxid Redox Signal. 2001;3:203-213. [PubMed] [DOI] |
| 18. | Grisham MB, Jourd' Heuil D, Wink DA. Nitric oxide I Physiological chemistry of nitric oxide and its metabolites:implications in inflammation. Am J Physiol. 1999;276:G315-321. [PubMed] |
| 19. | Moncada S, Erusalimsky JD. Does nitric oxide modulate mitochondrial energy generation and apoptosis? Nat Rev Mol Cell Biol. 2002;3:214-20. [PubMed] [DOI] |
| 20. | Beltran B, Mathur A, Duchen MR, Erusalimsky JD, Moncada S. The effect of nitric oxide on cell respiration:A key to understanding its role in cell survival or death. Proc Natl Acad Sci USA. 2000;97:14602-14607. [PubMed] [DOI] |