修回日期: 2004-12-02
接受日期: 2004-12-08
在线出版日期: 2005-02-01
目的: 观察温阳中药复方肝之福在实验性肝纤维化形成过程中的防治作用, 并探讨其疗效机制.
方法: Wistar大鼠45只随机分为4组: 正常对照组、肝之福组、秋水仙碱组及模型对照组. 除正常组外, 其余3组均采用CCl4 SC及饮用100 mL/L乙醇的方法制备大鼠肝纤维化模型. 在造模的同时, 肝之福组予肝之福灌胃, 秋水仙碱组予秋水仙碱灌胃, 模型对照组则予等量生理盐水灌胃, 1次/d, 共30 d. 实验结束后分别采血测定肝功能、肝纤维化指标, 取肝组织测定羟脯氨酸(Hyp)含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性, 并根据炎症活动度及纤维化半定量计分系统(SSS)评分, 以观察预防用药组与模型对照组的组织学变化, 同时对肝组织内Ⅰ、Ⅲ、Ⅳ型胶原进行染色并定量分析.
结果: 与模型对照组相比, 肝之福组的肝功能明显改善, 肝纤维化指标显著降低, Hyp含量由1.52±0.35 mg/g减少到1.12±0.29 mg/g(P<0.05), MDA含量由16.3±6.0 mmol/g减少到8.8±2.1 mmol/g(P<0.01), 而SOD活性则由86.33±17.74 nkat/g升高至122.01±19.12 nkat/g (P<0.01); 同时, SSS评分炎症活动度及肝纤维化程度明显改善, 肝组织内Ⅰ型、Ⅲ型、Ⅳ型胶原含量下降. 经比较, 肝之福抗肝纤维化的上述疗效与秋水仙碱相当.
结论: 肝之福可保护肝脏, 预防或缓解肝纤维化的形成, 抗脂质过氧化是其可能的作用机制.
引文著录: 王丽春, 赵连三, 唐红, 刘丽, 刘聪, 张红英, 尧凡. 温阳中药复方肝之福对大鼠肝纤维化形成的影响. 世界华人消化杂志 2005; 13(3): 330-335
Revised: December 2, 2004
Accepted: December 8, 2004
Published online: February 1, 2005
AIM: To investigate the effect of compound Ganzhifu on experimental hepatic fibrosis and its possible mechanism.
METHODS: Forty-five Wistar rats were randomly divided into four groups: normal (N) group, Ganzhifu (G) group, colchicine (C) group and model (M) group. All the rats, except those in N group, were given CCl4 by subcutaneous injection and alcohol (10%) by oral administration to establish the model of hepatic fibrosis. At the same time, the rats in G, C or M group were treated through stomach irrigation with Ganzhifu, colchicine or saline, respectively. Blood was collected for the examination of liver function and serum fibrosis markers. Hydroxyproline (Hyp), malondial dehyde (MDA) content, and superoxide disumutase (SOD) activity were determined in liver tissues. HE, Masson and Gorden-Sweet staining were used to examine the pathological changes in liver tissue sections. Inflammation and fibrosis were evaluated by semi-quantitative scoring system (SSS). In addition, The expression of typeI, III, IV collagens was detected by immunohistochemistry.
RESULTS: Compared with that in M group, liver function was improved remarkably in G group, and there were significant decreases in the liver fibrosis markers (Hyp: 1.52±0.35 mg/g vs 1.12±0.29 mg/g, P<0.05; MDA: 16.3±6.0 mmol/g vs
8.8±2.1 mmol/g, P<0.01). However, the SOD activity was notably elevated (86.33±17.74 nkat/g vs 122.01±19.12 nkat/g, P<0.01). Less inflammation, lower degree of fibrosis and reduced content of typeI, III, IV collagens were observed in G group than in M group. No significant difference was found between the effects of Ganzhifu and colchicines against fibrosis.
CONCLUSION: Ganzhifu can protect liver from fibrosis and the mechanism may be related to its anti-oxidative effect.
- Citation: Wang LC, Zhao LS, Tang H, Liu L, Liu C, Zhang HY, Yao F. Effect of Chinese drug compound Ganzhifu on liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 330-335
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/330.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.330
肝纤维化存在可逆性[1], 早期采取干预措施阻断肝纤维化的发展, 对预防肝硬化的形成具有重要意义. 中药复方肝之福可改善肝脏微循环, 增加肝脏及肠系膜静脉血流量, 减低肝脏纤维化程度[2]. 其方义为温肾祛寒, 健脾利水, 有别于目前常用的活血化瘀类中药复方. 我们利用大鼠肝纤维化模型作为实验动物, 探讨了肝之福对阻断肝纤维化形成过程的影响及其可能的作用机制.
肝之福复方制剂(含干姜、桂枝、制附子、黄芪、柴胡、枳壳、白杓、甘草)系由我院中药制剂室煎制浓缩而成的混悬液, 每毫升含生药量0.366 g. 秋水仙碱浓度为17 mg/L(云南西双版纳制药厂产). Beckman Dur 530分光光度计, Nikon TE2000-U倒置生物显微镜, FJ 630-Gg免疫计数器. 健康Wistar大鼠共45只, 体质量180-220 g, 雌雄各半, 购自四川大学华西医学实验动物中心. 随机分为4组: 模型对照组12只, 肝之福组12只, 秋水仙碱组12只及正常对照组9只. 上述前3组动物SC 400 mL/L CCl4(用前用橄榄油临时配制), 首次剂量为5 mL/kg, 以后为3 mL/Kg; 2次/wk, 共14次; 同时, 以100 mL/L乙醇代替常水供动物饮用. 正常对照组则SC等量橄榄油, 正常饮水. 在造模的同时, 肝之福组灌喂肝之福液3 mL(含生药量1.1 g), 1次/d, 至造模结束, 共30 d. 秋水仙碱组则同法灌喂秋水仙碱液3 mL(含秋水仙碱0.05 mg). 模型对照组则同法予等量生理盐水灌喂.
上述造模及处理过程结束日, 禁食12 h后称质量, 股静脉取血, 分离血清置-20 ℃保存; 并立刻完整摘取肝脏及脾脏, 称质量后用生理盐水漂洗肝左叶数次, 滤纸拭干后, 切取0.2 g置于冰浴中的组织匀浆器内, 加入冰生理盐水2 mL, 制备成100 g/L肝组织匀浆, 4 000 r/min 4 ℃离心, 取上清液保存于-20 ℃.肝右叶置于40 g/L中性甲醛液中常规固定后, 石蜡包埋, 用于制作组织芯片, 测定血清肝功能包括TB(总胆红素)、ALT、ALB、A/G, 检测HA(透明质酸), PCⅢ(Ⅲ型前胶原), CⅣ(Ⅳ型胶原), LN(层粘蛋白)含量(放射免疫分析法, 试剂盒购自上海海军医学研究所); 肝匀浆检测SOD(超氧化物歧化酶)活性(黄嘌呤氧化酶法)、MDA(丙二醛)含量(硫代巴比妥酸法)、Hyp(羟脯氨酸)含量(二甲氨基苯甲醛法). 以上检测试剂盒购自南京建成生物工程研究所, 均按试剂盒说明书操作. 组织芯片分别行常规HE染色, Masson三色染色(染胶原纤维)及网织纤维染色, 由病理专业医师读片, 光镜下观察, 并根据我国学者王泰龄et al改进的肝纤维化半定量评分系统(SSS)进行炎症活动度及肝纤维化程度计分. 采用SABC法免疫组织化学染色, DAB显色, 镜下观察肝组织内Ⅰ, Ⅲ, Ⅳ型胶原的表达, 并采用下列方法进行定量分析: 每个组织标本随机选取10个视野, 使用美国Image-Pro Plus专业图像分析软件, 测定每视野阳性染色面积占整个视野面积的百分比, 取其均值.
统计学处理 实验结果数据以mean±SD表示, 经SPSS软件包11.12版本进行方差分析.
正常组9只大鼠均活动如常, 毛发有光泽, 饮食量及体质量均增加, 肝质量/体指数为3.32±0.23, 脾/体指数为2.46±0.78; 模型组随病程进展, 12只大鼠均逐渐出现活动减少, 皮毛松弛蓬乱, 毛色晦暗, 精神萎靡, 进食减少, 体质量减轻等病态, 至造模结束时已陆续死亡3只. 剩余9只均显示肝脾肿大, 肝/体指数为5.92±0.94, 脾/体指数为4.34±2.09, 均明显高于正常对照组(P<0.05, 0.01); 治疗组至造模结束时, 肝之福组已陆续死亡3只; 其余9只的肝/体指数为5.03±0.59, 脾/体指数为4.15±1.12; 秋水仙碱组已陆续死亡2只, 剩余10只的肝/体指数为5.23±0.76, 脾/体指数为3.51±0.46. 两治疗组的肝/体指数之间无明显差异, 但均明显低于模型对照组(P<0.05), 提示经肝之福组或秋水仙碱治疗后, 虽然仍有肝肿大, 但肿大程度较未治疗者明显减轻. 不过, 脾/体指数在三组之间均无显著差异, 提示脾肿大未受上述治疗的影响.
与正常对照组相比, 模型对照组的肝功能显示显著异常(P<0.01); 而肝之福或秋水仙碱治疗组肝功能则明显改善(P<0.05, 0.01), 已接近正常肝功能. 上述疗效在两治疗组之间无明显差异, 表明肝之福有保护肝功能的作用, 其疗效与秋水仙碱相当(表1).
模型组HA, PCⅢ, CⅣ和LN均较正常对照组明显升高(P<0.01); 而肝之福组和秋水仙碱治疗组的上述肝纤维化指标虽仍然高于正常对照组, 但均明显低于模型对照组. 其中HA, PCⅢ的降低具有统计学意义(P<0.05或0.01, 表2).
正常组MDA(丙二醛)含量为3.2±0.5 mmol/g, SOD(超氧化物歧化酶)活性为164.6±34 nkat/g, 肝之福组MDA含量(8.8±2.1 mmol/g)较正常组升高, 但明显低于模型对照组(16.3±6.0 mmol/g, P<0.01)和秋水仙碱组(13.3±2.6 mmol/g, P<0.01); 而SOD活性(122.01±19.12 nkat/g)较正常组降低, 但明显高于模型对照组(86.33±17.74 nkat/g, P<0.01)和秋水仙碱组(100.56±13.72 nkatu/g, P<0.05), 表明肝之福可降低肝组织内MDA含量, 提高SOD活性, 而秋水仙碱不具有这种作用. 模型对照组Hyp含量为1.52±0.35 mg/g, 明显高于正常对照组0.85±0.15mg/g (P<0.01); 而治疗组(肝之福组1.12±0.29 mg/g, 秋水仙碱组1.21±0.20 mg/g)虽仍然高于正常对照组, 但均明显低于模型对照组(P<0.05或0.01), 表明肝之福可显著减少胶原在肝脏内的沉积.
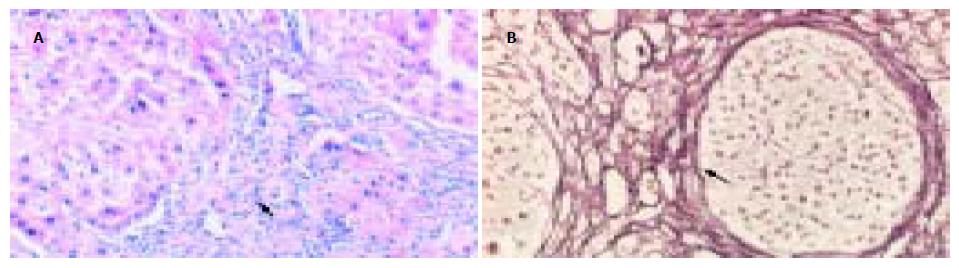
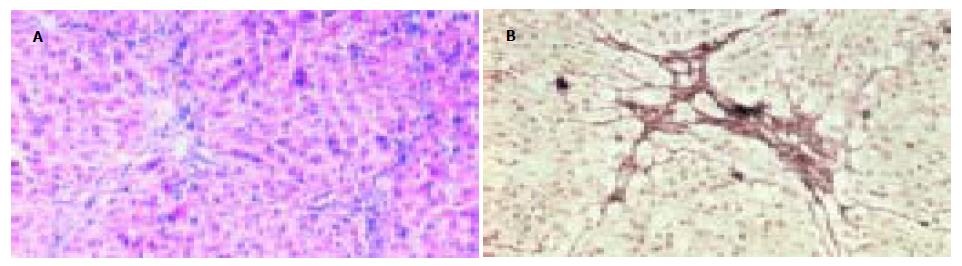
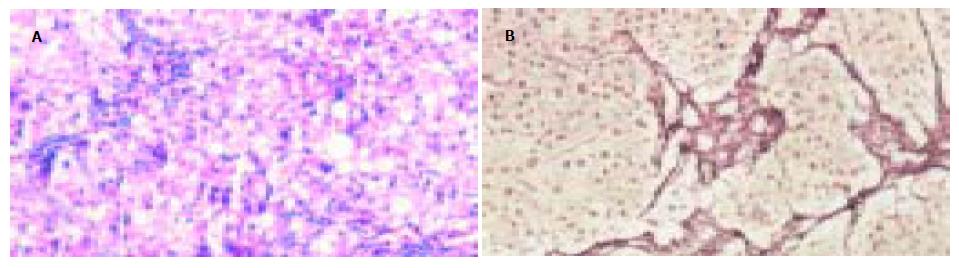
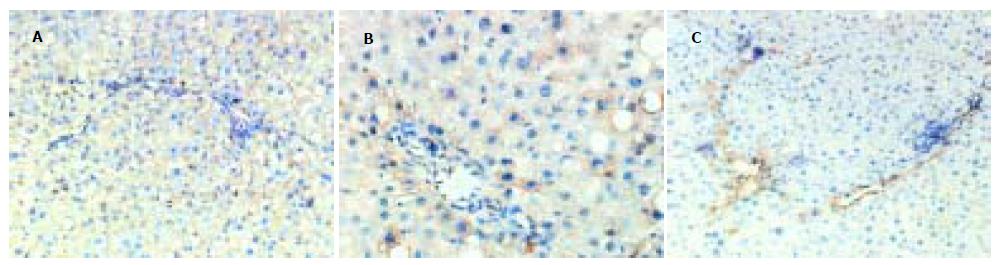
模型对照组肝小叶结构破坏, 由广泛增生的纤维组织将原有肝小叶分割包绕成大小不等的假小叶结节. 假小叶内肝细胞索排列紊乱, 肝细胞肿胀, 胞质疏松, 可见气球样变; 肝窦扩张, 汇管区明显扩大, 可见大量炎细胞浸润(图1A), 纤维组织明显增生并伸向小叶内, 形成粗大的纤维隔分割小叶(图1B). 与模型组相比, 肝之福组和秋水仙碱组的肝组织病变明显减轻, 肝小叶结构轻度紊乱, 仅在少数区域见有不完整的假小叶形成. 肝细胞脂肪变性较轻, 散在点状坏死. 肝窦扩张不明显, 汇管区稍扩大, 仅见少量炎细胞浸润, 纤维组织轻度增生, 部分视野可见少量细纤维隔(图2, 3). 炎症活动度SSS计分: 肝之福组10.00±1.41, 秋水仙碱组11.40±2.12, 均明显低于模型对照组13.33±1.73(P<0.05或0.01), 但两组之间无显著差异. 纤维化程度计分: 肝之福组13.11±1.27, 秋水仙碱组12.90±1.73, 也明显低于模型对照组20.11±2.20(P<0.01), 两组之间仍无显著差异.
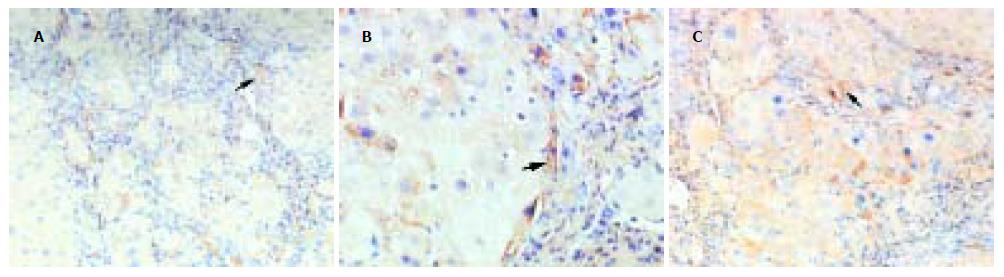
Ⅰ型胶原: 模型对照组肝组织在假小叶中央静脉周围、汇管区、Disse间隙等部位均可见强阳性染色, 棕黄色的Ⅰ型胶原呈束状粗纤维, 主要位于炎症坏死区、增生的纤维间隔及肝窦周围, 明显加宽分割包绕肝小叶(图4A). 而在肝之福组和秋水仙碱组, 虽然血管周围及汇管区、Disse间隙亦呈均匀阳性染色, 但较模型对照组着色轻, 且无明显纤维间隔形成(图5A).Ⅲ型胶原: 在模型对照组, 可见Ⅲ型胶原由中央静脉周围向小叶周边延伸, 纤维间隔内大量条索状强阳性染色, 纤维堆积, 大部分Disse间隙有胶原纤维沉积, 呈强阳性染色(图4B). 而在肝之福组和秋水仙碱组, 纤维间隔均匀阳性染色, Disse间隙内阳性染色, 与模型对照组比着色程度及范围均明显减弱(图5B).Ⅳ型胶原: 在模型对照组, 可见大量的Ⅳ型胶原位于增生的纤维间隔内, 呈束状强阳性染色, 甚至连成片状, 在血窦呈连续分布, 在细胞外基质中有Ⅳ型胶原阳性细胞存在(图4C); 而在肝之福组和秋水仙碱组, Ⅳ型胶原在基膜及血窦内呈连续分布, 纤维间隔窄而且薄, 着色程度较模型对照组减弱(图5C). 经Image-Pro Plus专业图像软件分析, 模型对照组肝组织的Ⅰ, Ⅲ, Ⅳ型胶原含量均明显高于正常对照组(P<0.01); 而治疗组(肝之福组及秋水仙碱组)虽仍然明显高于正常对照组, 但均明显低于模型对照组(P<0.01), 而肝之福组与秋水仙碱组两组之间无显著性差异(表3).
在祖国医学实践中, 用干姜、桂枝、制附子治疗慢性肝病已有悠久历史. 肝之福就是以干姜、桂枝、制附子等温阳药物为主药, 辅以保肝药物组成的复方制剂. 方中附子、干姜辛热, 桂枝辛甘温, 通行十二经全身, 附子温补肾阳, 干姜温补脾胃, 桂枝温经络散寒, 改善局部末梢微循环; 黄芪甘温补气, 使气得温则行, 血得气以之推动; 柴胡微辛苦寒; 白芍敛阴补血; 枳壳苦辛微宣行气消滞; 甘草调和诸药. 以上各药合用共奏温阳益气、疏肝健脾之功, 使肝脾气血流畅, 肝组织获得充分的的营养供给, 损伤的肝细胞得以修复, 达到防治肝纤维化的目的, 已得到临床及实验研究的证实. 我们的实验结果表明, 在以CCL4进行致肝纤维化造模的同时, 给予肝之福或秋水仙碱进行预防性处理, 均可明显改善造模鼠的肝功能指标(降低总胆红素、谷丙转氨酶, 提高血清白蛋白水平和白球比值), 减少血清中的羟脯氨酸含量. 而且, 病理组织学观察、SSS计分、及各型胶原的图像定量分析的结果也表明, 与模型对照组相比, 肝之福组的肝脏炎症坏死和肝纤维化程度亦均明显缓解, SSS计分显著下降(P<0.05或0.01), 三种胶原的含量也明显降低(P<0.01). 上述疗效指标在肝之福组与秋水仙碱组之间无明显差异.
模型对照组中Ⅰ, Ⅲ和Ⅳ型胶原在纤维组织增生和增宽的汇管区及纤维间隔中有较强的阳性着色, 甚至形成纤维细索, 提示病变处于由肝纤维化向肝硬化的发展过程中; 而我们观察到, 肝之福组及秋水仙碱组中Ⅰ, Ⅲ和Ⅳ型胶原的阳性表达较模型组明显减弱, 着色少而浅, 定量分析结果显示三种胶原含量均明显低于模型组(P<0.01). 以上结果显示, 肝之福在实验性肝纤维化形成过程中具有明显的保护作用, 可显著减轻肝细胞的变性坏死, 抑制肝脏炎症, 缓解肝纤维化的形成, 与对照治疗药秋水仙碱的疗效相当. 但秋水仙碱是一个典型的有丝分裂毒素, 对分裂旺盛的细胞作用更强; 因此存在较大的毒副作用, 例如, 骨髓抑制、肾损害、消化系症状等. 尤其是在晚期慢性肝病患者, 长期服用秋水仙碱(1 mg/d)可发生明显的毒副作用. 与秋水仙碱相比, 肝之福不良反应很低, 用于治疗肝纤维化具有显著的优点.
目前的研究认为, 肝纤维化的病理改变是细胞外基质(ECM)的增生和降解失衡所致, 而病理情况下细胞外基质的主要细胞来源是肝星状细胞(HSC), 他的激活和增生在肝纤维化过程中起主要作用[3-4]. HSC的活化过程受许多因素调控, 包括细胞因子和氧化应激, 特别是脂质过氧化物, 可能是HSC活化和增生的重要媒介[5-7]. 目前, 所有临床和实验性肝纤维化都被证实与氧化应激有关[8-9]. 而CCl4/乙醇致肝纤维化的主要机制就是活性氧自由基的产生及其引发的脂质过氧化, 损伤肝细胞[10-11], 产生脂质过氧化物MDA等, 促进HSC转化、增生和合成ECM, 同时抑制ECM降解, 导致肝纤维化. 鉴于氧化应激和脂质过氧化是引起肝细胞损伤及HSC活化的重要机制[12], 而SOD是广泛存在于生物体内的一种金属酶, 主要功能是清除体内多余的氧自由基, 因此, 抑制脂质过氧化则是抗肝纤维化的重要环节. 我们发现与模型组相比, 预防性使用肝之福可明显降低肝组织中的MDA含量(P<0.01), 提高SOD活性(P<0.05), 而秋水仙碱不具有这种抗脂质过氧化作用, 显示肝之福抗肝纤维化的作用机制与秋水仙碱有所不同. 组织芯片又称组织微阵列, 是一种高通量、多样本的分析工具, 可同时对几百甚至上千种正常、疾病或疾病发展不同阶段的组织样本进行基因及其表达产物的研究, 比较传统的单组织切片, 具有反应条件均一、结果参比性好的优势, 有助于保障本研究结果的可靠性.
编辑: 潘伯荣 审读:张海宁
| 1. | Okazaki I, Watanabe T, Hozawa S, Niioka M, Arai M, Maruyama K. Reversibility of hepatic fibrosis: from the first reportof collagenase in the liver to the possibility of gene therapy for recovery. Keio J Med. 2001;50:58-65. [PubMed] [DOI] |
| 2. | 王 丽春, 雷 秉钧, 李 林, 赵 静波. 温阳中药对实验性肝纤维化治疗作用的研究. 四川大学学报(医学版). 2004;35:532-535. [PubMed] |
| 3. | Sakata R, Ueno T, Nakamura T, Sakamoto M, Torimura T, Sata M. Green tea polyphenol epigallocatechin-3-gallateinhiplatelet-derived growth factor-induced proliferation human hepatic stellate cell line LI90. J Hepatol. 2004;40:52-59. [PubMed] [DOI] |
| 4. | Isono M, Soda M, Inoue A, Akiyoshi H, Sato K. Reverse transformation of hepatic myofibroblast-like cells byTGFbetal/LAP. Biochem Biophys Res Commun. 2003;311:959-965. [PubMed] [DOI] |
| 5. | Mann DA, Smart DE. Transcriptional regulation of hepatic stellate cell activation. Gut. 2002;50:891-896. [PubMed] [DOI] |
| 6. | Pinzani M, Marra F. Cytokine receptors and signaling in hepatic stellate cells. Semin Liver Dis. 2001;21:397-416. [PubMed] [DOI] |
| 7. | Liu XJ, Yang L, Mao YQ, Wang Q, Huang MH, Wang YP, Wu HB. Effects of the tyrosine protein inhibitor genistein onthe proliferation, activation of cultured rat hepatic stellate cells. World J Gastroenterol. 2002;8:739-745. [PubMed] [DOI] |
| 8. | Zhong Z, Froh M, Wheeler MD, Smutney O, Lehmann TG, Thurman RG. Viral gene delivery of superoxide dismutaseattenuates experimental cholestasis-induced liver fibrosis in the rat. Gen Ther. 2002;9:183-191. [PubMed] [DOI] |
| 9. | Cui YH, Wang XL, Liu Q, Liu P. Influences of anti-oxidation of salvianolic acid B on proliferation of rat culturedhepatic stellete cells. Shijie Huaren Xiaohua Zazhi. 2002;10:317-319. [PubMed] |
| 10. | Hernandez-Munoz R, Diaz-Munoz M, Chagoya de Sanchez V. Possible role of all redox state on collagen metabolismin carbon tetrachloride-induced cirrhosis as evidenced by adenosine administration to rats. Biochem Biophys Acta. 1994;1200:93-99. [PubMed] [DOI] |
| 11. | Liu SL, Degli Esposti S, Yao T, Diehl AM, Zern MA. Vitamin E therapy of acute CCl4-induced hepatic injury in miceis associated with inhibition of nuclear factor kappa B binding. Hepatology. 1995;22:1474-1481. [PubMed] |
| 12. | Svegliati Baroni G, Dmbrosio L, Ferretti G, Casini A, Disario A, Salzano R, Ridolfi F, Saccomanno S, Jezequel AM, Benedetti A. Fibrogenic effect of oxidative stress on rat hepatic stellete cells. Hepatology. 1998;27:720-726. [PubMed] [DOI] |