修回日期: 2004-10-25
接受日期: 2004-11-04
在线出版日期: 2005-02-01
目的: 探讨槲皮素(quercetin, QU)联合顺铂(DDP)对胃癌SGC-7901细胞增生、凋亡及凋亡相关基因Bcl-XL mRNA表达的影响.
方法: 用槲皮素和顺铂处理胃癌SGC-7901细胞后, 应用光镜、电镜、MTT法、流式细胞仪和RT-PCR技术研究胃癌细胞的形态学变化、生长抑制、诱导凋亡和对凋亡相关基因Bcl-XL mRNA表达的影响.
结果: 药物作用于细胞24 h后, 可看到较为典型的细胞凋亡形态学变化. DDP和QU均可以抑制胃癌SGC-7901细胞增生或诱导其凋亡, 且有时间和剂量依赖效应, 联合应用具有协同效应. 联合组的诱导凋亡率及增生抑制效应显著高于单用DDP组(P<0.01), 干预48 h后, Bcl-XL mRNA的表达下调, QU可以加强下调作用.
结论: 人胃癌SGC-7901细胞体外实验中, QU和顺铂可以抑制其增生并诱导凋亡, 二者联合应用有一定的协同效应, 且呈剂量依赖关系.
引文著录: 王海忠, 王沁. 槲皮素联合顺铂对胃癌SGC-7901细胞增生和凋亡的影响. 世界华人消化杂志 2005; 13(3): 303-307
Revised: October 25, 2004
Accepted: November 4, 2004
Published online: February 1, 2005
AIM: To investigate the effects of quercetin combined with cisplatin on the proliferation and apoptosis of, and the expression of apoptosis-related gene Bcl-XL in human gastric cancer SGC-7901 cells.
METHODS: After treated with quercetin (QU), cisplatin (DDP) or both (QU-DDP), the viability of SGC-7901 cells was evaluated by MTT assay. Cell cycle distribution and apoptosis were detected by flow cytometry. Cell morphology was examined under light microscope and electron microscope. The expression of Bcl-XL mRNA was detected by the reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: After exposure to different drugs for 24 h, SGC-7901 cells manifested typical morphological features of apoptosis. Both DDP and QU inhibited the proliferation and induced the apoptosis of SGC7901 cells in a time and concentration-dependent manner. QU combined with DDP synergistically enhanced cell death. The apoptosis was more pronounced in cells treated with both drugs (QU: 1 mmol/L, DDP: 80 mmol/L) than DDP alone (80 mmol/L) (19.930.07 vs 5.160.11, P<0.01). After exposure to DDP for 48 h, Bcl-XL mRNA expression was down-regulated, which was promoted by QU.
CONCLUSION: QU combined with DDP effectively inhibits proliferation and induces apoptosis of the human gastric cancer SGC-7901 cells in vitro in a dose-dependent manner.
- Citation: Wang HZ, Wang Q. Effects of quercetin combined with cisplatin on proliferation and apoptosis of human gastric cancer SGC-7901 cells. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 303-307
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/303.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.303
胃癌是严重危害人类健康最常见的癌症之一[1-2], 占我国恶性肿瘤死亡率之首[3-4]. 槲皮素(quercetin, QU)是一种天然的黄酮类化合物, 化学名为3, 3', 4', 5, 7-五羟基黄酮, 广泛分布于蔬菜、水果、干果、饮料及中草药中. Erlund et al[5]研究表明, QU没有毒副作用. 1971年NCI首次发现槲皮素对P388白血病具有抑制作用, 近年来的研究表明QU在体外、体内动物实验模型中均显示出抗癌活性[6-9]. 我们观察槲皮素和顺铂联合使用对体外培养胃腺癌SGC-7901细胞增生和凋亡的影响, 并通过检测凋亡率和Bcl-XL mRNA的表达用药前后的变化, 探讨两种药物的合用是否可增强抗癌作用及可能的机制, 为临床治疗提供理论与实验依据.
人胃癌细胞株SGC-7901(中分化腺癌)购自中科院上海细胞生物研究所. RPMI 1640培养液和胰蛋白酶(Gibco), 小牛血清(杭州四季青公司), 噻唑兰(MTT)、二甲基亚砜(DMSO)及L-谷酰胺(Sigma), RNA提取液(Trizol, Life Technologies), RT-PCR试剂盒(Takara公司), 注射用顺铂(0.01 g/支, 山东齐鲁制药厂, 50 g/L葡萄糖溶, 培养基释)配制为1 mmol/L溶液存储在-4 ℃的冰箱内, 五羟黄酮(Sigma, DMSO溶, 培养基释)配制为0.1 mol/L 存储在-20 ℃的冰箱内待用, DMSO在递质中的浓度为0.2 g/L, 不影响细胞的正常生长[10]. 人胃癌SGC-7901细胞培养在含100 mL/L的灭活小牛血清、100 kU/L青霉素 G, 100 mmol/L链霉素和 2 mmol/L L-谷酰胺的 RPMI 1640完全培养基中, 置37 ℃, 50 mL/L CO2饱和湿度、1个大气压的孵箱内培养.
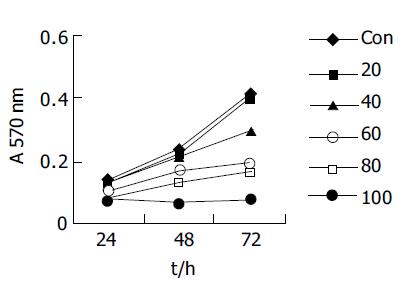
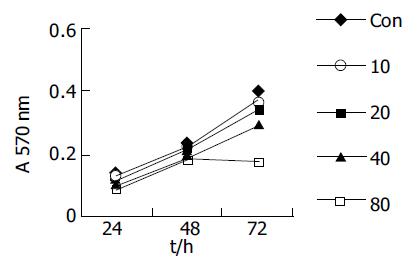
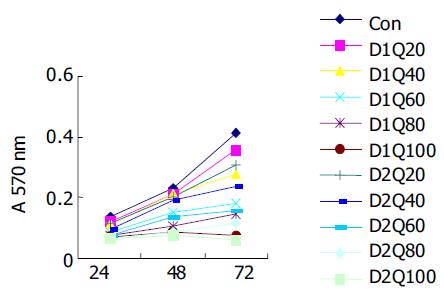
1.2.1 细胞增生: 单药处理: 取对数生长期细胞, 接种于96孔板, 调整细胞浓度为3104/孔, 培养24 h后, 加入不同浓度的处理因素(QU浓度分别为20, 40, 60, 80, 100 umol/L; DDP浓度分别为1, 2, 4, 8 μmol/L), 保持总体积为200 mL/孔, 每一剂量组设4个复孔. 同时设试验对照组: SGC-7901细胞+同等剂量的培养基. 分别于24, 48, 72 h加入MTT(5 g/L, 15 mL/孔), 继续培养4 h, 弃去培养液, 每孔加200 mL的DMSO/异丙醇(1:1)混合液, 以DMSO调零, 用酶联免疫检测仪以570 nm波长测定各孔的吸光度(A), 计算平均A值. 联合处理: 1, 2 mmol/L浓度的DDP分别与以上5种不同浓度的QU联合(QU在加入顺铂后40 min加入)培养, 其余具体步骤相同. 选择1, 2, 4 mmol/L浓度的DDP分别与20, 40, 80 mmol/L的QU联合处理并行台盼兰染色计算细胞活力, 按照 Chou et al[11]方法进行合成指数(CI)的计算, CI>1、CI = 1、CI<1分别代表拮抗、相加、协同效应. 形态学观察: 分别培养细胞至培养瓶70-80%铺满后, 根据加入的药物和浓度实验分4组: 对照组(未处理), 40, 80 mmol/L QU, 1 mmol/L DDP, 1 mmol/L DDP +40, 80 mmol/L QU, 继续培养24 h, 倒置显微镜下观察细胞形态变化; 收集单层附壁细胞爬片, 常规HE染色后观察. 方法同前, 24 h后收集细胞, 离心弃上清, 25 g/L戊二醛固定, 制备超薄切片, 双铅染色, 电镜(日本JEM100CX型)下观察并照相.
1.2.2 细胞周期和凋亡: 试验分组及前期处理同形态学观察, 收集药物处理后的胃癌细胞5105, PBS洗涤2次后, 用4 ℃乙醇固定12 h以上, 离心除去乙醇, 加入10 g/L RNA酶溶液200 mL, 37 ℃水浴15 min, 加入碘化丙啶, 室温下避光孵育15 min, 上流式细胞仪检测凋亡百分率和各细胞周期所占百分比. 实验重复3次. Bcl-XL mRNA表达的前期处理同形态学观察, 实验分为对照组(未处理), 1 mmol/L DDP, 60 mmol/L QU, 1 mmol/L DDP +60 mmol/L QU, 收获1106细胞, 按照试剂盒操作说明用RNA提取液(Trizol)提取总RNA, 逆转录合成cDNA, Bcl-XL引物序列: 5'-CAATGGACTGGTGAGCCCA-3'和5'-AGTTCAAACTCGTCGCCTG-3', 307 bp; 内参β-actin(b-2 mic roglubulin)引物序列为: 5'-ACCCCCACTGAAAAAGATGA-3'和5'-ATCTTCAAACCTCCATGATG-3', 120 bp. 扩增条件: 94 ℃预变性5 min, 94 ℃变性1 min, 56 ℃退火1 min, 72 ℃延伸1 min, 35个循环后, 72 ℃延伸10 min. PCR 产物5 mL在2 g/L琼脂糖上电泳(含0.5 mg/L溴化乙锭), 经凝胶图像分析仪分析结果, 将Bcl-XL和β-actin的比值做为Bcl-XL表达的参数, 对Bcl-XL的PCR产物进行相对定量, 取未处理的SGC-7901细胞做对照, 实验重复3次.
统计学处理 采用SPSS 10.0进行作图和统计分析, 吸光度(A)用方差分析, 均数比较用t检验.
QU或DDP(单位mmol/L)单药作用后出现相似的影响结果: 同一时间点不同浓度组A值不同, 趋势均为高浓度组低于低浓度组; 同一浓度不同时间点A值不同, 所有浓度下均为随着时间的延长, A值逐渐增大(图1-2). 24 h时低浓度之间或高浓度之间(QU20与40, 80与100; DDP1与2, 4与8)A值差别无统计学意义; 随着时间延长, 低浓度组(QU 20及40; DDP 1, 2)与对照组A值差别无统计学意义; 不同的是在48 h处, QU4与QU 8 A值差别无统计学意义; 但在72 h处, 对照组与DDP4 A值差别无统计学意义, 对照组与QU 40 mmol/L A值有差别性, 其余两浓度组间均有显著差别. QU与DDP联合使用的交互作用有统计学意义(P<0.0 001), 固定DDP浓度下不同浓度QU组A值不同, DDP1时, QU五个浓度组间A值差别均有统计学意义; DDP2时, QU80与100间A值差别无统计学意义; 趋势均为高浓度组低于低浓度组. 固定QU浓度下DDP不同浓度组A值不同, QU2时, DDP1与DDP 2间A值差别无统计学意义; 其余两浓度组间差别均有统计学意义, 趋势均为高浓度组低于低浓度组(图3). 联合处理组按照 Chou et al方法进行合成指数(CI)的计算CI<1提示二者之间具有协同效应(表1).
| Agent(umol/L) | Viability(%) | CI |
| DDP1+Q20 | 73.4±5.6 | 0.484 |
| DDP1+Q40 | 41.5±3.4 | 0.631 |
| DDP1+Q80 | 35.2±2.7 | 0.628 |
| DDP2+Q20 | 63.8±4.5 | 0.628 |
| DDP2+Q40 | 56.1±2.9 | 0.598 |
| DDP2+Q80 | 35.5±1.08 | 0.674 |
| DDP4+Q20 | 45.2±3.2 | 1.042 |
| DDP4+Q40 | 31.5±1.02 | 0.998 |
| DDP4+Q80 | 21.4±0.4 | 0.954 |
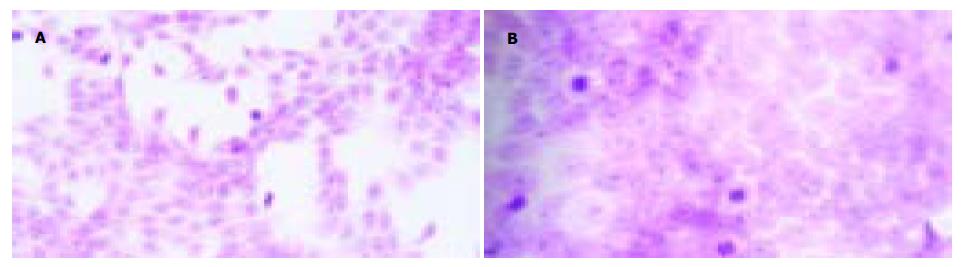
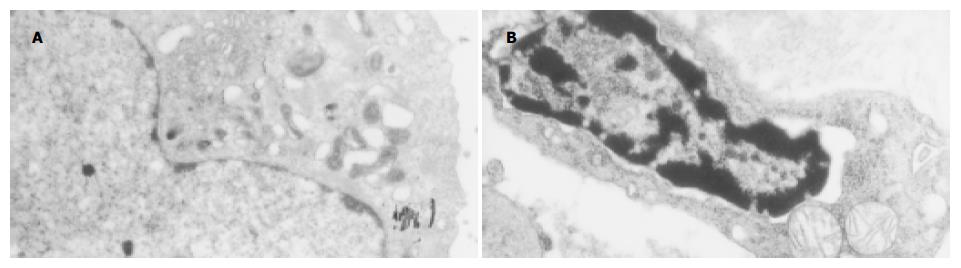
光镜下未处理组细胞形态呈多角形、圆形、细胞体积大, 边缘不清, 多形性明显, 胞质较丰富饱满而透亮; 核大小不一, 可见核分裂、双核及核仁; 细胞生长紧密甚至呈堆叠生长(图4A). QU与DDP处理组细胞形态变化明显, 由多角形为主变为形态一致、以梭形为主, 胞质丰富透亮, 可见部分圆形漂浮的细胞, 其胞质内见许多颗粒; 大部分细胞体积小, 贴壁紧密, 分散存在, 细胞境界清楚; 细胞核明显变小(图4B). 透射电镜证实, 正常细胞的细胞膜完整, 细胞核和细胞器等结构清晰(图5A), 药物处理后24 h开始出现较为典型的细胞凋亡的形态学变化: 胞质浓缩, 内质网变疏松并与细胞膜融合, 形成空泡, 晚期核碎裂, 染色质片断化, 产生凋亡小体等(图5B).
药物作用24 h后, 流式细胞仪检测凋亡率和细胞周期分布, 可见细胞凋亡率明显增加, 且联合组细胞凋亡率明显高于单药组及对照组(P<0.01). 对细胞周期分布的影响: 单独使用QU使SGC-7901细胞G2/M期明显增多, S和G0/G1期细胞减少; SGC-7901细胞被顺铂阻滞在S和G2/M期; 联合使用QU和顺铂治疗组细胞的增生周期均有不同程度的下降(表2).
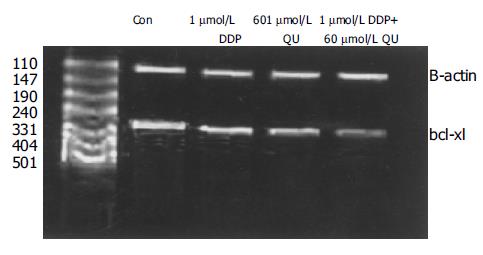
RT-PCR产物电泳显示, 药物作用48 h后, 对照组和处理组在307 bp处均出现特异性Bcl-XL条带, 实验组Bcl-XL mRNA的表达均达明显低于对照组(P<0.05, 图6). 经凝胶图像分析仪分析结果, 将Bcl-XL和β-actin的比值做为Bcl-XL表达的参数, 对Bcl-XL的PCR产物进行相对定量, 对照0.95±0.04, DDP1 0.65±0.02, QU60 0.54±0.02, 联合用药组0.18±0.01降低较单药显著(P<0.05).
肿瘤细胞的增生与其丧失凋亡能力有关[12-16], 并且存在多种因素导致了肿瘤细胞凋亡能力的丧失, 逃避凋亡机制的调控在肿瘤细胞对常规化疗药物耐药中起关键作用[17-18]. 临床上许多患者在确诊时已丧失了手术机会, 而化疗和放疗的效果不佳、毒副作用较大. 因此, 寻找一种高效低毒的药物作为化疗治疗或是辅助治疗晚期肿瘤就是许多学者研究的方向[19]. 我们采用体外细胞培养的方法研究发现, 微摩尔浓度槲皮素能明显抑制体外培养的胃癌SGC-7901细胞的生长, 且其抑制细胞增生在一定范围内, 随槲皮素的浓度而增加, 作用时间延长, 细胞增生抑制率相应增加, 具有时效及量效关系, 这一浓度约在20-100 mmol/L之间, 高于此浓度抑制作用太强, 细胞难以增生; 低于此浓度则基本没有显示抑制增生作用, 而且可能有部分的增强效应(未报告数据). MTT试验证实随时间的延伸, 低浓度QU时间效应逐渐消失, 但在72 h处, 40 mmol/L组与对照组再次出现显著性差异, 机制不明, 较高浓度组的时间效应比较明显. 经DDP处理的SGC-7901细胞, 量效关系比较明显, 较高浓度组有一定的时间相关性, 而低浓度组(1、2)随着作用时间的延长, 48 h后1, 2 mmol/L组与对照组比较差异性消失, 72 h后4 mmol/L组与对照组比较差异性也消失, 这可能与肿瘤细胞的耐药机制产生有关. 联合使用QU后良效关系仍然存在, 时间效应则一直延续到72 h后, 表明QU可以加强顺铂的抑制增生效应, 也可能部分的对抗肿瘤细胞的耐药性. 同时经过台盼兰染色计算活细胞数目使用合用指数分析二者之间的确存在一定范围内的协同效应, 说明QU联合DDP治疗胃癌可能起到增效、减毒作用, 这一结论与文献[20]报道基本一致.
QU可诱导白血病细胞、大肠癌细胞、肝癌细胞凋亡. 在我们的实验中, 经HE染色和电子显微镜检查, 单独或联合处理24 h开始出现凋亡的形态学改变, 并随药物浓度、联合作用、时间凋亡细胞明显增多, HE染色和电子显微镜均可观察到较为典型的细胞凋亡过程的形态学改变. 流式细胞仪检查在DNA直方图上G1峰前出现凋亡峰, 细胞周期分析表明, 单独使用QU使SGC-7901细胞G2/M期明显增多, S和G0/G1期细胞减少; SGC-7901细胞被顺铂阻滞在S和G2/M期; 联合使用QU和顺铂治疗组细胞的增生周期均有不同程度的下降, 细胞凋亡率明显高于DDP同一浓度的单独使用, 表明QU可以通过加强DDP诱导凋亡的途径抑制肿瘤细胞的生长, 具有抗增生促凋亡作用[14].
近年来, 关于bcl-2基因家族与肿瘤细胞凋亡的关系已成为新的研究热点[21-22], Bcl-XL是bcl-2基因家族中Bcl-X两种亚型之一[23], Bcl-XL cDNA编码一种含233个氨基酸的蛋白质, 其分子质量为21 ku, 能够抑制不同细胞中由多种刺激所诱发的凋亡, 其抑制凋亡的作用明显强于bcl-2和其他bcl-2家族成员, 在调控许多细胞群的凋亡中发挥着更为重要的作用[24-25]. 许多肿瘤细胞, 包括胃癌[26]Bcl-XL表达升高, 肿瘤细胞凋亡减少、增值明显以及耐药的产生可能与此有关. 我们的研究发现, 实验组Bcl-XL mRNA的表达均达明显低于对照组, 且QU具有加强DDP下调Bcl-XL mRNA的表达的作用, 这可能是QU抗肿瘤的作用机制之一.
编辑: 潘伯荣 审读:张海宁
| 1. | Yin T, Ji XL, Shen MS. Relationship between lymph node sinuses with blood and lymphatic metastasis of gastric cancer. World J Gastroenterol. 2003;9:40-43. [PubMed] [DOI] |
| 2. | Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2:533-543. [PubMed] [DOI] |
| 3. | Deng DJ. Overview on recent studies of gastric carcinogenesis: human exposure of N-nitrosamides. Shijie Huaren Xiaohua Zazhi. 2000;8:250-252. |
| 4. | Zhao GH, Li TC, Shi LH, Xia YB, Lu LM, Huang WB, Sun HL, Zhang YS. Relationship between inactivation of p16 gene and gastric carcinoma. World J Gastroenterol. 2003;9:905-909. [PubMed] [DOI] |
| 5. | Erlund I, Kosonen T, Alfthan G, Mäenpää J, Perttunen K, Kenraali J, Parantainen J, Aro A. Pharmacokinetics of quercetin from quercetin aglycone and rutin in healthy volunteers. Eur J Clin Pharmacol. 2000;56:545-553. [PubMed] [DOI] |
| 6. | López-Lázaro M. Flavonoids as anticancer agents: structure-activity relationship study. Curr Med Chem Anticancer Agents. 2002;2:691-714. [PubMed] [DOI] |
| 7. | Ranelletti FO, Maggiano N, Serra FG, Ricci R, Larocca LM, Lanza P, Scambia G, Fattorossi A, Capelli A, Piantelli M. Quercetin inhibits p21-RAS expression in human colon cancer cell lines and in primary colorectal tumors. Int J Cancer. 2000;85:438-445. [PubMed] [DOI] |
| 8. | Shi M, Wang FS, Wu ZZ. Synergetic anticancer effect of combined quercetin and recombinant adenoviral vector expressing human wild-type p53, GM-CSF and B7-1 genes on hepatocellular carcinoma cells in vitro. World J Gastroenterol. 2003;9:73-78. [PubMed] [DOI] |
| 9. | Di Carlo G, Mascolo N, Izzo AA, Capasso F. Flavonoids: old and new aspects of a class of natural therapeutic drugs. Life Sci. 1999;65:337-353. [PubMed] [DOI] |
| 10. | Courage C, Budworth J, Gescher A. Comparison of ability of protein kinase C inhibitors to arrest cell growth and to alter cellular protein kinase C localisation. Br J Cancer. 1995;71:697-704. [PubMed] [DOI] |
| 11. | Chou TC, Talalay P. Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv Enzyme Regul. 1984;22:27-55. [PubMed] [DOI] |
| 12. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 13. | Tao HQ, Zou SC. Effect of preoperative regional artery chemotherapy on proliferation and apoptosis of gastric carcinoma cells. World J Gastroenterol. 2002;8:451-454. [PubMed] [DOI] |
| 14. | Liu S, Wu Q, Ye XF, Cai JH, Huang ZW, Su WJ. Induction of apoptosis by TPA and VP-16 is through translocation of TR3. World J Gastroenterol. 2002;8:446-450. [PubMed] [DOI] |
| 15. | Wu YL, Sun B, Zhang XJ, Wang SN, He HY, Qiao MM, Zhong J, Xu JY. Growth inhibition and apoptosis induction of Sulindac on Human gastric cancer cells. World J Gastroenterol. 2001;7:796-800. [PubMed] [DOI] |
| 16. | Huang J, Cai MY, Wei DP. HLA class I expression in primary hepatocellular carcinoma. World J Gastroenterol. 2002;8:654-657. [PubMed] [DOI] |
| 19. | Kasibhatla S, Tseng B. Why target apoptosis in cancer treatment? Mol Cancer Ther. 2003;2:573-580. [PubMed] |
| 20. | Cipák L, Rauko P, Miadoková E, Cipáková I, Novotný L. Effects of flavonoids on cisplatin-induced apoptosis of HL-60 and L1210 leukemia cells. Leuk Res. 2003;27:65-72. [PubMed] [DOI] |
| 21. | Pellecchia M, Reed JC. Inhibition of anti-apoptotic Bcl-2 family proteins by natural polyphenols: new avenues for cancer chemoprevention and chemotherapy. Curr Pharm Des. 2004;10:1387-1398. [PubMed] [DOI] |
| 22. | Xu AG, Li SG, Liu JH, Gan AH. Function of apoptosis and expression of the proteins Bcl-2, p53 and C-myc in the development of gastric cancer. World J Gastroenterol. 2001;7:403-406. [PubMed] [DOI] |
| 23. | Ogata Y, Takahashi M. Bcl-xL as an antiapoptotic molecule for cardiomyocytes. Drug News Perspect. 2003;16:446-452. [PubMed] [DOI] |
| 24. | Ochs K, Kaina B. Apoptosis induced by DNA damage O6-methylguanine is Bcl-2 and caspase-9/3 regulated and Fas/caspase-8 independent. Cancer Res. 2000;60:5815-5824. [PubMed] |
| 25. | Iwata M, Harada K, Kono N, Kaneko S, Kobayashi K, Nakanuma Y. Expression of Bcl-2 familial proteins is reduced in small bile duct lesions of primary biliary cirrhosis. Hum Pathol. 2000;31:179-184. [PubMed] [DOI] |