修回日期: 2004-11-07
接受日期: 2004-11-17
在线出版日期: 2005-02-01
目的: 研究二烯丙基二硫(DADS)诱导人胃癌MGC803细胞分化作用及其机制.
方法: 采用ConA凝集实验、碱性磷酸酶(ALP)比活性测定、免疫荧光染色细胞化学、免疫细胞化学及划痕标记荧光染料示踪技术(SLDT)等方法, 观察DADS诱导人胃癌MGC803细胞分化的作用.
结果: 人胃癌MGC803细胞对ConA的凝集率从79.1%下降为27.0%(χ2 = 29.78, P<0.05); ALP比活性由2.00 nkat/g降至0.67 nkat /g(F = 207.6, P<0.05), 下降率为66.1%; 细胞骨架蛋白呈细丝状, 由胞核向胞质规则、放射状伸展, 表明其合成增加与重组; SLDT表明人胃癌MGC803细胞不显示荧光染料的传播, 失去细胞间通讯功能, DADS处理后黄色荧光分布在伤沿细胞列和相邻的数列细胞内, 表示细胞间通讯功能恢复. 免疫细胞化学结果显示, p21WAF1表达增加, 突变型p53、Ras-p21、C-myc表达降低, 而pRb表达无改变.
结论: DADS可以诱导MGC803细胞分化, 癌基因与抑癌基因在此过程中起着重要作用.
引文著录: 凌晖, 张良运, 梁晓秋, 宋颖, 周建国, 苏琦. 二烯丙基二硫诱导人胃癌MGC803细胞的分化. 世界华人消化杂志 2005; 13(3): 294-298
Revised: November 7, 2004
Accepted: November 17, 2004
Published online: February 1, 2005
AIM: To explore the differentiation induced by diallyl disulfide (DADS) of human gastric carcinoma MGC803 cell line.
METHODS: The DADS-induced differentiation of human gastric carcinoma MGC803 cells was examined by means of ConA-mediated cell agglutination, alkaline phosphatase activity detection, cytochemical and immunocytochemical staining, and scrape-loading/dye transfer technique (SLDT).
RESULTS: After treated with DADS, ConA-mediated cell agglutination rate was significantly decreased (79.1% vs 27.0%, P<0.05). Specific alkaline phosphatase activity was decreased by 66.1%, from 2.00 nkat/g to 0.67 nkat /g (F = 207.6, P<0.05). Filament-like cytoskeleton protein radiated regularly from the nuclei into cytoplasm, indicating its increased synthesis and reconstruction. SLDT revealed no dye transfer among MGC803 cells in the absence of DADS, while positive transfer of LY dye was found among the cells in the presence of DADS, suggesting that intercellular communication was restored. Immunocytochemisty showed that p21WAF1 expression was increased, with mutant p53, Rasp21 and C-myc expression decreased and pRb unchanged.
CONCLUSION: DADS can induce differentiation of MGC803 cells, in which oncogenes and anti-oncogenes may play important roles.
- Citation: Ling H, Zhang LY, Liang XQ, Song Y, Zhou JG, Su Q. Diallyl disulfide induces differentiation of human gastric carcinoma MGC803 cell line. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 294-298
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/294.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.294
二烯丙基二硫(diallyl disulfide, DADS)是大蒜中的一种脂溶性的有效成分, 对白血病[1]、乳腺癌[2]、肝癌[3]和神经胶质瘤[4]等多种肿瘤均有明显的抑制作用, 是一种很有开发潜力的抗肿瘤药物. 我们已发现二烯丙基二硫诱导了人白血病HL-60细胞分化[5]; 能显著抑制人胃癌MGC803细胞增生[6], 并且通过激活p38通路引起细胞周期G2/M期阻滞[7-9], 同时对小鼠肾包膜下移植人胃癌细胞的生长起抑制作用[10]. 现观察不同浓度的DADS对体外培养的人胃癌MGC803细胞的诱导分化作用.
MGC803细胞为人胃低分化黏液癌, 山东师范大学生物系建株, 从湖南医科大学肿瘤所引进. DADS为Fluka公司产品(d420 = 1.0, Mr146.28, 纯度80%, 含10-20%DAS). ConA, 抗管蛋白抗体a-Tubulin, FITC-羊抗兔IgG二抗和Lucifer Yellow均为Sigma产品. 双缩脲法检测试剂盒碱性磷酸酶检测试剂盒为南京建成生物工程公司生产. p21WAF1, p53, Rasp21, C-myc, pRb(均为鼠抗mAb), UltrasensitiveTMS-P Kit和DAB Kit均购于福州迈新公司. 细胞用含100 mL/L小牛血清的RPMI1640培养液置37 ℃, 含50 mL/L CO2, 恒湿、恒温培养箱中培养. 取对数生长期细胞, 按所需细胞浓度接种于培养瓶或培养板内, 待细胞完全贴壁6 h后, 换用含或不含药物的培养液培养至预定时间. 实验设立不同浓度的DADS以及常规培养的阴性对照组.
1.2.1 ConA凝集性实验: 将培养至预定时间的细胞消化, 吹打并两次通过7号针头, 调整细胞密度为108/L, 另用PBS将ConA稀释终浓度为25、50、100、200 mg/L. 分别取0.1 mL ConA/PBS液与等量细胞悬液混合于96孔板内, 每剂量4复孔, 充分振荡后, 静置观察细胞凝集现象, 分别记录ConA浓度为100 mg/L时凝集细胞数. 根据公式: 细胞凝集率(%) = (无ConA时单细胞数-有ConA时单细胞数)/无ConA时单细胞数100%
1.2.2 间接免疫荧光染色: 盖片培养细胞经0.01 mol/L pH7.4 PBS洗去培养液, 滤纸吸去水分, 空气中干燥, 立即投入冷氯仿: 甲醇(V:V, 2:1)混合液内, 在-5 ℃以下固定20 min后, 空气中干燥; 滴加3 g/L Triton X-100/PBS液制成的不同稀释度的抗管蛋白抗体a-Tubulin, 密闭容器内37 ℃温育1 h; 取出盖片, PBS洗去残留的抗体, 再按PBS→1%Triton X-100/PBS→PBS顺序洗涤, 每次5 min; 吸水干燥; 滴加FITC-羊抗兔IgG二抗(用前以1 g/LTriton X-100/PBS液稀释), 37 ℃温育1 h; PBS洗去残留的抗体, 同前洗涤, 最后盖片过一次去离子水, 洗去盐分, 干燥; 用甘油/PBS液封固盖片, Leitz落射荧光显微镜观察和照相.
1.2.3 考马斯亮蓝染色: 盖片培养细胞经25 g/L戊二醛固定15 min后, 三蒸水洗3次5 min, 用考马斯亮蓝染液染色1 h, 镜下观察细胞颜色变深后, 倾去染液, 同前洗涤, 甲醇醋酸分化液分化, 镜下观察细胞内微丝明显、背景清晰时即终止分化, 三蒸水洗3次5 min; 酒精梯度脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察.
1.2.4 碱性磷酸酶比活性测定: 准备样本, 常规胰酶消化制成单细胞悬液, 1 000 r/min离心10 min; PBS液重悬细胞, 1 000 r/min离心10 min, 重复1次; 然后加入2.5 g/L脱氧胆酸钠/PBS液0.5 mL裂解细胞. 测定前将细胞裂解混合液1 500 r/ min离心15 min, 取上清进行测定. 按蛋白总量(双缩脲法)检测试剂盒进行检测蛋白总量, 蛋白总含量计算: 蛋白总含量(g/L) = 测定管吸光度/标准管吸光度幢曜脊芘ǘ(g/L)(紫外分光光度计Perklin elmer lambda bio 2.2, PE com USA). 按ALP检测试剂盒进行检测ALP活性, 根据公式计算: ALP(nkat/L) = 测定管吸光度/标准管吸光度捶雍(0.005)×稀释倍数(100/0.05)(以吸光度为纵坐标, 酶活力单位为横坐标绘制ALP活性标准曲线). ALP比活性 = ALP酶活力/细胞蛋白总量.
1.2.5 细胞间缝隙连接通讯功能检查采用划痕标记荧光染料示踪技术: 常规消化传代, 接种细胞于6孔培养板内培养, 至细胞生长达密度饱和; 除去培养基, 室温下以PBS洗3次, 细胞浸在2 mL含0.5 g/L Lucifer Yellow的PBS液中; 用手术刀片轻轻划痕数条, 计时, 标记3 min; 吸尽荧光染液, 以PBS洗3-4次以去尽游离的剩余染料; 细胞浸于PBS液内; 沿划痕线观察沿线细胞导入荧光物质情况, 并用荧光显微镜测定细胞间荧光染料扩散程度.
1.2.6 免疫细胞化学: 载玻片先用多聚L-赖胺酸处理, 石蜡切片脱蜡入水后, 用柠檬酸缓冲液直接煮沸法进行抗原修复. 0.01 mol/L pH7.2 PBS冲洗3次, 每次5 min; 每张切片加过氧化酶阻断剂50 mL, 室温孵育10 min; PBS冲洗3次, 每次5 min; 每张切片加非免疫性动物血清50 mL, 室温孵育5 min; PBS洗1次5 min; 每张切片加一抗50 mL, 4 ℃过夜; PBS洗3次5 min; 每张切片加链霉素抗生物素蛋白-过氧化酶溶液50 mL, 室温孵育10 min; PBS洗3次5 min; 每张切片加新鲜配制的DAB溶液100 mL, 显色5-10 min; 自来水冲洗, 苏木素浅染, 酒精脱水, 二甲苯透明, 中性树胶封片.
统计学处理 采用SPSS 10.0 统计学软件进行χ2检验和方差分析, P<0.05为差异有显著性统计学意义.
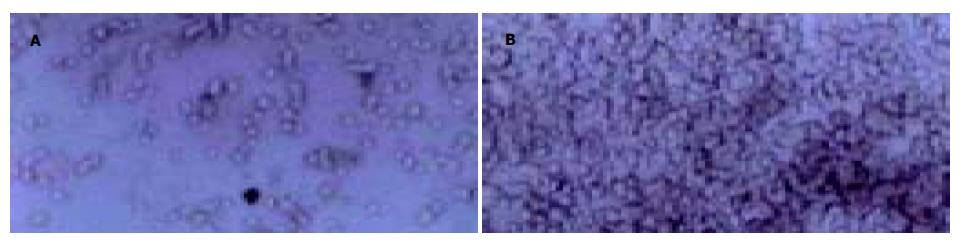
ConA借助细胞表面的凝集素受体介导细胞间的凝集反应, MGC803细胞对ConA的凝集率间接反映细胞表面微绒毛数量. 结果显示, DADS浓度由35 mg/L降至20 mg/L时, MGC803细胞对ConA的凝集率(图1)则由27.0%递增至37.5%, 表现出浓度依赖性; χ2检验, 各组间两两比较均有显著性差异(χ2 = 29.78, P<0.05, 表1).
| MGC80 | DADS(mg/L) | ||||
| 3 | 20 | 25 | 30 | 35 | |
| 有ConA单细胞数 | 28 | 150 | 68 | 59 | 46 |
| 无ConA单细胞数 | 134 | 240 | 105 | 85 | 63 |
| 细胞凝集率(%) | 79.1 | 37.5 | 35.2 | 30.6 | 27.0 |
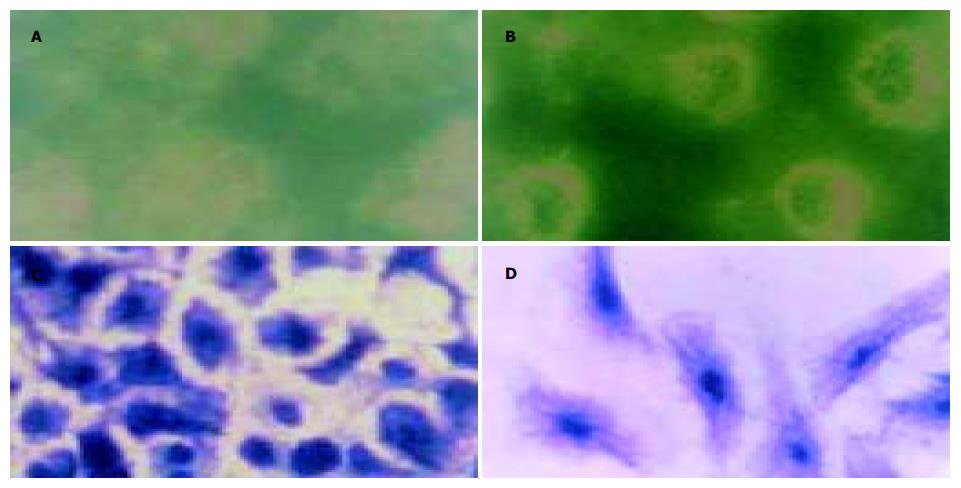
间接免疫荧光染色显示, 未处理组MGC803细胞微丝微管蛋白荧光微弱; DADS处理的MGC803细胞内荧光增强, 呈花环样围绕胞核分布; 考马斯亮蓝染色则证实, 细胞内骨架蛋白呈细丝状, 从胞核表面向胞质胞膜呈放射状伸展, 表明处理后的MGC803细胞骨架蛋白重新合成与组装(图2).
未处理组MGC803细胞内ALP比活性为2.00 nkat/g, 20-35 mg/LDADS处理后, 细胞内ALP比活性由1.70 nkat/g下降至0.67 nkat/g(F = 207.6, P<0.05), 下降率为15.7%至66.1%, 表明DADS具有抑制MGC803细胞内ALP比活性的作用, 并呈现浓度依赖效应(表2).
| MGC803 | DADS(mg/L) | ||||
| 细胞 | 20 | 25 | 30 | 35 | |
| ALP比活性 | 0.120 | 0.102 | 0.066 | 0.059 | 0.040 |
| 比活性下降率(%) | 15.7 | 15.5 | 51.2 | 66.1 | |
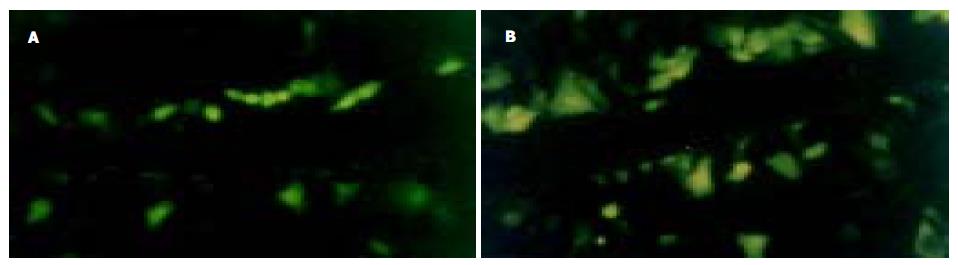
划痕标记后数分钟即可观察到黄色荧光传播. 人胃癌MGC803细胞不显示荧光染料的传播, 表明无间缝隙连接通讯功能; DADS处理后黄色荧光分布在伤沿细胞列和相邻的数列细胞内, 表示有间缝隙连接通讯功能, 荧光强度从伤沿细胞列到临近数列细胞逐渐减弱, 以伤沿细胞列最强(图3).
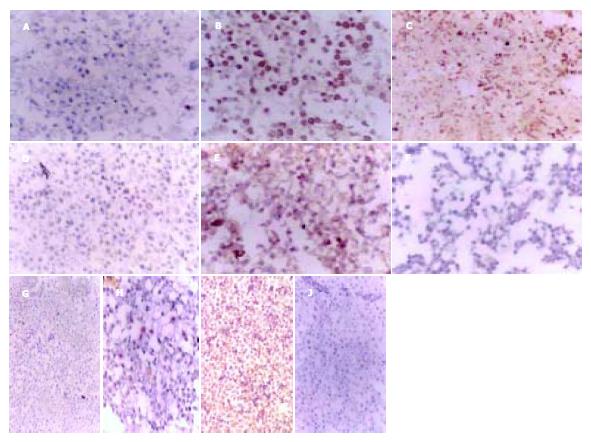
DADS作用后的MGC803细胞, 其癌基因与抑癌基因的表达发生如下变化: P21WAF1表达增加, 突变型P53、Rasp21、C-myc表达降低, 而pRb表达无改变(图4).
研究证实, 二烯丙基二硫(DADS)可促进过氧化氢产生, caspase-3活化及DNA降解, 从而诱导白血病HL-60细胞凋亡[1], 通过诱导乳腺癌细胞凋亡抑制癌细胞增生[2], 并可通过增进胞核中组蛋白乙酰化, 促进大鼠肝癌细胞分化[3], 可使H-ras表达下降抑制神经胶质瘤细胞增生[4]. DADS抑制MGC803细胞生长是由于细胞增生速度的减慢而不是因为DADS直接杀伤细胞, 使进入分裂增生的细胞数量减少, 我们观察到ConA凝集性实验发现DADS处理后细胞恶性行为下降; DADS处理的MGC803细胞出现微丝微管合成增加与重组装, 呈现规则的放射状分布, 提示瘤细胞恶性表型下降和去恶化. 研究表明, DADS可增加鼠肝细胞的细胞间通讯功能[11]; 维生素D3 可以通过维持细胞间通讯预防肾细胞癌变[12]. 本实验结果显示, 人胃癌细胞无荧光染料的传播, 表明其缺乏细胞间缝隙连接通讯功能, 证实人胃癌细胞连接通讯抑制, 与癌细胞增生的失控有关. DADS处理人胃癌MGC803细胞后, 在伤沿细胞列和相邻的数列细胞内出现黄色荧光, 并且, 荧光强度从伤沿细胞列到临近数列细胞表现级差, 以伤沿细胞列最强, 提示DADS抑制细胞增生与其诱导的细胞间缝隙连接通讯功能恢复有关. 肿瘤细胞的恶性表现还与细胞代谢失调密切相关. 在胃癌及其癌前病变的酶学研究中发现, ALP(碱性磷酸酶)是胃癌细胞分化的一种标志酶. 本研究显示, DADS可使MGC803细胞的ALP活性呈现不同程度下降, 且随DADS浓度的升高, ALP比活性亦随之下降, 提示MGC803细胞在DADS作用后发生了再分化而向正常细胞方向发展.
癌基因与抑癌基因在细胞分化过程中起着重要作用. p53基因是与人类肿瘤关系最密切的抑癌基因之一, 他是癌症治疗中关键的靶子[13-14], 通过调节细胞凋亡过程[15-16]及肿瘤细胞分化[17-19]起作用. 野生型 p53可增加人肝癌Bel7402/5-FU耐药细胞株的化疗敏感性[20]. p21WAF1是p53的一个下游基因, p21蛋白的表达与p53的表达刚好相反, 但分化细胞中p21的表达并不必定反映p21在细胞分化过程中的作用, 他的表达与生长抑制有关且早于终末分化. β-catenin通过激活化 p53-p21WAF1 通路诱导子宫内膜癌细胞分化[21]. 另一个抑癌基因Rb使细胞由G1期进入S期, 三者之间相互调节. c-Myc蛋白属即刻早期应答基因的编码产物, 在细胞处于G0期向G1期过渡时已有表达且一直持续到DNA合成期, 使G1期持续时间缩短而加速进入S期, 是G1期的"进展因子"反义寡核苷酸抑制人肝癌HepG2 和 Morris 5123 细胞生长过程中c-Myc表达下调. (非类固醇抗炎药)通过上调c-Myc表达诱导人胃癌细胞凋亡. Ras基因在细胞的恶性转化过程中的作用机制复杂并表现与c-Myc基因协同作用. p53介导的G1/S期监测点机制中, p53上游的信号传导在H-ras转导的细胞中保持正常, 但其下游的信号传导通路则被改变. 本实验中检测到p21WAF1、pRb表达增强, 突变型p53、p21ras、c-Myc表达减弱表明他们在MGC803细胞周期演进中有着积极作用并最终诱导细胞分化.
编辑: 潘伯荣 审读:张海宁
| 1. | Kwon KB, Yoo SJ, Ryu DG, Yang JY, Rho HW, Kim JS, Park JW, Kim HR, Park BH. Induction of apoptosis by diallyldisulfide through activation of caspase-3 in human leukemia HL-60 cells. Bioch Pharmacol. 2002;63:41-47. [PubMed] [DOI] |
| 2. | Nakagawa H, Tsuta K, Kiuchi K, Senzaki H, Tanaka K, Hioki K, Tsubura A. Growth inhibitory effects of diallyl disulfideon human breast cancer cell lines. Carcinogenesis. 2001;22:891-897. [PubMed] [DOI] |
| 3. | Lea MA, Randolph VM. Induction of histone acetylation in rat liver and hepatoma by organosulfur compoundsincluding diallyl disulfide. Anticancer Res. 2001;21:2841-2845. [PubMed] |
| 4. | Perkins E, Calvert J, Lancon JA, Parent AD, Zhang J. Inhibition of H-ras as a treatment for experimental brain C6glioma. Brain Res Mol Brain Res. 2003;111:42-51. [PubMed] [DOI] |
| 9. | Yuan JP, Wang GH, Ling H, Su Q, Yang YH, Song Y, Tang RJ, Liu Y, Huang C. Diallyl disulfide-induced G2/M arrest ofhuman gastric cancer MGC803 cells involves activation of p38 MAP kinase pathways. World J Gastroenterol. 2004;10:2731-2734. [PubMed] [DOI] |
| 10. | 刘 瑶, 黄 卫国, 袁 静萍, 黄 琛, 唐 荣军, 宋 颖, 周 秀田, 凌 晖, 何 洁, 苏 琦. 二烯丙基二硫对小鼠肾包膜下移植人胃癌细胞的生长抑制作用. 中国药理学通报. 2004;20:835-836. |
| 11. | Huard C, Druesne N, Guyonnet D, Thomas M, Pagniez A, Le Bon AM, Martel P, Chaumontet C. Diallyl disulfide(DADS) enhances gap-junctional intercellular communication by both direct and indirect mechanisms in rat liver cells. Carcinogenesis. 2004;25:91-98. [PubMed] [DOI] |
| 12. | Fujioka T, Suzuki Y, Okamoto T, Mastushita N, Hasegawa M, Omori S. Prevention of renal cell carcinoma byactive vitamin D3. World J Surg. 2000;24:1205-1210. [PubMed] |
| 13. | Bottone FG Jr, Baek SJ, Nixon JB, Eling TE. Diallyl disulfide (DADS) induces the antitumorigenic NSAID-activatedgene (NAG-1) by a p53-dependent mechanism in human colorectal HCT 116 cells. J Nutr. 2002;132:773-778. [PubMed] |
| 14. | Salvatella X, Martinell M, Gairi M, Mateu MG, Feliz M, Hamilton AD, De Mendoza J, Giralt E. A tetraguanidiniumligand binds to the surface of the tetramerization domainof protein p53. Angewandte Chemie. 2004;43:196-198. [PubMed] [DOI] |
| 15. | Li PX, Wong J, Ayed A, Ngo D, Brade AM, Arrowsmith C, Austin RC, Klamut HJ. Placental transforming growthfactor-beta is a downstream mediator of the growth arrest and apoptotic response of tumor cells to DNA damage andp53 overexpression. J Biol Chem. 2000;275:20127-20135. [PubMed] [DOI] |
| 16. | Hsu YL, Kuo PL, Chiang LC, Lin CC. Isoliquiritigenin inhibits the proliferation and induces the apoptosis of humannon-small cell lung cancer a549 cells. Clin Exp Pharmacol Physiol. 2004;31:414-418. [PubMed] [DOI] |
| 17. | May P, May E. Twenty years of p53 research: structural and functional aspects of the p53 protein. Oncogene. 1999;18:7621-7636. [PubMed] [DOI] |
| 18. | Gonda G, Bajtai A, Nagy P, Szanto I, Kiss J. Quantitative analysis of p53 expression and cell proliferation ingastric carcinomas. An immunohistochemical study. Hepatogastroen-terology. 2004;51:273-276. [PubMed] |
| 19. | Amannllah A, Liebermann DA, Hoffman B. P53-independent apoptosis associated with c-Myc-mediated block inmyeloid cell differentiation. Oncogene. 2000;19:2967-2977. [PubMed] [DOI] |
| 20. | Li YX, Lin ZB, Tan HR. Wild type p53 increased chemosensitivity of drug-resistant humanhepatocellular carcinomaBel7402/5-FU cells. Acta Pharmacol Sin. 2004;25:76-82. [PubMed] |
| 21. | Saegusa M, Hashimura M, Kuwata T, Hamano M, Okayasu I. β-catenin simultaneously induces activation of thep53-p21waf1 pathway and overexpression of cyclin D1 during squamous differentiation of endometrial carcinoma cells. Am J Pathol. 2004;164:1739-1749. [PubMed] [DOI] |