基于活性肝细胞为主要生物成分的肝细胞治疗学已逐渐成为治疗肝衰竭及先天性肝脏代谢性疾病的重要手段, 但其关键是获得理想的肝细胞材料. 肝细胞永生化是解决肝细胞来源的重要途径之一, 这一领域的研究进展较为迅速. 目前已经建立的肝细胞株包括肿瘤源性肝细胞株、由正常肝细胞经胶原凝胶夹心培养系统培养后而获得的肝细胞株、由正常肝细胞经转染/转导而获得的肝细胞株, 以及p53或p19基因敲除而建立的肝细胞株等. 上述肝细胞株多由肝肿瘤细胞衍变而来或经病毒转导而获得, 因此存在安全性之虑. 另外, 多数肝细胞株的分化功能与原代细胞相比有不同程度地下降. 为克服上述缺陷, 国内外学者开始采用可回复性永生化方法, 其基本原理是先将永生化基因SV40T导入原代细胞以获得永生化细胞株, 使其获得体外增生能力, 然后再以特异性位点重组技术切除SV40T基因, 使细胞株回复到永生化前的状态. 这样, 肝细胞株既具有了永生化特性, 又可解决安全性与分化功能差的缺点. 从这一技术的发展现状及趋势看, 进一步改善载体设计将是近期研究的热点.
关键词: 肝细胞; 永生化
引文著录: 陈耀凯. 肝细胞永生化: 进展与挑战. 世界华人消化杂志 2005; 13(3): 273-275
N/A
N/A
Correspondence to: N/A
Received: January 10, 2005
Revised: January 15, 2005
Accepted: January 22, 2005
Published online: February 1, 2005
0 引言
当前, 基于活性肝细胞为主要生物成分的肝细胞治疗学已逐渐成为治疗肝衰竭及先天性肝脏代谢性疾病的重要手段, 其中以体外生物人工肝支持系统及肝细胞移植发展最为迅速, 而上述疗法成功的关键是获得理想的肝细胞材料. 理想的肝细胞应具有以下特征[1]: (1)人源性; (2)表型正常; (3)易于获得; (4)易于培养且能迅速生长至高密度; (5)具有良好的分化状态及成熟肝细胞的全部生物代谢功能. 现阶段肝细胞材料在来源、代谢活性及安全性等方面均远未达到理想程度, 已成为限制肝细胞治疗学发展的瓶颈问题, 这一问题的解决必将大大提升体外生物人工肝支持系统及肝细胞移植的临床实用价值, 也将为肝细胞治疗学开辟更广阔的前景. 目前研究中使用的肝细胞包括同种肝细胞(人肝细胞)、异种肝细胞(哺乳动物肝细胞)及肝细胞株. 理论上讲, 人肝细胞(包括成人肝细胞及人胎肝细胞)最为理想, 但成人供肝来源极其有限且仅用于肝移植, 加之成人肝细胞在体外增生能力差, 故大量获得成人肝细胞几无可能. 胎肝的利用因涉及伦理问题, 亦难以大量推广应用[2-3]. 动物肝细胞存在发生免疫反应及传播动物病毒的危险[4-5]. 鉴于上述原因, 肝细胞永生化成为解决肝细胞来源的重要途径之一, 尽管该方法亦存在诸多问题、面临巨大挑战, 但这一领域的进展仍较为迅速, 且随着研究策略的不断改进, 前景也变得愈加光明.
1 肿瘤源性肝细胞株
原代肝细胞在体外培养时存在生长条件要求严格、存活时间有限、不能增生、传代困难等缺点, 而由肝肿瘤细胞衍变而来的肝细胞株在体外培养时增生能力很强, 且具有正常肝细胞的某些主要功能. 肝肿瘤细胞株 Hep G2细胞株是从肝母细胞瘤分离出来的, 具有肝细胞的代谢解毒功能, C3A细胞株由Hep G2衍化而来, 具有良好的分泌白蛋白、参与尿素及糖原合成等肝细胞特异性功能. C3A细胞株增生能力极强, 在人工肝中空纤维生物反应器中接种2 g细胞, 可增生到200 g. 将C3A用于治疗狗肝衰竭模型, 获得良好疗效, 并见人血清白蛋白、甲胎蛋白及凝血因子Ⅴ增高. 用C3A人工肝治疗7例Ⅲ-Ⅳ度肝性脑病患者, 结果4例脑病症状改善, 其中1例存活. 肿瘤源性肝细胞株的缺点是安全性问题, 另外其特异性功能的分化亦较差, 目前多数用于实验研究, 仅C3A细胞株少量用于临床治疗.
2 正常肝细胞源性肝细胞株
Kono et al[6]从人正常肝组织中分离原代肝细胞, 经胶原凝胶夹心培养系统培养后获得细胞株HHY41, 该细胞株的获得既未用病毒转导, 也未经致癌物处理. HHY41具有典型肝细胞的形态特征, 细胞表面有肝细胞特异性抗原; 具有葡萄糖-6-磷酸酶活性, 能分泌白蛋白、转铁蛋白、甲胎蛋白等肝特异性蛋白, 细胞色素P450活性正常; Northern转印分析证实了胞质内存在白蛋白mRNA, 细胞核型与正常肝细胞相同; 体外培养时具有快速增生能力. 但有学者认为这种肝细胞株很可能是正常肝细胞在体外培养过程中受到病毒感染而导致的永生化, 因此同样存在安全性之虑.
3 正常肝细胞经转染/转导而获得的肝细胞株
正常肝细胞经质粒转染或病毒感染而永生化是目前采用较多的永生化方法. Werner et al[7]从肝活检标本中分离人肝细胞, 经细胞转染试剂将反义pRB及反义p53基因转染入肝细胞而获得肝细胞株HepZ, 具有细胞色素P450活性等肝细胞特异性代谢功能, 能长期传代且增生能力强. Wege et al[8]研究了端粒酶介导的永生化方法对于人胎肝细胞永生化的可行性. 端粒酶是一种细胞内核糖核蛋白, 对于维持端粒长度及染色体稳定起关键作用, 包括人肝细胞在内的体细胞不表达端粒酶活性, 因而细胞端粒随细胞周期进行性缩短, 最终导致细胞老化. 我们利用逆转录病毒将端粒酶逆转录酶(催化亚单位)基因导入人胎肝细胞, 并对转导细胞的端粒酶活性、端粒长度、增生能力、肝细胞功能、致瘤性及分化潜能进行了鉴定. 结果端粒酶逆转录酶的表达使人胎肝细胞端粒酶活性得以恢复, 细胞能保持端粒长度, 体外培养中倍增300多倍后仍能保持肝细胞的特异性功能, 肝细胞生长因子及受体、转录因子、白蛋白及糖原合成、尿素合成、葡萄糖-6-磷酸酯酶、细胞色素P450活性等均与原代细胞相近. 该研究未发现该细胞株的致瘤性, 无c-Myc(原癌基因)上调, 在免疫缺陷小鼠体内成功定植, 初步显示了其安全性. 在众多转染/转导方法中, 目前应用较多的方法是将SV40T基因导入成熟肝细胞或胚胎肝细胞, 该基因可编码SV40大T抗原, 后者与细胞生长抑制基因p53、pRB结合使其功能丧失, 最终导致细胞永生化. Liu et al[9]将SV40T转导入原代猪肝细胞, 获得一株非瘤源性、可无限传代且高度分化的猪肝细胞株. 该细胞株可连续培养传代2年, 氨甲酰磷酸合成酶(尿素循环的关键酶)、细胞角蛋白(CK)18、P450代谢活性、白蛋白合成能力等特征性标志仍保持完好. Allain et al[10]利用逆转录病毒载体将SV40T基因导入具有双表型(肝细胞表型与胆管上皮细胞表型)的原代猕猴胎肝上皮细胞, 获得永生化细胞株. 这种细胞株在体外培养时可无限生长, 表达肝上皮细胞标志CK8、CK18, 肝细胞特异性标志白蛋白、甲胎蛋白, 胆管细胞特异性标志CK7、CK19, 内源性端粒酶持续表达. 将细胞株通过无胸腺小鼠门静脉移植后, 约50%的外源细胞整合入肝实质, 且无致瘤性. 3 wk后, 定植于肝实质的外源细胞表达白蛋白与甲胎蛋白, 但不表达CK19, 表明双潜能的细胞株已经分化为肝细胞. 总体看来, 经转染/转导而获得的肝细胞株特异性功能分化较好, 但由于病毒基因及其他外源性基因留在肝细胞内, 并未解决肝细胞株的安全性问题.
4 基因敲除的永生化肝细胞株
一些学者采用p53或p19基因敲除方法使肝细胞永生化, p53基因敲除可使细胞周期越过Hayflick极限而永生化, p19基因缺失调低了p53基因的生长抑制功能从而使细胞永生化. Dumble et al[11]利用p53基因敲除小鼠建立了一株永生化的肝卵圆细胞株, 与原代肝卵圆细胞基因表达及表型相近, 在无胸腺裸鼠体内可形成肿瘤. Mikula et al[12]从p19基因敲除小鼠肝脏分离建立了肝细胞株MIM, 该细胞株表达肝细胞的特异性标志, 植入肝损伤SCID小鼠脾脏后可在肝脏定植并增生, 表明细胞株参与了肝组织重建. 理论上, 基因敲除的肝细胞株可能会由于p53或p19基因的敲除而丧失其基因稳定性, 因而这种肝细胞株的安全性尚需进一步研究.
5 可回复肝细胞株
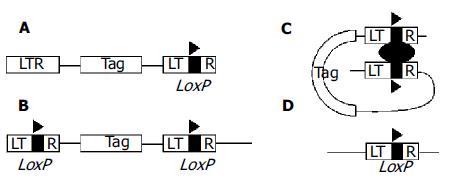
近几年来, 国外学者设计了一种可回复性永生化程序(reversible immortalization), 为解决细胞材料问题提供了新的思路及手段. 其基本原理是先将永生化基因SV40T导入原代细胞以获得永生化细胞株, 使其获得体外增生能力, 然后再以特异性位点重组技术切除SV40T基因, 使细胞株回复到永生化前的状态(图1), 这样细胞既得到了增生又不具有致癌性及病毒感染的可能性. 目前这一方法已被用于人生肌细胞、人肝窦内皮细胞、人肝细胞及其他哺乳动物体细胞的永生化[4,13-19]. Kobayashi et al[4,16]采用该方法建立的肝细胞株具有肝实质细胞的形态学特征及肝细胞特异性功能基因, 再利用腺病毒或逆转录病毒载体将重组酶Cre基因导入, SV40T基因被成功切除, 细胞株回复到永生化前的状态, 这种由肝细胞株回复而来的细胞称为回复肝细胞(reverted hepatocytes). Weber et al还利用可回复性永生化方法建立了猴肝祖细胞株, 该细胞株具有双向分化潜能, 同时表达肝细胞及胆管细胞表型. 将细胞株植入无胸腺小鼠体内, 50%左右的细胞定植成功, 数天后停止增生并向肝细胞分化. 采用表达Cre的逆转录病毒感染后细胞即停止生长并老化死亡.
图1 特异性基因位点重组原理.
A: 逆转录病毒载体; B: 整合原病毒; C: Cre介导位点重组; D: 重组后剩余载体序列.
6 今后的研究策略
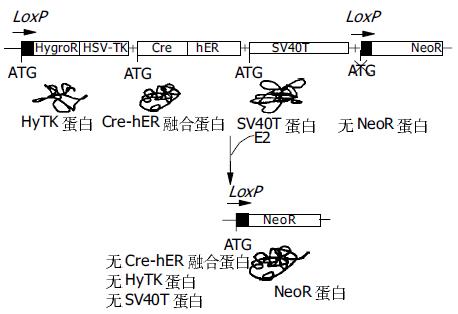
与传统永生化方法相比, 可回复性永生化显然具有较大的优势. 但该方法目前仍存在一些缺陷: 细胞必须经过两次病毒载体转导; 不能保证永生化基因的彻底清除; 第二次转导后重组酶基因留在细胞内, 仍有可能与内源性序列发生重组导致染色体移位等; 对重组酶活性不能实施有效控制. 从这一技术的发展现状及趋势看, 进一步改善载体设计将是近期研究的热点. 我们曾提出采用一种新策略构建逆转录病毒载体(图2), 并以此实现人胎肝细胞的永生化与回复. 主要特点是: (1)将永生化基因SV40T与重组酶Cre基因置于同一载体, 转导一次完成; (2)SV40T与Cre均位于两个LoxP位点之间, 将一同被切除; (3)Cre基因与雌激素受体(ER)配体结合区(LBD)编码基因构成融合基因, 其产生融合蛋白(由Cre重组酶与LBD组成)的酶活性受配体(雌二醇, E2)控制, 因而可通过E2控制Cre重组酶; (4)潮霉素磷酸转移酶与单纯疱疹病毒胸苷激酶的融合基因(HyTK)将使少数未发生重组的细胞在昔洛韦(GCV)的选择下死亡, 进一步保证了回复肝细胞的安全性. 对这一设想的研究目前仍在进行中, 虽取得了一些重要进展, 但尚未达到最终目标.