修回日期: 2005-09-25
接受日期: 2005-09-30
在线出版日期: 2005-12-28
目的: 分析外周血中CK20基因产物的表达与直肠癌Dukes分期和组织学分型的关系, 探讨用FQ-PCR检测CK20来预测直肠癌微转移以及判断患者预后的价值.
方法: 采集47例直肠癌患者外周血标本、10例良性肠道病患者及10例健康志愿者外周血标本. 用FQ-PCR检测外周血CK20的表达情况.
结果: 10例良性肠道病患者及10 例健康志愿者外周血中均检测不到CK20的表达, 与直肠癌组有明显差异(72.34%, 34/47)(χ2 = 37.434,P<0.01). 47例直肠癌患者外周血中CK20的表达量与Dukes分期呈正相关(r = 0.680, P<0.01).
结论: 直肠癌外周血中CK20的表达量与肿瘤分期有关, 并且分期越晚CK20的表达量越多, 用CK20 FQ-PCR检测癌转移较常规病理组织学敏感, 对直肠癌患者病情的判定、疗效评价及恢复情况具有重要临床意义.
引文著录: 殷红专, 韩霞, 苏琪, 吴硕东, 刘恩卿. 荧光定量PCR检测CK20在直肠癌外周血中表达的意义. 世界华人消化杂志 2005; 13(24): 2892-2895
Revised: September 25, 2005
Accepted: September 30, 2005
Published online: December 28, 2005
AIM: To analyze the relations of CK20 expression in the peripheral blood with the Dukes stages and histological types, and to discuss the value of fluorescence quantitative polymerase chain reaction (FQ-PCR) for predicting the metastases and prognosis of rectal cancer.
METHODS: The peripheral blood samples were collected from 47 patients with rectal cancer, 10 patients with benign intestinal diseases, and 10 healthy volunteers. Then FQ-PCR was performed to detect the expression of CK20 mRNA in the peripheral blood.
RESULTS: There was no positive expression of CK20 mRNA in the patients with benign intestinal diseases and the healthy volunteers, which was significantly different from that in the patients with rectal cancer (72.34%, 34/47) (χ2 = 37.434, P < 0.01). The level of CK20 expression in the peripheral blood of the 47 patients with rectal cancer was positively correlated with the Dukes stages of rectal cancer (r = 0.680, P < 0.01).
CONCLUSION: The level of CK20 expression is positively related with tumor stages in the peripheral blood of the rectal cancer patients. CK20 detection by FQ-PCR is more sensitive than routine histological methods in predicting the metastases and prognosis of rectal cancer.
- Citation: Yin HZ, Han X, Su Q, Wu SD, Liu EQ. Detection of CK20 in peripheral blood of rectal cancer patients with fluorescence quantitative polymerase chain reaction and its significance. Shijie Huaren Xiaohua Zazhi 2005; 13(24): 2892-2895
- URL: https://www.wjgnet.com/1009-3079/full/v13/i24/2892.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i24.2892
细胞角蛋白20 (CK20) 是由Moll et al[1]于1990年发现的一种多肽, 局限在胃肠上皮细胞, 不同于其它CK, CK20具有更为严格的上皮组织特异性[2,3]. 正常组织中, CK20见于肠黏膜细胞、胃黏膜及幽门腺体细胞、十二指肠黏膜、泌尿系伞状细胞、表皮Merkel细胞, 而其它正常组织如乳腺、平滑肌、血细胞、淋巴细胞、造血细胞等均为阴性[2]. CK20在所有大肠癌几乎都明显表达且在侵袭、转移、扩散到其他组织器官时始终保持稳定, CK20的分布特点使其成为良好的肿瘤标志物[4], 因而成为肿瘤分子生物学领域的一个研究热点. 我们应用荧光定量PCR (FQ-PCR) 方法观察CK20基因产物在直肠癌患者外周血中的表达情况, 分析外周血中CK20基因产物的表达分别与直肠癌Dukes分期、组织学分型的关系, 探讨用FQ-PCR检测CK20来预测直肠癌微转移以及判断患者预后的价值.
分别抽取2003-09/2004-12间中国医科大学附属第二临床学院普外四科手术治疗的47例直肠癌患者外周血标本、10例良性肠道病患者及10例健康志愿者外周血标本. 47例直肠癌患者男29例, 女18例, 最大年龄87岁, 最小年龄36岁, 平均年龄62岁; DukesA期15例, B期16例, C期13例, D期 3例; 其中高分化腺癌23例, 中分化腺癌18例, 低分化腺癌3例, 黏液腺癌3例. 全部病例术后均经病理诊断证实, 其中直肠癌患者术前均未行化疗和放疗, 术中经系统淋巴结廓清. 临床分期按改良Dukes分期.
1.2.1 标本的制备: 分别抽取直肠癌患者、良性肠道病患者术前30 min静脉血5 mL及10例健康志愿者静脉血5 mL, 置于肝素抗凝管内 (肝素2 g/L, 0.5 mL) 混匀, 淋巴细胞分离液提取白细胞, -80 ℃贮存备用. 总RNA的提取采用Trizol抽提法.
1.2.2 引物及探针合成: 由中山大学基因研究中心进行引物合成(表1).
| 基因名称 | 碱基序列 |
| 上游引物 | 5'-GGAAGTCGATGGCCTACACAA-3′ |
| 下游引物 | 5'-GGCCTGGAGCAGCATCAA-3′ |
| 荧光探针 | 5'-FAM-CATCTGGGCAACACTGTCAATGTGGAG-TAMRA-3′ |
1.2.3 FQ-PCR检测: 将提取的RNA样本进行逆转录反应; 制备阳性模板的标准梯度; 样本总RNA作逆转录反应后, 取5 uL逆转录产物作为模板, 制备样品检测体系; 将制备好的阳性标准品和检测样本同时上机, 仪器为美国PE公司生产的GeneAmp 5700全自动实时荧光定量PCR仪, 严格按照试剂盒说明操作, 反应条件; 93℃ 2 min, 然后93℃ 30 min, 55℃ 1 min, 共40个循环. 反应结束后, 由计算机软件分析计算定量结果. 定量的单位是拷贝数/uL.
统计学处理 采用SPSS12.0软件进行非参数一致性检验、秩和检验及χ2检验, P<0.05为有统计学意义.
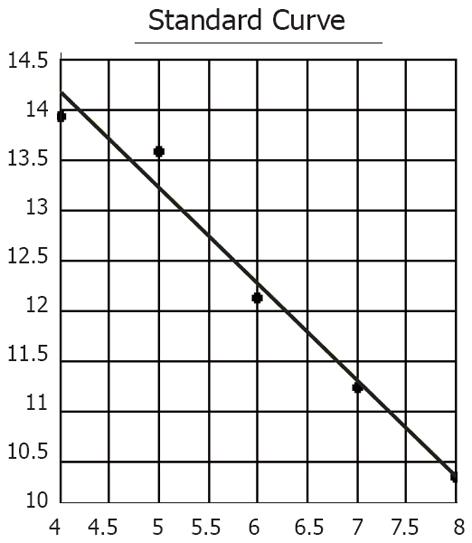
2.1 我们根据不同浓度的标准阳性模板测得的荧光信号到达设定域值时所经历的循环数(cycle threshold, Ct)值, 绘制标准曲线图(图1). 标准曲线线性相关性良好, 斜率-0.963504, 截距18.019 125, 回归系数为-0.987856. 根据所测样品的Ct值, 在标准曲线中可确定样品起始模板的数量, 通过电脑数据处理得出定量结果.
10例良性肠道病患者及10例健康志愿者外周血中均检测不到CK20的表达, 与直肠癌组有明显差异(χ2 = 37.434, P<0.01)(表2).
| 分组 | 检测结果 | 合计 | |
| 阳性 | 阴性 | ||
| 健康志愿者及良性肠道病患者 | 0 | 20 | 20 |
| 直肠癌患者 | 34 | 13 | 47 |
| 合计 | 34 | 33 | 67 |
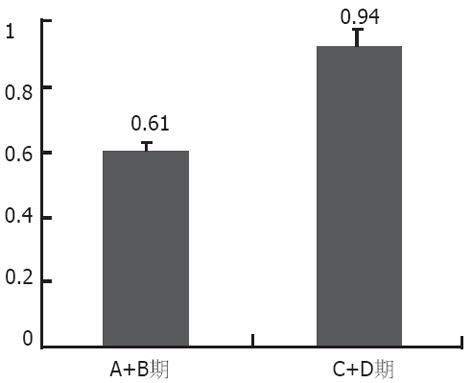
47例直肠癌患者外周血中CK20的表达量与Dukes分期呈正相关(Spearman相关系数r = 0.680, P<0.01). CK20的阳性检出率在Dukes C+D期(93.75%, 15/16) 显著高于A+B期(61.29%, 19/31)(χ2 = 6.571, P<0.05)(表3, 图2); 定量分析, 将各Dukes分期外周血中CK20表达的拷贝数进行秩和检验 (Mann-Whitney Test), A期与B期之间无统计学差异(Z = -0.977, P = 0.358>0.05); C期显著高于B期(Z = -3.798, P<0.001); D期显著高于C期(Z = -2.354, P = 0.014<0.05).
| Dukes分期 | 检测结果 | 合计 | |
| 阳性 | 阴性 | ||
| A+B期 | 19 | 12 | 31 |
| C+D期 | 15 | 1 | 16 |
| 合计 | 34 | 13 | 47 |
CK20不同于其它肿瘤标志物, 具有更为严格的上皮组织特异性, 非上皮来源组织或细胞如正常血液、骨髓和淋巴结不表达[5]. 正常组织中, CK20见于肠黏膜细胞、胃黏膜及幽门腺体细胞、十二指肠黏膜、泌尿系伞状细胞、表皮Merkel细胞, 而其它正常组织如乳腺、平滑肌、血细胞、淋巴细胞、造血细胞等均为阴性, 正常人中无表达[6-9]. CK20的表达在细胞发生化生、恶变、肿瘤转移、体外培养等改变时持续表达阳性. 下列肿瘤CK20表达阳性; 结肠直肠癌、胃腺癌及未分化癌、泌尿道移行细胞癌、胆道腺癌、胰管细胞腺癌、皮肤Merkel细胞癌等. CK20表达阴性的有; 乳腺黏液腺癌和小叶腺癌、子宫内膜癌、卵巢非黏液腺癌、肾细胞癌、肺腺癌及鳞状细胞癌、鳞状细胞癌 (子宫颈、咽、食管、皮肤)、肉瘤、恶性淋巴瘤等. 因此, 作为检测直肠癌肿瘤细胞的标志物, CK20具有一定的特异性[5,10].
FQ-PCR技术是在PCR 技术出现6 a后, 于1995年美国PE公司率先研制成功的荧光定量技术, 它突破了传统PCR技术要求新鲜标本、其迅速处理、技术要求较高、易受污染、非定量或半定量等桎梏[11]. FQ-PCR的Taq酶不仅有延伸脱氧核糖核酸引物的活性还有5'→3'外切核酸酶活性,可在链延伸过程中实现链替换,并将被替换的单链切断, 这就是FQ-PCR的酶学基础. FQ-PCR反应体系中不仅有两条普通的引物, 还有一条荧光标记探针, 这条探针的5'端和3'端分别标记了荧光报告基团 (R) 和荧光淬灭基团(Q). 当这条探针保持完整时R基团的荧光信号被Q基因所淬灭; 一旦探针被切断, 淬灭作用消失, 产生荧光发射,通过荧光光谱分析仪检测荧光强度, 即可准确测知扩增产物的含量[12], 具有技术操作简便、快速、结果判断客观、重复性能好、定量范围宽(可包括0-1014个拷贝/L)、无需样品梯度稀释、高灵敏性、高特异性、高精确性的特点, 采用完全封闭式的操作系统, 克服了传统的PCR技术易受污染, 造成假阳性等诸多缺点[12]. 因此, FQ-PCR技术是一种简便易行的有临床应用价值的检测方法, 而且是基因诊断、疗效评价、技术创新和临床研究的高新技术手段, 具有广泛的开发前景[13,14].
10例良性肠道病患者及10例健康志愿者外周血中均检测不到CK20的表达, 符合并证实了文献报道中CK20在正常人及良性胃肠病中不表达[15-19], 表明CK20具有很高的特异性. 常规检查未发现转移的部分A期及B期直肠癌患者外周血中发现有CK20的表达, 表明部分早期直肠癌患者血液中已有癌细胞, 已具备了血行转移的条件, 应在手术后结合放、化疗等综合治疗措施, 且要给予更积极的随访. 同时, 直肠癌患者外周血中CK20的表达量与直肠癌Dukes分期呈正相关, 随着病情的发展CK20的表达量增加. CK20的阳性表达率在C+D期中明显高于A+B期, 这一结论与孙念绪et al[20]结论基本相符. 在此基础上, 将各分期中测得的CK20 mRNA的数量进行秩和检验, 得出结论; CK20的表达量在A、B期间无差异, C期高于B期, D期高于C期, 而这种定量分析在国内外文献中未见报道. 直肠癌患者外周血中CK20的表达率在直肠癌各病理分型中没有明显差异, 这与郭英et al[21]的研究结论基本相符. 以上可以说明外周血中CK20 FQ-PCR的检测有助于综合判断疾病恶性程度及预后, 而它可能为今后指导直肠癌患者术前与术后辅助治疗及判断复发和监测化疗疗效提供依据.
FQ-PCR已经应用于医学研究中的多个领域, 尤其在遗传学方面对染色体病及单基因病的诊断、对基因表达的研究、对基因突变及其多样性的研究等较为多见[22], 在肿瘤放疗和化疗后癌基因表达的检测方面也有应用[23]. 而我们应用FQ-PCR技术检测直肠癌肿瘤标志物CK20, 结合了CK20的高特异性及FQ-PCR的高灵敏、高精确性、简便安全、可定量检测等特点, 在国内外的文献中均未见报道, 这无疑是为直肠癌微转移的检测开辟了一条新的道路.
我们可以通过日后积累样本量及随访, 观察各分期直肠癌患者的生存时间及制定各分期中CK20的取值范围, 从而为直肠癌的辅助治疗提供更为系统的依据.
电编: 张勇 编辑: 菅鑫妍 审读: 张海宁
| 1. | Moll R, Schiller DL, Franke WW. Identification of protein IT of the intestinal cytoskeleton as a novel type I cytokeratin with unusual properties and expression patterns. J Cell Biol. 1990;111:567-580. [PubMed] [DOI] |
| 2. | Burchill SA, Bradbury MF, Pittman K, Southgate J, Smith B, Selby P. Detection of epithelial cancer cells in peripheral blood by reverse transcriptase-polymerase chain reaction. Br J Cancer. 1995;71:278-281. [PubMed] [DOI] |
| 3. | Lassmann S, Bauer M, Soong R, Schreglmann J, Tabiti K, Nahrig J, Ruger R, Hofler H, Werner M. Quantification of CK20 gene and protein expression in colorectal cancer by RT-PCR and immunohistochemistry reveals inter- and intratumour heterogeneity. J Pathol. 2002;198:198-206. [PubMed] [DOI] |
| 5. | Dorudi S, Kinrade E, Marshall NC, Feakins R, Williams NS, Bustin SA. Genetic detection of lymph node micrometastases in patients with colorectal cancer. Br J Surg. 1998;85:98-100. [PubMed] [DOI] |
| 7. | Chen XM, Chen GY, Wang ZR, Zhu FS, Wang XL, Zhang X. Detection of micrometastasis of gastric carcinoma in peripheral blood circulation. World J Gastroenterol. 2004;10:804-808. [PubMed] |
| 10. | Park SY, Kim HS, Hong EK, Kim WH. Expression of cytokeratins 7 and 20 in primary carcinomas of the stomach and colorectum and their value in the differential diagnosis of metastatic carcinomas to the ovary. Hum Pathol. 2002;33:1078-1085. [PubMed] [DOI] |
| 16. | Lee MJ, Lee HS, Kim WH, Choi Y, Yang M. Expression of mucins and cytokeratins in primary carcinomas of the digestive system. Mod Pathol. 2003;16:403-410. [PubMed] [DOI] |
| 17. | Vlems FA, Diepstra JH, Cornelissen IM, Ruers TJ, Ligtenberg MJ, Punt CJ, van Krieken JH, Wobbes T, van Muijen GN. Limitations of cytokeratin 20 RT-PCR to detect disseminated tumour cells in blood and bone marrow of patients with colorectal cancer: expression in controls and downregulation in tumour tissue. Mol Pathol. 2002;55:156-163. [PubMed] [DOI] |
| 20. | 孙 念绪, 王 德虎, 唐 波. 结、直肠癌血行转移与肿瘤转移因子的关系. 中国普外基础与临床杂志. 2002;9:348-351. |
| 23. | Egawa C, Miyoshi Y, Takamura Y, Taguchi T, Tamaki Y, Noguchi S. Decreased expression of BRCA2 mRNA predicts favorable response to docetaxel in breast cancer. Int J Cancer. 2001;95:255-259. [PubMed] [DOI] |