修回日期: 2005-10-28
接受日期: 2005-10-31
在线出版日期: 2005-12-28
目的: 探讨肠屏障功能与胆色素结石形成间的相关性, 及其可能的作用机制.
方法: 豚鼠80只随机分为对照组 (CON)、成石组(PS)、肠黏膜保护组 (GLN), 分别给予正常饲料、胆色素结石致石饮食、添加肠黏膜保护剂谷氨酰胺的致石饮食, 饲养8 wk建立胆囊胆色素结石模型. 检测并比较各组胆结石成石率、肠黏膜形态、肠黏膜通透性、血浆内毒素水平、胆汁β-葡萄糖醛酸酶活性.
结果: 成石组成石率为73.9%, 与正常组相比, 成石组肠黏膜通透性增加, 肠黏膜细胞超微结构受损, 血浆内毒素水平[由(77±43)×10-6 EU/L增至 (1367±525)×10-6 EU/L, P<0.01]和内、外源性胆汁β-葡萄糖醛酸酶活性增高 (内源性由122.1±39.5 Fishman单位增至209.8±47.5 Fishman单位, P<0.01, 外源性由573.5±476.9 Fishman单位增至2206.6±983.9 Fishman单位, P<0.01). 肠黏膜保护组成石率下降至44.4%,各指标均较成石组降低, 内毒素水平[(156±97)×10-6 EU/L vs (1367±525)×10-6 EU/L, P<0.05]、肠黏膜通透性、肠黏膜细胞受损程度均较成石组有显著性差异, 而胆汁β-葡萄糖醛酸酶活性无显著差异.
结论: 胆色素结石与肠屏障功能异常之间具有一定的相关性. 肠屏障功能异常可能通过继发细菌移位、内毒素血症、胆汁β-葡萄糖醛酸酶活性改变, 在促进胆色素结石的形成中发挥一定的作用.
引文著录: 苏洋, 吴硕东, 金俊哲, 张振海, 范莹. 肠屏障功能对豚鼠胆囊胆色素结石形成的影响. 世界华人消化杂志 2005; 13(24): 2853-2857
Revised: October 28, 2005
Accepted: October 31, 2005
Published online: December 28, 2005
AIM: To investigate the possible action and mechanism of the intestinal barrier function in the pathogenesis of pigment gallstone.
METHODS: Eighty guinea pigs were randomly divided into three groups: normal group (CON), pigment gallstone group (PS) and intestinal mucosa protection group (GLN). Normal forage, pigment gallstone-forming forage and pigment gallstone-forming forage with supplemental intestinal mucosa protector (glutamine) were given to the animals of corresponding groups, respectively. The gallstone-forming rate, morphological changes of intestinal mucosa, intestinal permeability, serum endotoxin and biliary β-glucuronidase were detected after 8 wk.
RESULTS: The gallstone-forming rate was 73.9% in PS. In comparison with those in CON, the intestinal mucosa damage, serum endotoxin level [(1367±525)×10-6 EU/L vs (77±43) ×10-6 EU/L, P < 0.01] and activity of biliary β-glucuronidase (endogenous: from 209.8±47.5 vs 122.1±39.5 Fishman Unit, P < 0.01; exogenous: from 2206.6±983.9 vs 573.5±476.9 Fishman Unit, P < 0.01) were significantly increased in PS. In GLN, the gallstone-forming rate was decreased to 44.4%, which was markedly higher than that in PS (P < 0.05). The morphological changes of intestinal mucosa, intestinal permeability and serum endotoxin [(156±97)×10-6 EU/L vs (1367±525)×10-6 EU/L, P < 0.05] were notably decreased in GLN as compared with those in PS, and there was no significant difference in β-glucuronidase activity.
CONCLUSION: Intestinal barrier function is correlated with pigment gallstone formation. Intestinal barrier function disorder may promote pigment gallstone formation through bacteria translocation, endotoxemia and change of biliary β-glucuronidase activity.
- Citation: Su Y, Wu SD, Jin JZ, Zhang ZH, Fan Y. Influence of intestinal barrier function on pigment gallstone formation in guinea pig model. Shijie Huaren Xiaohua Zazhi 2005; 13(24): 2853-2857
- URL: https://www.wjgnet.com/1009-3079/full/v13/i24/2853.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i24.2853
肠道屏障功能在烧伤[1]、创伤[2]、胰腺炎[3]等多种疾病中的作用愈来愈引起人们的重视, 但肠黏膜屏障功能与胆石症之间的关系尚无相关研究. 我们观察到胆囊胆色素结石的形成可能与肠屏障功能也存在一定联系. 为分析二者间的相关性及可能的内在机制, 我们选用致石食谱诱导的豚鼠胆囊胆色素结石动物模型来进行进一步的观察. 沿着肠屏障功能异常-细菌移位-胆汁酶学改变-胆色素结石形成的线索, 对肠黏膜形态学、肠黏膜通透性、血浆内毒素、胆汁β-葡萄糖醛酸酶 (β-GD) 一系列指标进行了观察. 并进一步应用肠黏膜保护剂谷氨酰胺 (GLN) 进行干预, 研究其对结石形成率及以上各指标的影响, 旨在从一个新的角度-肠黏膜屏障功能, 来探讨胆色素结石的形成机制.
健康豚鼠80只, 雌雄各半, 体质量200-250 g, 由中国医科大学附属二院动物实验室提供. 酚酞葡萄糖醛酸 (Sigma公司), 胆固醇、胆酸、酪蛋白 (沈阳化学试剂有限公司), 谷氨酰胺颗粒剂/安凯舒颗粒剂 (重庆药友制药有限公司), 鲎试剂和内毒素检测血浆处理剂 (中国湛江经济技术开发区海洋生物制品厂). 致石食谱 (g/kg): 玉米粉136.3, 黄豆粉90.9, 面粉90.7, 鱼粉63.6, 麸皮90.9, 盐10, 酵母粉10, 苜蓿粉416.5, 猪油20, 蔗糖30, 纤维素20, 胆固醇1, 胆酸0.4, 维生素C 0.05, 酪蛋白20. 肠黏膜保护组食谱在以上成分基础上添加30 g/kg谷氨酰胺. 对照组采用常规豚鼠饲料喂养.
动物模型构建及分组: 实验豚鼠随机分为3组, 对照组 (CON组) 20只, 普通饲料饲养; 胆色素结石组(PS组) 30只, 给予致石食谱饲养, 构建豚鼠胆囊胆色素结石模型; 肠黏膜保护组 (GLN组) 30只, 以谷氨酰胺作为肠黏膜保护剂, 添加于饲料中, 观察保护肠黏膜屏障对成石率的影响. 相同环境饲养8 wk, 分别行胆汁、血浆、肠组织标本取材及检测, 解剖胆囊, 观察结石形成情况, 统计成石率.
1.2.1 膜超微结构: 取距离回盲部5 cm回肠组织, 立即放入30 g/L戊二醛溶液中固定15 min, 然后切取1 mm×1 mm×4 mm大小的黏膜组织, 按照常规电镜标本制作方法, 依次以10 g/L四氧化锇酸后固定、脱水、染色,在JEM-100CXⅡ透射电镜下观察比较各组标本肠黏膜细胞间紧密连接、微绒毛排列、胞质内细胞器等亚细胞超微结构.
1.2.2 肠黏膜通透性: 取回肠黏膜组织标本, 约1mm×1 mm×2 mm大小, 立即浸入以0.1 mol/L的二甲砷酸钠缓冲液 (pH7.4) 配制的含30 g/L硝酸镧和30 g/L戊二醛的固定液中固定2 h, 再以30 g/L硝酸镧二甲砷酸钠缓冲液浸洗两次, 经含20 g/L硝酸镧的10 g/L四氧化锇行后固定, 依次脱水、包埋, 不经电子染色, JEM-100CXⅡ型透射电镜观察示踪剂镧颗粒在细胞间连接和细胞膜内外的分布, 反映肠黏膜通透性.
1.2.3 血浆内毒素水平: 以10 g/L肝素抗凝的去热源管收集豚鼠静脉血标本, 3 500 r/min离心取上清, 于BET-32B型细菌内毒素测定仪上, 采用动态浊度法检测血浆内毒素水平.
1.2.4 胆汁β-葡萄糖醛酸酶活性: 抽取豚鼠胆囊胆汁, 采用改良Fishman法, 检测胆汁内源性和外源性β-GD活性.
统计学处理 数据使用SPSS11.5统计软件进行统计, 用mean±SD表示, 分别进行χ2检验、t检验, P<0.05为有统计学意义.
成石组成石率为73.9%, 模型建立成功. 使用谷氨酰胺作为肠黏膜保护剂的GLN组, 成石率 (44.4%) 低于成石组 (P<0.05), 表明肠黏膜保护剂有抑制豚鼠胆囊胆色素结石形成的作用.
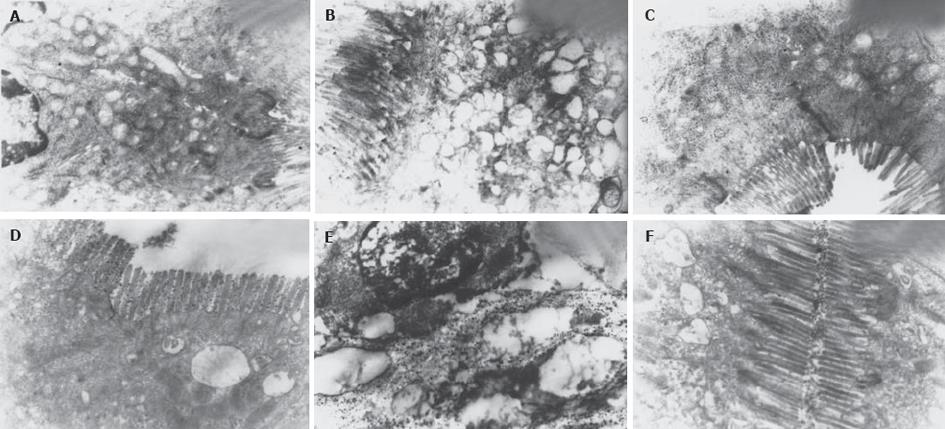
与CON组相比, PS组(图1 A, B) 肠黏膜细胞微绒毛排列紊乱, 细胞间连接处电子密度增强, 部分断裂. 部分细胞胞质内线粒体肿胀, 嵴消失, 呈空泡样改变, 内质网扩张成池, 表面核糖体脱离, 偶见细胞核畸变; GLN组 (图1C) 细胞间连接处亦可见电子密度增强, 但结构轮廓完整, 微绒毛排列略稀疏, 部分细胞有变性样改变.
硝酸镧颗粒为直径1-4 nm的重金属大分子, 正常情况下不能通过由肠黏膜上皮细胞和细胞间紧密连接构成的肠黏膜机械屏障, 也不在该处积聚排列. 但当肠黏膜通透性增高时, 镧颗粒可以穿越肠黏膜上皮细胞间紧密连接进入到细胞间隙, 甚至通过细胞膜进入到胞质内. 本实验中, PS组 (图1 D, E) 可见电子密度高的镧颗粒沉积在细胞间隙中和细胞微绒毛间, 沿细胞轮廓呈线条状积聚分布, 少数颗粒进入胞质内, 显示肠黏膜细胞间连接和细胞膜通透性增高, 肠屏障功能受损; GLN组(图1F)可见部分细胞微绒毛间有镧颗粒沉积, 上皮细胞深部细胞间隙内偶见镧颗粒分布, 胞质内未见镧颗粒, 显示肠黏膜通透性相对良好.
与对照组相比, PS组血浆内毒素水平明显增高, GLN组血浆内毒素水平亦高于CON组, 但低于PS组 (表1).
PS组内、外源性β-葡萄糖醛酸酶活性均较CON组明显增高 (P<0.01), 其中以外源性活性增高为主; GLN组内、外源性β-葡萄糖醛酸酶活性亦比CON组高 (P<0.05); GLN组与PS组比较, 酶活性在数值上低于PS组, 但本实验例数内无统计学差异 (表1).
肠屏障功能是人体有效地防止肠内细菌及其毒性产物向肠外转移扩散, 从而维持机体内环境安全稳定的重要机制[4-7]. 它通过肠黏膜上皮细胞机械屏障、肠道免疫系统、肠道正常菌群以及黏液化学屏障等机制共同完成防御内源性微生物侵害的作用[8-11]. 肠屏障功能异常与细菌移位[12]、内毒素吸收入血密切相关[13], 共同参与了烧伤、感染、胰腺炎、创伤、休克[14-17]等多种疾病的病理生理过程, 甚至被认为是引发全身炎症反应综合征的中心环节之一[18-21]. 我们在近期对胆色素结石的研究工作中注意到, 饮食诱导的叙利亚金黄地鼠胆囊胆色素结石形成过程中, 肠道屏障功能可能存在异常. 这一现象提示我们, 肠道屏障功能异常是否在胆色素结石形成的某些环节中也发挥一定作用呢? 为了观察二者之间的相关性, 分析其可能的作用机制和地位, 我们选用了另一种动物模型-豚鼠, 对其相关指标进行了实验观察.
肠黏膜形态学检查显示, PS组部分肠黏膜上皮细胞呈变性样改变, 而CON组和GLN组的肠黏膜上皮细胞结构则比较正常. 以硝酸镧为示踪剂检查发现, PS组豚鼠回肠黏膜细胞间连接和细胞膜通透性增高, 镧颗粒可以穿过肠屏障进入到细胞间和细胞内. 肠黏膜通透性是肠屏障功能的重要指标, 通透性增高表明肠黏膜屏障受到损伤. 同时, PS组的血浆内毒素水平高于CON组, 这也与肠屏障损伤是一致的. 这些现象证实了成石组动物存在较明显的肠黏膜屏障功能异常表现, 胆色素结石与肠屏障功能异常之间具有一定的相关性. 而进一步应用肠黏膜保护剂-谷氨酰胺作为干预因素后发现, 获得肠黏膜保护的GLN组豚鼠肠黏膜通透性和血浆内毒素水平均有改善, 并且成石率降至44.4%, 明显低于普通PS组的73.9%. 谷氨酰胺是人体内的一种高效能的生糖氨基酸, 是小肠黏膜细胞的主要能源来源. 谷氨酰胺对于改善肠黏膜上皮细胞的生长和修复, 从而维持肠屏障正常功能的作用已得到肯定[22-26]. 本实验动物模型中, 补充谷氨酰胺可降低成石率的现象进一步印证了肠屏障功能与胆色素结石形成二者之间具有相关性, 并且更支持肠屏障功能异常作为胆色素结石形成的原因而非继发结果.
胆色素结石的形成是一种与细菌感染、胆汁成分代谢异常、胆汁淤滞等多种因素相关的多机制参与的病理过程[27-31]. 其中以Maki为代表的细菌感染学说认为, 细菌感染可提高胆汁中β-葡萄糖醛酸酶的活性水平, 该酶分解胆汁中结合型胆红素成为游离型胆红素, 后者易于在胆汁中析出, 并与钙盐结合形成胆色素钙[32], 于胆汁中沉积凝结, 从而导致胆色素结石的形成. β-葡萄糖醛酸酶又分为内源性和外源性. 外源性β-葡萄糖醛酸酶由胆道细菌感染产生, 其在胆色素结石形成中的作用已得到肯定[33]. 内源性β-葡萄糖醛酸酶由机体自身组织细胞产生, 广泛存在于人体各组织溶酶体中, 在肝组织中含量较高, 其活性与胆色素结石亦具有相关性. 有研究表明, 在内毒素刺激下, 肝脏细胞β-葡萄糖醛酸酶基因表达增高, 可导致肝细胞内源性β-葡萄糖醛酸酶合成增加. 本实验中胆汁内、外源性β-葡萄糖醛酸酶活性均有升高, 并以外源性为主. 这可能是肠屏障损伤通过引起细菌移位和继发感染的作用, 促进了细菌产生外源性β-葡萄糖醛酸酶. 而本实验中血浆内毒素水平的增高既是细菌移位感染的表现, 又可能作为刺激内源性β-葡萄糖醛酸酶增高的因素. 肠屏障功能的异常, 以及其继发的细菌移位感染、血内毒素增高, 为内、外源性β-葡萄糖醛酸酶活性的升高提供了解释.
基于以上结果, 我们推测肠屏障功能异常可能通过继发细菌移位、内毒素血症, 导致胆汁内、外源性的β-葡萄糖醛酸酶活性改变, 从而在胆色素结石的形成环节中发挥一定的作用. 我们也发现在GLN组中, 应用谷氨酰胺后可以降低成石率, 但对β-葡萄糖醛酸酶活性的抑制作用在本实验例数内未获得统计学差异, 是否由于谷氨酰胺亦可能通过胆汁代谢等其它途径影响结石的形成尚有待进一步研究.
电编: 张勇 编辑: 潘伯荣 审读: 张海宁
| 1. | Enomoto N, Takei Y, Yamashina S, Fukuda T, Suzuki S, Ikejima K, Kitamura T, Sato N. Burn injury sensitizes rat Kupffer cells via mechanisms dependent on gut-derived endotoxin. J Gastroenterol. 2004;39:1175-1181. [PubMed] [DOI] |
| 2. | Ding LA, Li JS, Li YS, Zhu NT, Liu FN, Tan L. Intestinal barrier damage caused by trauma and lipopolysaccharide. World J Gastroenterol. 2004;10:2373-2378. [PubMed] [DOI] |
| 4. | Ding LA, Li JS. Intestinal failure: pathophysiological elements and clinical diseases. World J Gastroenterol. 2004;10:930-933. [PubMed] |
| 5. | Ogata Y, Nishi M, Nakayama H, Kuwahara T, Ohnishi Y, Tashiro S. Role of bile in intestinal barrier function and its inhibitory effect on bacterial translocation in obstructive jaundice in rats. J Surg Res. 2003;115:18-23. [PubMed] [DOI] |
| 6. | Nakayama M, Yajima M, Hatano S, Yajima T, Kuwata T. Intestinal adherent bacteria and bacterial translocation in breast-fed and formula-fed rats in relation to susceptibility to infection. Pediatr Res. 2003;54:364-371. [PubMed] [DOI] |
| 7. | Baumgart DC, Dignass AU. Intestinal barrier function. Curr Opin Clin Nutr Metab Care. 2002;5:685-694. [PubMed] [DOI] |
| 8. | Lambert JC, Zhou Z, Wang L, Song Z, McClain CJ, Kang YJ. Preservation of intestinal structural integrity by zinc is independent of metallothionein in alcohol-intoxicated mice. Am J Pathol. 2004;164:1959-1966. [PubMed] [DOI] |
| 9. | Ding LA, Li JS, Li YS, Liu FN, Tan L. Prophylactic treatment with growth hormone improves intestinal barrier function and alleviates bacterial translocation in stressed rats. Chin Med J. 2004;117:264-269. [PubMed] |
| 10. | Carneiro-Filho BA, Lima IP, Araujo DH, Cavalcante MC, Carvalho GH, Brito GA, Lima V, Monteiro SM, Santos FN, Ribeiro RA. Intestinal barrier function and secretion in methotrexate-induced rat intestinal mucositis. Dig Dis Sci. 2004;49:65-72. [PubMed] [DOI] |
| 11. | Ulusoy H, Usul H, Aydin S, Kaklikkaya N, Cobanoglu U, Reis A, Akyol A, Ozen I. Effects of immunonutrition on intestinal mucosal apoptosis, mucosal atrophy, and bacterial translocation in head injured rats. J Clin Neurosci. 2003;10:596-601. [PubMed] [DOI] |
| 12. | Choudhry MA, Rana SN, Kavanaugh MJ, Kovacs EJ, Gamelli RL, Sayeed MM. Impaired intestinal immunity and barrier function: a cause for enhanced bacterial translocation in alcohol intoxication and burn injury. Alcohol. 2004;33:199-208. [PubMed] [DOI] |
| 13. | Assimakopoulos SF, Vagianos CE, Patsoukis N, Georgiou C, Nikolopoulou V, Scopa CD. Evidence for intestinal oxidative stress in obstructive jaundice-induced gut barrier dysfunction in rats. Acta Physiol Scand. 2004;180:177-185. [PubMed] [DOI] |
| 14. | Wang ZT, Yao YM, Xiao GX, Sheng ZY. The protective effect of supplementation of probiotics combined with riboflavin on the intestinal barrier of the rats after scald injury. Zhonghua Shao Shang ZaZhi. 2004;20:202-205. [PubMed] |
| 15. | Li JY, Sun D, Lu Y, Jin H, Jiang XG, Hu S, Sheng ZY. Change in intestinal function in sepsis in rat. Zhongguo Weizhongbing JiJiu Yixue. 2004;16:352-354. [PubMed] |
| 16. | Luyer MD, Buurman WA, Hadfoune M, Jacobs JA, Konstantinov SR, Dejong CH, Greve JW. Pretreatment with high-fat enteral nutrition reduces endotoxin and tumor necrosis factor-alpha and preserves gut barrier function early after hemorrhagic shock. Shock. 2004;21:65-71. [PubMed] [DOI] |
| 17. | Chang JX, Chen S, Ma LP, Jiang LY, Chen JW, Chang RM, Wen LQ, Wu W, Jiang ZP, Huang ZT. Functional and morphological changes of the gut barrier during the restitution process after hemorrhagic shock. World J Gastroenterol. 2005;11:5485-5491. [PubMed] [DOI] |
| 18. | Ding LA, Li JS. Gut in diseases: physiological elements and their clinical significance. World J Gastroenterol. 2003;9:2385-2389. [PubMed] |
| 19. | Yu P, Martin CM. Increased gut permeability and bacterial translocation in Pseudomonas pneumonia-induced sepsis. Crit Care Med. 2000;28:2573-2577. [PubMed] [DOI] |
| 20. | Hassoun HT, Kone BC, Mercer DW, Moody FG, Weisbrodt NW, Moore FA. Post-injury multiple organ failure: the role of the gut. Shock. 2001;15:1-10. [PubMed] [DOI] |
| 21. | Kudsk KA. Current aspects of mucosal immunology and its influence by nutrition. Am J Surg. 2002;183:390-398. [PubMed] [DOI] |
| 22. | Kozar RA, Schultz SG, Bick RJ, Poindexter BJ, DeSoignie R, Moore FA. Enteral glutamine but not alanine maintains small bowel barrier function after ischemia/reperfusion injury in rats. Shock. 2004;21:433-437. [PubMed] [DOI] |
| 23. | Li N, DeMarco VG, West CM, Neu J. Glutamine supports recovery from loss of transepithelial resistance and increase of permeability induced by media change in Caco-2 cells. J Nutr Biochem. 2003;14:401-408. [PubMed] [DOI] |
| 24. | Ding LA, Li JS. Effects of glutamine on intestinal permeability and bacterial translocation in TPN-rats with endotoxemia. World J Gastroenterol. 2003;9:1327-1332. [PubMed] [DOI] |
| 25. | Wischmeyer PE, Lynch J, Liedel J, Wolfson R, Riehm J, Gottlieb L, Kahana M. Glutamine administration reduces Gram-negative bacteremia in severely burned patients: a prospective, randomized, double-blind trial versus isonitrogenous control. Crit Care Med. 2001;29:2075-2080. [PubMed] [DOI] |
| 26. | De-Souza DA, Greene LJ. Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Crit Care Med. 2005;33:1125-1135. [PubMed] [DOI] |
| 27. | Swidsinski A, Lee SP. The role of bacteria in gallstone pathogenesis. Front Biosci. 2001;6:93-103. [PubMed] [DOI] |
| 28. | Stewart L, Ponce R, Oesterle AL, Griffiss JM, Way LW. Pigment gallstone pathogenesis: slime production by biliary bacteria is more important than beta-glucuronidase production. J Gastrointest Surg. 2000;4:547-553. [PubMed] [DOI] |
| 29. | Jayanthi V, Anand L, Ashok L, Srinivasan V. Dietary factors in pathogenesis of gallstone disease in southern India-a hospital-based case-control study. Indian J Gastroenterol. 2005;24:97-99. [PubMed] |
| 30. | Stewart L, Oesterle AL, Erdan I, Griffiss JM, Way LW. Pathogenesis of pigment gallstones in Western societies: the central role of bacteria. J Gastrointest Surg. 2002;6:891-903. [PubMed] [DOI] |
| 31. | Donovan JM. Physical and metabolic factors in gallstone pathogenesis. Gastroenterol Clin North Am. 1999;28:75-97. [PubMed] [DOI] |
| 32. | Rege RV. The role of biliary calcium in gallstone pathogenesis. Front Biosci. 2002;7:e315-e325. [PubMed] [DOI] |
| 33. | Osnes T, Sandstad O, Skar V, Osnes M. beta-Glucuronidase in common duct bile, methodological aspects, variation of pH optima and relation to gallstones. Scand J Clin Lab Invest. 1997;57:307-315. [PubMed] [DOI] |