修回日期: 2005-09-25
接受日期: 2005-09-30
在线出版日期: 2005-12-28
目的: 观察补肾 (左归丸) 对小鼠骨髓形成肝细胞的影响, 揭示"肾生骨髓, 髓生肝"的科学内涵.
方法: 采用交叉性别骨髓移植模型, 雌性BALB/c小鼠随机分为补肾组 (左归丸)、补气血组 (八珍汤) 和对照组 (生理盐水), 接受9.0Gy 60Co源γ射线照射后, 经尾静脉注射输入同种系雄性小鼠骨髓细胞, 骨髓移植后分别给予7 g/(kg•d) 左归丸、八珍汤、生理盐水灌胃, 给药2、4、6 mo处死动物, 取肝组织标本. 通过荧光原位杂交检测肝组织切片雄性性别决定基因Sry与白蛋白mRNA双阳性细胞 (雄性骨髓来源的肝细胞), 计算各组骨髓转化为肝细胞的阳性细胞率 (%).
结果: 补肾组、补气血组和对照组的阳性细胞率均随着骨髓移植时间的延长而增加, 移植后6 mo时间点骨髓转化为肝细胞的阳性细胞率 (18.25±3.36) 与2、4 mo时间点 (4.00±1.73, 4.80±1.30) 相比显著升高(P<0.01). 同一时间点不同组小鼠骨髓转化为肝细胞的阳性细胞率有显著差异, 骨髓移植后2 mo时补肾组阳性细胞率 (4.00±1.73) 高于补气血组 (1.20±0.45) 和对照组 (1.00±0.61)(P<0.01), 移植后4 mo时补肾组阳性细胞率 (4.80±1.30) 高于补气血组 (1.40±0.55)(P<0.01), 移植后6 mo时补肾组阳性细胞率 (18.25±3.36) 高于补气血组 (7.20±1.33) 和对照组 (9.25±1.31)(P<0.01).
结论: 补肾 (左归丸) 能够促进骨髓形成肝细胞. 补肾促进骨髓形成肝细胞的作用机制可能在于调节全身机能和改善肝脏微环境, 有利于骨髓细胞移行至肝脏并转化为肝细胞.
引文著录: 李瀚旻, 高翔, 晏雪生, 明安萍, 彭亚琴, 李晶津. 左归丸促进骨髓形成肝细胞的研究. 世界华人消化杂志 2005; 13(24): 2818-2822
Revised: September 25, 2005
Accepted: September 30, 2005
Published online: December 28, 2005
AIM: To observe the influence of nourishing kidney (using Zuoguiwan) on the formation of liver cells from bone marrow cells.
METHODS: The female BALB/c mice were randomly divided into kidney nourishing group (KN, treated by Zuoguiwan), Qi-Xue restorative group (QXR, treated by Bazhentang) and control group (NC, treated by normal saline). After whole body irradiation with 9.0 Gy 60Co γ-rays, the female mice were injected via the tail vein with bone marrow cells from homogenic male mice to establish bone marrow transplantation model. Zuoguiwan, Bazhentang and normal saline intragatrically given to the corresponding group at the same dose [7 g/(kg•d)] after bone marrow transplantation. The mice were sacrificed to obtain liver tissues at 2, 4, and 6 mo. Fluorescence in situ hybridization (FISH) for Chromosome Y (Sry) and albumin mRNA was used to detect liver cells derived from male bone marrow, and then the rate of positive cells was calculated.
RESULTS: The positive rates of liver cells in KN, QXR and NC group were all increased with the time increase after bone marrow transplantation. The positive rate in KN group at 6 mo was markedly elevated (18.25±3.36% vs 4.00±1.73%, 4.80±1.30%, P < 0.01). Furthermore, the positive rate in NK group was significantly higher than that in QXR group (2 mo: 4.00±1.73% vs 1.20±0.45%, P < 0.01; 4 mo: 4.80±1.30% vs 1.40±0.55%, P < 0.01; 18.25±3.36% vs 7.20±1.33%, P < 0.01) and NC group (2 mo: 4.00±1.73% vs 1.00±0.61%, P < 0.01; 6 mo: 18.25±3.36% vs 9.25±1.31%, P < 0.01) at the same time point.
CONCLUSION: Zuoguiwan can promote bone marrow cells' forming into liver cells in mice.
- Citation: Li HM, Gao X, Yan XS, Ming AP, Peng YQ, Li JJ. Promotion effect of Zuoguiwan on bone marrow cells' forming into liver cells in mice. Shijie Huaren Xiaohua Zazhi 2005; 13(24): 2818-2822
- URL: https://www.wjgnet.com/1009-3079/full/v13/i24/2818.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i24.2818
"肝肾同源"的理论基础源于《素问·阴阳应象大论》"肾生骨髓, 髓生肝"的精辟论断[1-4]. 由于受经典胚胎发育学有关源于中胚层的骨髓不会产生源于内胚层的肝脏等固有认识的限制, 长久以来缺乏对"肾藏精、精生髓成肝"的研究. 近些年来, 国内外学者突破经典胚胎发育学的某些固有认识, 获得了一系列创新性强和应用前景广阔的研究成果. 特别是随着骨髓干细胞研究的深入, "髓生肝"的科学内涵逐渐被揭示[5-10]. 在此基础上, 我们提出"补肾生髓成肝"的科学假说, 开展补肾促进骨髓形成肝细胞的实验研究.
1.1.1 实验动物与分组: BABL/C小鼠, 4周龄, 雌性120只、雄性60只, SPF级, 湖北省预防医学院动物中心提供. 雌性小鼠随机分为补肾组[7g/(kg·d)左归丸灌胃]、补气血[7g/(kg·d)八珍汤灌胃]组、移植对照组 (等体积生理盐水灌胃), 每组40只, 骨髓移植术前1 wk起饮水中加入红霉素(250 mg/L)和庆大霉素(320 mg/L)以清洁消化道.
1.1.2 实验药物: 左归丸由熟地、淮山药、枸杞子、山茱萸、菟丝子、川牛膝、鹿角胶、龟板胶依次按8:4:4:4:4:3:4:4称重, 前六味水煎, 后两味加温熔于其中, 用蒸馏水调浓度为100%, 0.1 mPa×15 min灭菌, 4 ℃保存. 八珍汤由人参10 g, 白术10 g, 茯苓10 g,甘草6 g, 当归15 g, 川芎10 g, 白芍15 g, 熟地15 g组成, 制备方法、浓度和保存方法同上.
1.2.1 骨髓移植: 雄性小鼠颈椎脱臼处死, 750 mL/L乙醇浸泡10 min, 无菌条件下取股骨、剪开干骺端, 用5 mL注射器吸取0.5 mL RPMI-1640液冲出骨髓, 过6#针头3次、4#针头2次制成单个细胞悬液, 记数并调整细胞浓度为1×107/mL. 雌性小鼠接受60Co源γ射线全身照射、总剂量9 Gy, 然后经尾静脉输入制备好的雄性小鼠骨髓细胞悬液0.2 mL(约2×106个细胞). 移植雄性小鼠骨髓的雌性小鼠饲养于SPF级动物房, 饮水中加入红霉素(250 mg/L)和庆大霉素(320 mg/L), 每天更换垫料和饮水, 垫料、饲料和饮水均经高温消毒.
1.2.2 标本采集与处理: 分别于给药2、4、6 mo后, 颈椎脱臼处死小鼠, 无菌条件下切取肝脏左叶, 16 g/L福尔马林固定, 石蜡包埋. 取实验动物肝组织蜡块切取5 µm连续切片, 45 ℃水洗, 附贴于载玻片, 干燥后60 ℃烘烤至石蜡完全融化. 二甲苯脱蜡, 依次用1000、950、850、700 mL/L乙醇处理, 水洗, 空气中干燥备用. 以正常雄性小鼠肝组织切片作为阳性对照, RNA酶处理的正常雌性小鼠肝组织切片作为阴性对照.
1.2.3 杂交探针制备: 雄性性别决定基因Sry基因探针根据小鼠Y染色体性别决定区序列 (GenBank登记号: NM 011564)设计, 白蛋白mRNA探针根据小鼠白蛋白mRNA序列 (GenBank登记号: AJ011413) 设计. Sry基因探针用地高辛标记, 白蛋白mRNA探针用生物素标记. 探针由上海闪晶分子生物技术研究所设计、合成, 序列如下: Sry基因探针: TCAGTGGCTT TTAGCTCTTA CACTTTAAGT TTTGACTTCT GTATCTGTCT GTCTCTGTCT GTCTCTGTCT GTCTGTCTGT CTTTGTCTGT CTGTCTGTTT CTCTTTGCAT CACATCTCTG TCTTTTTGGT TGCAATCATA ATTCTTCCAT TATGTTCAGC ATTTCAGATC TTGATTTTTA GTGTTCAGCC CTACAGCCAC ATGATATCTT AAACTCTGAA GAAGAGACAA GTTTTGGGAC TGG 白蛋白mRNA探针: ACCAAAGTCAACAAGGAGTGCTGCCATGGT GACCTGCTGGAATGCGCAGATGACAGGGCGGAACTTGCCAAGTACATGTG TGAAAACCAGGCGACTATCTCCAGCAAACTGCAGACTTGC TGCGATAAAC CACTGTTGAAGAAAGCCCACTGTCTTAGTGGGTGGAGCATGACACCATGCCTGCTGATC TGCCTGCCAT TGCTGCTGAT TTTGTTGA
1.2.4 杂交: 石蜡切片60 ℃热固定过夜, 切片在二甲苯中浸泡10 min、晾干, 3:1甲醇/乙酸浸泡30 s、晾干, 滴加10 µL蛋白酶K(10 mg/L)、37 ℃消化20 min. 2×SSC洗10 min, 双蒸水冲洗, 依次用700、850、1000 mL/L乙醇脱水. 将载玻片放入变性液 (70%Formamide, 2×SSC, 75 ℃) 中变性5 min, 经700、850、1 000 mL/L梯度乙醇脱水, 置空气中干燥.阴性对照切片杂交前用20 mg/L RNA酶消化15 min, Buffer A冲洗5 min、2次, 空气中干燥备用. 将7 µL原位杂交缓冲液、2 µL探针(Sry基因探针、白蛋白mRNA探针各1 µL)、1 µL Cot-1 DNA混匀, 95 ℃预杂交5 min后滴加在载玻片上, 盖上原位杂交专用盖玻片, 放入湿盒, 置37 ℃恒温箱内杂交过夜. 甲酰胺洗液45 ℃洗10 min、2次, Tween洗液室温洗2 min、2次, 4×SSC室温洗2 min,滴加鼠抗地高辛抗体40 µL孵育2 h, 0.5 mol/L PBS洗5 min、3次. 滴加TRITC标记山羊抗鼠 (1:50)、FITC标记的卵白素 (1:50)孵育2 h, Buffer B洗2 min、3次, Buffer C洗2 min, DAPI(1 mg/L) 复染, 37 ℃, 15 min.荧光信号增强封片剂封片, 镜下观察.
1.2.5 图象采集与分析: 荧光显微镜下观察, TRITC激发波长568nm、发射波长585 nm; FITC激发波长488 nm、发射滤片波长568 nm;DAPI激发波长372 nm, 发射波长488 nm. Leica FISH软件进行图像采集, 每张切片随机选取10个视野(油镜), 每个视野细胞数约10-30个, 记录双阳性细胞率.
统计学处理 所得数据用统计软件SPSS10.0分析. P<0.05认为显著差异.
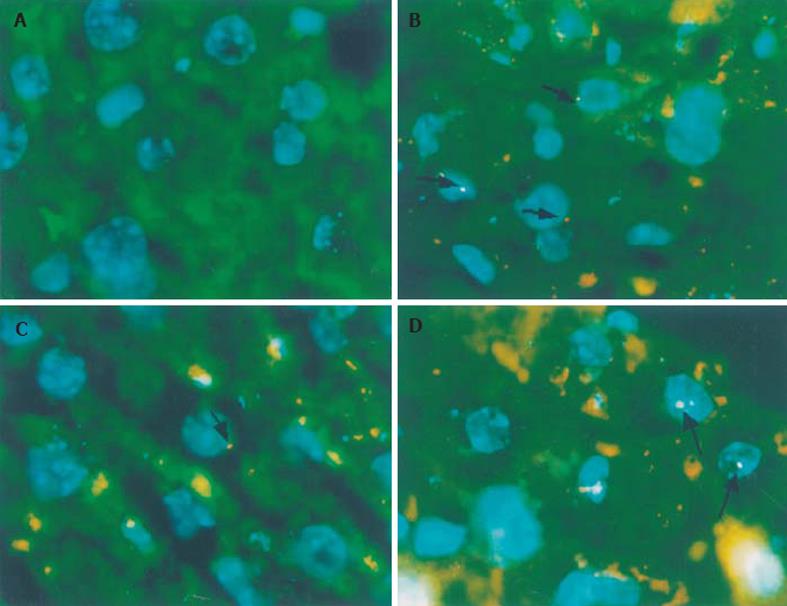
FISH图像中肝细胞自发荧光呈绿色, Sry基因用TRTIC显色、呈红色或浅红色(图中箭头处), 白蛋白mRNA用FITC显色、呈黄绿色, DAPI复染后细胞核呈蓝色(见图1A-D). Sry基因阳性说明该细胞源于移植的雄性骨髓, 白蛋白mRNA阳性说明该细胞具有成熟肝细胞产生白蛋白的功能, 因此图像中的双阳性细胞就是骨髓来源的肝细胞, 阳性细胞率在目前是反映骨髓细胞形成肝细胞转化率的可靠指标.
各组实验小鼠不同时间点阳性细胞率有显著变化, 补肾组、补气血组和移植对照组的阳性细胞率均随着骨髓移植时间的延长而增加, 移植后6 mo时点的阳性细胞率与移植后2 mo、4 mo时点相比明显升高、差异具有显著性(P<0.01). 同一时间点不同组实验小鼠的阳性细胞率之间有显著差异, 骨髓移植后2 mo时补肾组阳性细胞率高于补气血组和对照组(P<0.01), 移植后4 mo时补肾组阳性细胞率高于补气血组(P<0.01), 移植后6 mo时补肾组阳性细胞率高于补气血组和移植对照组(P<0.01) (表1).
鉴于有关人类胚胎干细胞的研究受到伦理道德和法律的限制, 成体干细胞的研究越来越受到重视. 最近的许多研究证明, 骨髓中的干细胞在特定环境下可分化成为多种组织细胞[11-15], 骨髓细胞向肝细胞横向分化的潜能已得到肯定[16,17]. 但是, 骨髓转化为肝细胞的自然转化率较低 (2%左右)[18-20], 不能满足临床应用的需要. 因此, 如何提高其转化率, 使之能够应用于临床是目前学术界关注的热点和难点.
我们根据《内经》"肾生骨髓, 髓生肝"的理论认识, 结合现代"肾生骨髓"和"髓生肝"研究基础, 提出"补肾生髓成肝"的科学假说, 开展补肾促进骨髓形成肝细胞的实验研究, 探讨补肾促进骨髓形成肝细胞的方法和机制, 为进一步运用左归丸及其活性成分从骨髓诱导分化、扩增肝细胞产生人工肝以及在临床中运用补肾结合骨髓移植(或骨髓干细胞移植)治疗肝脏疾病, 奠定坚实的实验基础和提供分子生物学的理论指导, 揭示"肾生骨髓, 髓生肝" (补肾生髓成肝) 的科学内涵.
我们前期研究结果显示[21-30], 肝肾精血亏虚证大鼠模型肝再生过程严重失调, 肝再生度、肝细胞分裂指数和肝质量/体质量比值等均低于正常水平, 同时出现骨髓造血机能减退, 应用左归丸补肾能使模型动物上述指标显著回升, 明显促进肝再生, 并通过刺激骨髓有核细胞增生而恢复其造血机能, 这就提示了通过补肾促进骨髓形成肝细胞的可能性. 为了研究补肾能否提高骨髓形成肝细胞的转化率, 我们采用骨髓形成肝细胞动物模型 (骨髓受损的雌性小鼠接受雄性小鼠骨髓移植) 对比观察补肾 (左归丸) 对实验小鼠骨髓形成肝细胞的影响. 我们利用γ射线致死剂量照射破坏雌性小鼠骨髓后, 进行同种系雄性小鼠全骨髓细胞移植, 术后分别给予补肾方药(左归丸)、补气血方药 (八珍汤)和生理盐水灌胃, 通过测定小鼠肝组织切片中雄性性别决定基因 (Sry基因) 和白蛋白mRNA双阳性细胞―即骨髓来源的肝细胞―来观察不同药物对骨髓形成肝细胞的影响. 实验结果显示, 灌胃给药2 mo后补肾组小鼠肝组织切片双阳性细胞率高于补气血组和模型组 (生理盐水组), 给药4 mo后补肾组双阳性细胞率高于补气血组, 给药6 mo后补肾组双阳性细胞率高于补气血组和模型组, 统计分析证明其差别具有显著性, 提示补肾 (左归丸) 能够促进骨髓形成肝细胞, 且其作用优于补气血 (八珍汤). 其作用机制可能是在于调节全身机能和改善肝脏微环境, 有利于骨髓细胞移行至肝脏并转化为肝细胞. 本研究结果为"补肾生髓成肝"的理论认识提供了实验依据, 为骨髓干细胞在肝病临床应用奠定了坚实的实验基础.
电编: 张勇 编辑: 菅鑫妍 审读: 张海宁
| 1. | 李 瀚旻. "肝肾同源"的现代研究进展、评述与展望. 中国中医基础医学杂志. 2002;8:75-76. |
| 3. | 李 瀚旻. "肝肾同源"的理论探讨. 中国中医基础医学杂志. 2000;6:425-429. |
| 5. | Petersen BE, Goff JP, Greenberger JS, Michalopoulos GK. Hepatic oval cells express the hematopoietic stem cell marker Thy-1 in the rat. Hepatology. 1998;27:433-445. [PubMed] [DOI] |
| 6. | Omori N, Omori M, Evarts RP, Teramoto T, Miller MJ, Hoang TN, Thorgeirsson SS. Partial coloning of rat CD34 cDNA and expression during stem cell-dependent liver cell regeneration in the adult rat. Hepatology. 1997;26:720-727. [PubMed] [DOI] |
| 7. | Omori M, Omori N, Evarts RP, Teramoto T, Thorgeirsson SS. Coexpression of flt-3 ligang/flt-3 and SCF/C-kit signal transduction system in bile duct ligated SI and W mice. Am J Pathol. 1997;150:1179-1187. [PubMed] |
| 8. | Theise ND, Badve S, Saxena R, Henegariu O, Sell S, Crawford JM, Krause DS. Derivation of hepatocytes from bone marrow cells in mice after radiation-induced myeloablation. Hepatology. 2000;31:235-240. [PubMed] [DOI] |
| 9. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 10. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 11. | Ferrari G, Cusella-De Angelis G, Coletta M, Paolucci E, Stornaiuolo A, Cossu G, Mavilio F. Muscle regeneration by bone marrow-derived myogenic progenitors. Science. 1998;279:1528-1530. [PubMed] [DOI] |
| 12. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] [DOI] |
| 13. | Sanchez-Ramos J, Song S, Cardozo-Pelaez F, Hazzi C, Stedeford T, Willing A, Freeman TB, Saporta S, Janssen W, Patel N. Adult bone marrow stromal cells differentiate into neural cells in vitro. Exp Neu rol. 2000;164:247-256. [PubMed] [DOI] |
| 14. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] [DOI] |
| 17. | 李 瀚旻, 晏 雪生, 明 安萍, 彭 亚琴, 罗 建君, 兰 少波, 高 翔. 肝脏细胞条件培养基诱导大鼠骨髓间质细胞分化为肝细胞的作用. 中西医结合肝病杂志. 2005;15:28-30. |
| 18. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 19. | Mallet VO, Mitchell C, Mezey E, Fabre M, Guidotti JE, Renia L, Coulombel L, Kahn A, Gilgenkrantz H. Bone marrow transplantation in mice leads to a minor population of hepatocytes that can be selectively amplified in vivo. Hepatology. 2002;35:799-804. [PubMed] [DOI] |
| 20. | Li J, Ning G, Duncan SA. Mammalian hepatocyte differ-entiation requires the transcription factor HNF-4alpha. Genes Dev. 2000;14:464-474. [PubMed] |
| 21. | 李 瀚旻, 张 六通, 梅 家俊, 邱 幸凡, 王 平. "肝肾精血亏虚大鼠"动物模型的建立. 中国中医基础医学杂志. 2001;7:291-295. |
| 26. | Li HM, Gao X, Yang ML, Mei JJ, Zhang LT, Qiu XF. Effects of Zuogui Wan on neurocyte apoptosis and down-regulation of TGF-beta1 expression in nuclei of arcuate hypothalamus of monosodium glutamate -liver regeneration rats. World J Gastroenterol. 2004;10:2823-2826. [PubMed] [DOI] |
| 28. | 李 瀚旻, 高 翔, 周 密思. 左归丸针对性调节MSG-肝再生-大鼠再生肝组织基因表达. 中国中医基础医学杂志. 2005;11:595-598. |