修回日期: 2005-08-20
接受日期: 2005-08-26
在线出版日期: 2005-12-15
目的: 介绍一种有效鉴别纳米细菌的金标记免疫电镜方法.
方法: 纳米细菌经25 g/L戊二醛固定、树脂包埋后, 用钻石刀制成超薄切片, 用纳米细菌特异性抗体进行间接金标免疫电镜染色.
结果: 纳米细菌经负染后于透射电镜下观察, 呈球形或短棒状颗粒, 大小约为80-350 nm. 纳米细菌可以和特异性抗体结合, 在电镜下表现为胶体金颗粒的附着.
结论: 采用免疫电镜的方法, 在较好地显示纳米细菌超微结构的同时, 又可以指示其独特的抗原性.
引文著录: 王利民, 沈文律, 周珍, 张士莲. 纳米细菌的免疫电镜检测. 世界华人消化杂志 2005; 13(23): 2803-2805
Revised: August 20, 2005
Accepted: August 26, 2005
Published online: December 15, 2005
AIM: To introduce an effective method of immunogold electron microscopy for the detection of nanobacteria.
METHODS: Nanobacteria were fixed in the 25 g/L glut-araldehyde, and then were embedded in resin. After they were cut into ultrathin slices by diamond knife, an indirect immunogold electronic microscopy staining was performed on the nanobacteria using the specific antibody of nanobacteria.
RESULTS: The nanobacteria were ball- or stick-like with a length of 80-350 nm under electron microscope. Nanobacteria were combined with the specific antibo-dy. The adhesion of the immune colloidal gold granule was observed under the electronic microscopy.
CONCLUSION: The immune electronic microscopy can not only reveal the ultrastructure of nanobacteria, but also indicate its special antigenicity.
- Citation: Wang LM, Shen WL, Zhou Z, Zhang SL. Detection of nanobacteria by immune electronic microscopy. Shijie Huaren Xiaohua Zazhi 2005; 13(23): 2803-2805
- URL: https://www.wjgnet.com/1009-3079/full/v13/i23/2803.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i23.2803
芬兰科学家Kajander et al[1]进行哺乳动物细胞培养时, 发现纳米细菌(nanobacteria, Nb)是迄今为止在人体内发现的最小的有细胞壁的细菌, 其直径80-500 nm, 呈球状或球杆状, 细胞壁厚, 无荚膜与鞭毛结构, 体积极小, 可通过0.1-0.4 µm的滤菌膜, 普通的细菌学检测方法很难发现. 纳米细菌在pH 7.4和生理性钙、磷浓度中能形成羟磷灰石碳酸盐结晶, 产生坚硬的钙化外壳覆盖于菌体周围, 因此在高温、强酸等条件下仍能存活. 纳米细菌不能用普通微生物培养基培养, 但在37℃、pH 7.4和50 mL/L CO2条件下的细胞培养基中生长良好. 纳米细菌感染, 可以引起肾结石的形成[2,3]以及动脉粥样硬化[4-6], 并且与胆结石的发生有密切关系[7], 因此纳米细菌的研究越来越受到医学界的重视.
纳米细菌极其微小, 普通的光学显微镜根本无法对其进行观察, 而高分辨的电子显微镜则能清晰的显示其结构. 我们介绍一种检测纳米细菌的免疫电镜方法.
透射电子显微镜: JEM 2010型, 日本, 工作电压80 kV; 扫描电子显微镜: KYKY 2800型, 中国; 冷冻离心机: Hettich UNIVERSAL 16R型, 德国; Mouse anti-nanobacteria mAb 8D10: Nanobac Oy, 芬兰; Colloidal gold-affinipure goat anti-mouse lgG: Jackson Immuno, 美国; 纳米细菌: Nanobac Oy, 芬兰.
纳米细菌在细胞培养条件下培养4 wk, 取出培养瓶, 旋紧瓶口螺纹盖, 置于超声清洗仪器中, 超声处理5 min, 使贴附于培养瓶壁的纳米细菌脱落, 并使聚集成团的纳米细菌分散, 混匀, 吸取2 mL培养液, 12 000 g离心20 min, 弃上清液, PBS洗涤沉淀, 25 mL/L戊二醛4℃固定24 h, 双蒸水洗涤5 min×3次, 12 000 g离心后加入0.5 mL无水乙醇制成混悬液. 在配有VANTAGE DSI型能谱仪的KYKY 2800型扫描电镜上, 对其进行能谱分析, 工作电压20 kV.
上述经戊二醛固定的纳米细菌用双蒸水洗涤5 min×3次, 12 000 g离心后加入0.5 mL双蒸水制成混悬液. 将附有碳支持膜的200目铜网浮于上述悬液的液滴上5 min, 用滤纸小心吸除液体, 再置于10 mL/L磷钨酸悬液的液滴上90 s, 用滤纸小心吸除液体、晾干, 在JEM 2010透射电镜下观察, 工作电压80 kV.
胶体金标记抗体免疫电镜检测采用包埋后染色法, 上述标本离心后弃上清, 沉淀用10 mL/L四氧化锇后固定2 h, 梯度乙醇脱水, 环氧树脂包埋, 用钻石刀进行超薄切片, 切片置于200目有膜铜网上, 将铜网浮于100 mL/L FBS滴上, 室温40 min, 一抗(100 mg/L, mouse anti-nanobacteria mAb 8D10, Nanobac Oy)室温孵育60 min后4℃过夜, pH 7.4 PBS洗3 min×3次, pH 8.2 PBS洗5 min, 加1∶20稀释的12 nm胶体金标记羊抗小鼠IgG, 室温孵育45 min, 双蒸水洗3 min×3次, 50 mL/L醋酸铀染色5 min, 双蒸水洗3 min×3次, 枸橼酸铅染色5 min, 双蒸水充分洗涤, 干燥后在JEM 100CX透射电镜下观察, PBS 替代一抗作为阴性对照.
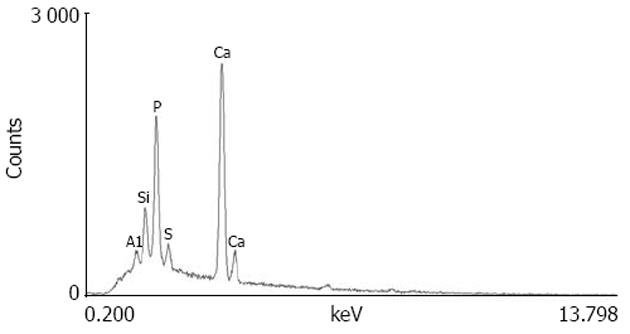
能谱分析显示, 纳米细菌含有钙、磷、铝、硅、硫、铜、铁等元素, 其钙磷比值为1.58(图1), 与羟基磷灰石中钙磷比值相似.
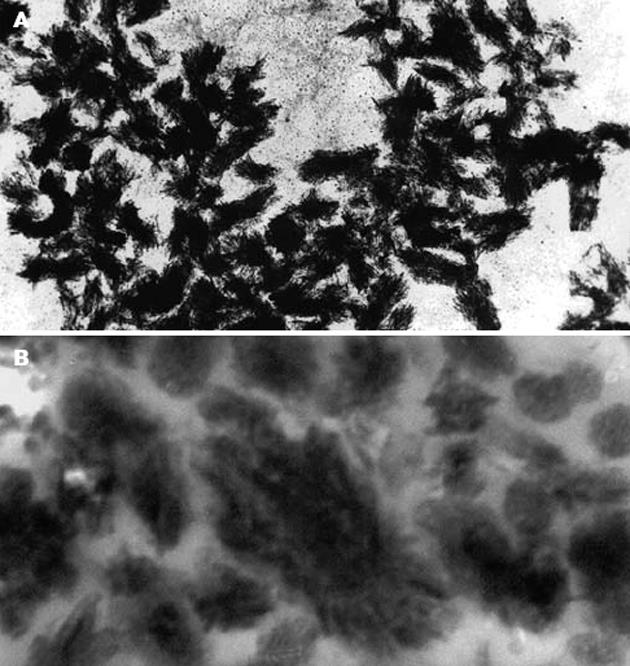
纳米细菌经负染后于透射电镜下观察, 呈球形或短棒状颗粒, 大小约为80-350 nm, 聚集成簇状(图2A), 超薄切片显示其表面被覆针样的由羟基磷灰石构成的细菌被膜(biofilm)(图2B).
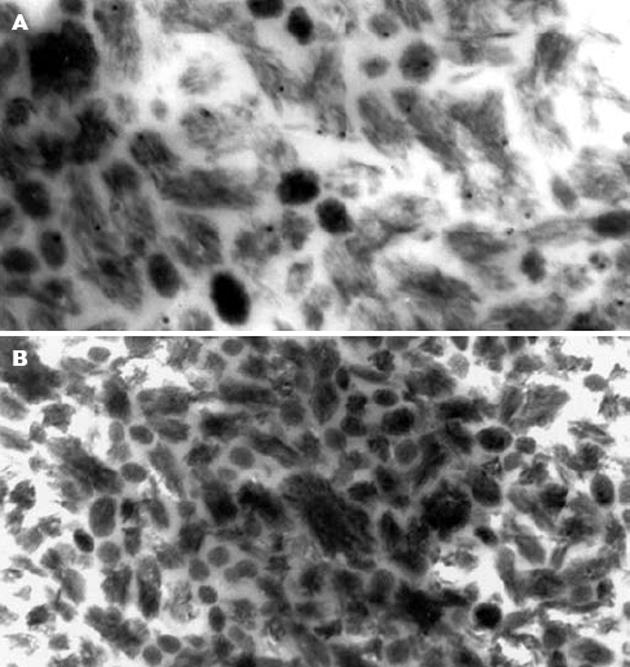
应用鼠抗纳米细菌的特异性单克隆抗体对其进行免疫学染色, 并用胶体金标记的二抗进行定位显示, 电镜结果显示胆汁中培养所得的纳米颗粒与纳米细菌抗体产生特异性结合(图3A). 而在以PBS代替8D10抗体的阴性对照中, 未观察到胶体金颗粒(图3B).
芬兰科学家Kajander发现了能导致细胞培养污染并杀死培养细胞的纳米细菌. 迄今为止, 纳米细菌是已知能在人类和哺乳动物血液中生存的、最小的、能够进行自我增殖的细菌. 他们的大小以纳米计, 直径由50-500 nm, 因此, 只能在电子显微镜和其他高分辨率显微镜下[8]才能观察到他们. 纳米细菌是一种极其微小的细胞内生长的细菌, 当处于不利于生长的环境中时, 能形成一层含钙的磷酸盐外壳, 这层含钙的生物膜同样能使他们在对大多数微生物来说都难以生存的、有害的理化条件中存活下来, 并且能作为结晶的核心促进肾结石的形成. 纳米细菌有着与众不同的特征, 包括: 耐高温、可以通过直径0.1 µm的滤菌膜、改变外形、形成并且调节自身机能以适应周围各种环境因素的变化[1,9].
尽管大量的研究显示, 在人类和部分哺乳动物体内确实存在着纳米细菌感染[2,4-7,10-15], 但是也有一部分学者对纳米细菌的存在提出了质疑[16]. 争论的焦点在于, 纳米细菌体型过于微小, 以至于无法用现有的微生物学理论解释纳米细菌的许多特性, 而以往关于纳米细菌的报道, 大多是以电镜为主的形态学研究. 因此部分学者认为纳米细菌其实并不存在[17]. 我们利用免疫电镜的方法, 成功地在显示纳米细菌超微结构的同时, 将其独特的抗原性显示出来, 为进一步研究纳米细菌与人类疾病的关系提供了一种非常有价值的研究方法. 采用这种方法, 能非常容易的将纳米细菌与其他纳米级无机物鉴别开来. 我们期待着能有更多的学者研究纳米细菌感染对人类健康的影响.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Kajander EO, Ciftcioglu N. Nanobacteria: an alternative mech-anism for pathogenic intra- and extracellular calcification and stone formation. Proc Natl Acad Sci USA. 1998;95:8274-8279. [PubMed] [DOI] |
| 2. | Ciftcioglu N, Bjorklund M, Kuorikoski K, Bergstrom K, Kajan-der EO. Nanobacteria: an infectious cause for kidney stone formation. Kidney Int. 1999;56:1893-1898. [PubMed] [DOI] |
| 3. | Garcia Cuerpo E, Olavi Kajander E, Ciftcioglu N, Lovaco Castellano F, Correa C, Gonzalez J, Mampaso F, Liano F, Garcia de Gabiola E, Escudero Barrilero A. Nanobacteria. An experimental neo-lithogenesis model. Arch Esp Urol. 2000;53:291-303. [PubMed] |
| 4. | Maniscalco BS, Taylor KA. Calcification in coronary artery disease can be reversed by EDTA-tetracycline long-term chem- otherapy. Pathophysiology. 2004;11:95-101. [PubMed] [DOI] |
| 5. | Miller VM, Rodgers G, Charlesworth JA, Kirkland B, Severson SR, Rasmussen TE, Yagubyan M, Rodgers JC, Cockerill FR 3rd, Folk RL, Rzewuska-Lech E, Kumar V, Farell-Baril G, Lieske JC. Evidence of nanobacterial-like structures in calcified human arteries and cardiac valves. Am J Physiol Heart Circ Physiol. 2004;287:H1115-H1124. [PubMed] [DOI] |
| 6. | Sommer AP, Oron U, Pretorius AM, McKay DS, Ciftcioglu N, Mester AR, Kajander EO, Whelan HT. A preliminary investigation into light-modulated replication of nanobacteria and heart disease. J Clin Laser Med Surg. 2003;21:231-235. [PubMed] [DOI] |
| 7. | Wang XJ, Liu W, Yang ZL, Wei H, Wen Y, Li YG. The detection of nanobacteria infection in serum of healthy Chinese people. Zhonghua Liuxingbingxue Zazhi. 2004;25:492-494. [PubMed] |
| 8. | Kempe A, Schopf JW, Altermann W, Kudryavtsev AB, Heckl WM. Atomic force microscopy of Precambrian microscopic fossils. Proc Natl Acad Sci USA. 2002;99:9117-9120. [PubMed] [DOI] |
| 9. | Kajander EO, Kuronen I, Åkerman K, Pelttari A, Çiftçioglu N. Nanobacteria from blood, the smallest culturable autonomously replicating agent on earth. Proc SPIE Int Soc Opt Eng. 1997;3111:420-428. [DOI] |
| 10. | Lopez-Brea M, Selgas R. Nanobacteria as a cause of renal di-seases and vascular calcifying pathology in renal patients ("en-dovascular lithiasis". Enferm Infecc Microbiol Clin. 2000;18:491-492. [PubMed] |
| 11. | Conte Visus A, Grases Freixedas F, Costa-Bauza A, Piza Reus P. Microinfections and kidney lithiasis. Arch Esp Urol. 2001;54:855-860. [PubMed] |
| 12. | Li Y, Wen Y, Yang Z, Wei H, Liu W, Tan A, Wu X, Wang Q, Huang S, Kajander EO. Culture and identification of nanobacteria in bile. Zhonghua Yixue Zazhi. 2002;82:1557-1560. [PubMed] |
| 13. | Kajander EO, Ciftcioglu N, Aho K, Garcia-Cuerpo E. Characte-ristics of nanobacteria and their possible role in stone formation. Urol Res. 2003;31:47-54. [PubMed] |
| 14. | Sedivy R, Battistutti WB. Nanobacteria promote crystallization of psammoma bodies in ovarian cancer. APMIS. 2003;111:951-954. [PubMed] [DOI] |
| 15. | Hjelle JT, Miller-Hjelle MA, Poxton IR, Kajander EO, Ciftcioglu N, Jones ML, Caughey RC, Brown R, Millikin PD, Darras FS. Endotoxin and nanobacteria in polycystic kidney disease. Kidney Int. 2000;57:2360-2374. [PubMed] [DOI] |
| 17. | Cisar JO, Xu DQ, Thompson J, Swaim W, Hu L, Kopecko DJ. An alternative interpretation of nanobacteria-induced biomine-ralization. Proc Natl Acad Sci USA. 2000;97:11511-11515. [PubMed] [DOI] |