修回日期: 2005-10-01
接受日期: 2005-10-08
在线出版日期: 2005-12-15
目的: 研究黏附分子P选择素L-EGF单抗在SCID小鼠胃癌转移中的治疗作用及其机制.
方法: 用SGC-7901人胃癌组织原位移植SCID小鼠建立转移模型. 术后第3天开始, 动物分别静脉注射生理盐水(生理盐水组, n = 11)或P选择素L-EGF单克隆抗体(L-EGF单抗组, n = 9), 6 wk末取部分胃癌组织、肿大淋巴结和可疑转移脏器作病理检查; 同时取部分胃癌组织作荧光定量PCR检测.
结果: 生理盐水组肿瘤转移率为81.8%(9/11), L-EGF单抗组转移率为11.1%(1/9), 两组相比有显著性差异(P<0.05). 荧光定量PCR测定显示, SCID小鼠伴有癌转移者其胃癌中P选择素mRNA表达较不伴癌转移者明显增强; L-EGF单抗组P选择素mRNA表达较生理盐水组低(Ct值: 20.54±2.20 vs 17.09±1.40, P<0.05).
结论: P选择素与癌转移密切相关, 其L-EGF单抗具有抗转移作用; 其机制可能与阻断癌细胞与血管内皮的黏附以及抑制P选择素基因表达有关.
引文著录: 陈金联, 陈明祥, 陆金来, 陈维雄, 朱金水, 陈尼维, 陆允敏, 周同, 吴云林, 陈国强. P选择素 L-EGF 单抗对 SCID 小鼠胃癌转移抑制作用. 世界华人消化杂志 2005; 13(23): 2791-2794
Revised: October 1, 2005
Accepted: October 8, 2005
Published online: December 15, 2005
AIM: To investigate the role of cell adhesion molecule P-selectin L-EGF monoclonal antibody (L-EGF Mab) in the inhibition of the metastasis of gastric cancer in sev-ere combined immunodeficient (SCID) mice.
METHODS: Human gastric cancer cell line SGC-7901 was orthotopically implanted into SCID mice to estab-lish metastatic model. At the 3rd day after implantation, the mice were intravenously injected with normal saline (n = 11) or P-selectin L-EGF Mab (n = 9). At the end of the 6th wk, pathological examinations were performed on the tissues from stomach and other possible invad-ed organs. Meanwhile, polymerase chain reaction was performed on the gastric cancer tissues.
RESULTS: The metastatic rate in the mice treated with normal saline was 81.8% (9/11), and that in the mice treated with P-selectin L-EGF Mab was 11.1% (1/9). There was significant difference between them (P <0.05). The level of P-selectin mRNA expression in the gastric can-cer with metastasis was markedly increased in com-parison with that without metastasis, and P-selectin mRNA expression in the mice treated with P-selectin L-EGF Mab was significantly lower than that in the ones treated with normal saline (cycle threshold: 20.54±2.20 vs 17.09±1.40, P <0.05).
CONCLUSION: CONCLUSION: P-selectin adhesion molecule is related to tumor metastasis, and P-selectin L-EGF Mab can inhibit the metastasis by down-regulating the express-ion of P-selectin mRNA..
- Citation: Chen JL, Chen MX, Lu JL, Chen WX, Zhu JS, Chen NW, Lu YM, Zhou T, Wu YL, Chen GQ. Inhibition of P-selectin L-EGF monoclonal antibody on metastasis of human gastric carcinoma in severe combined immunodeficient mice. Shijie Huaren Xiaohua Zazhi 2005; 13(23): 2791-2794
- URL: https://www.wjgnet.com/1009-3079/full/v13/i23/2791.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i23.2791
胃癌是我国最常见的恶性肿瘤之一, 肿瘤转移为恶性肿瘤致死的关键因素. 肿瘤转移机制至今仍未完全明了. 近年研究表明, 细胞黏附分子在胃癌等肿瘤转移中起着十分重要的作用[1,2]. 我们已对胃癌组织进行P选择素表达研究, 发现P选择素在胃癌组织中表达与肿瘤转移和预后显著相关[3]. 最近我们用人胃癌组织原位移植SCID小鼠建立胃癌转移模型, 发现P选择素单克隆抗体对胃癌具有抗转移作用[4].
近年P选择素的分子结构与功能关系已引起重视. 研究认为, P选择素的凝集素与表皮生长因子结构域的共同区域(L-EGF)可能是其黏附更有效的功能域. 最近应用RT-PCR方法从人血小板克隆出L-EGF基因, 并成功地制备P选择素L-EGF单克隆抗体, 体外实验表明其可特异性结合P选择素, 具有抗活化血小板与中性粒细胞黏附的功能[5]. 迄今为止, 国内外未见P选择素L-EGF单克隆抗体抗肿瘤转移的动物实验研究报道. 我们在建立人胃癌组织原位移植SCID小鼠胃癌转移模型的基础上, 用荧光定量PCR技术研究胃癌组织P选择素表达与肿瘤转移的关系, 观察P选择素L-EGF单抗对胃癌转移的影响.
逆转录酶、Taq DNA聚合酶、上下游引物和荧光标记探针由中山大学达安基因股份有限公司(广州)提供. 重度联合免疫缺陷(SCID)小鼠, 健康, ♂, 6-7周龄, 体质量为20-25 g, 由中国科学院上海实验动物中心提供.
1.2.1 动物模型: SCID小鼠30只, 随机分为试验组(20只)和正常对照组(10只). 试验组动物模型制作采用裸鼠皮下传代的SGC-7901人胃癌组织原位移植方法[4]. 动物麻醉后, 切开左上腹皮肤、腹壁和腹膜, 暴露胃壁, 在胃大弯中部用剪刀损伤胃浆膜约3 mm大小, 用0号丝线将人胃癌组织块(150 mg, 约5 mm×7 mm大小)缝在损伤处, 然后将胃送入腹腔, 腹壁、皮肤用丝线缝合.
1.2.2 动物实验方法: 动物模型制作后, 动物随机分为生理盐水注射组(生理盐水组, n = 11)与P选择素L-EGF单克隆抗体注射组(L-EGF单抗组, n = 9). 术后第3 d, L-EGF单抗组静脉内注射P选择素L-EGF单克隆抗体(上海交通大学附属瑞金医院), 每次100 μg(以100 μL生理盐水稀释), 2次/wk, 共3 wk; 生理盐水组注射生理盐水, 每次100 μL, 2次/wk, 共3 wk. 此外, 正常对照组, n = 10, 不作胃癌组织原位移植与生理盐水或L-EGF单抗注射.
1.2.3 标本采集及病理学检查: 动物均于术后第6周末处死, 取胃壁生长的肿瘤组织、肿大淋巴结和可疑转移脏器, 40 g/L福尔马林固定, 石蜡包埋, 制作病理切片, HE染色, 观察肿瘤转移情况. 同时取部分胃癌组织置液氮下保存.
1.2.4 TRIzol法抽提总RNA: SCID小鼠胃癌组织总RNA提取按TRIzol法抽提. 组织块(约100 mg)置匀浆器, 加TRIZol(100 mg组织加TRIZol 2 mL), 冷冻匀浆, 置Eppendorf管, 15-30℃孵育5 min, 加入氯仿(0.2 mL氯仿/mL TRIZol), 15-30℃孵育2-3 min, 4℃ 12 000 g离心15 min, 取上清液至新的Eppendorf管, 加异丙醇(0.5 mL异丙醇/mL TRIzol), 15-30℃孵育样品10 min, 4℃ 12 000 g离心10 min, 弃上清液, 750 mL/L乙醇洗涤沉淀一次, 4℃ 7 500 g离心5 min, 弃乙醇, 空气或真空干燥5-10 min, 加DEPC处理水溶解RNA, -80℃保存备用.
1.2.5 鼠的P选择素荧光探针序: P selectin f: GCATACTCATGGAATAACTCACG; P selectin r: GACGTCATTGAGGTGAGCG; P selectin probe: AGGCACTTCACAGACTTAGTGGCCAT.
1.2.6 cDNA合成: 取出RNA模板, 分别加入2 μL已经标记好的消毒离心管中, RT-PCR试剂盒解冻, 依次加入稀释好的逆转录酶0.5 μL、dNTPs 0.2 μL、上、下游引物各0.2 μL、DEPC水4.9 μL、RT-buffer 2 μL, 总体积10 μL. 然后依次插入预先设置(37℃ 1 h、95℃ 3 min)加热模块, 逆转录cDNA完成, 放入-80℃冰箱备用.
1.2.7 荧光PCR: 取出消毒好的96孔联体反应板, 分别加入cDNA模板, 取出实时荧光定量PCR试剂盒解冻, 依次加入Taq酶1 μL、dNTPs 0.5 μL、上、下游引物各0.5 μL、荧光标记探针0.5 μL、5×buffer 10 μL、ddH2O 32 μL、cDNA 5 μL, 放入全自动实时荧光定量PCR仪(美国ABI 7000)板槽中. 扩增条件: (1)93℃ 2 min; (2)93℃ 30 s、55℃ 1 min共40个循环.
统计学处理 χ2精确法检验和t检验.
人胃癌组织SGC-7901原位移植SCID小鼠后, 于第6周末处死. 经病理检查发现, 胃癌局部生长良好, 肿瘤向胃腔内不规则突出, 质硬脆; 光镜下观察见低分化腺癌组织, 浸润黏膜下层、黏膜层和肌层.
小鼠胃癌原位移植术后6 wk, 生理盐水组肿瘤转移率为81.8%(9/11), 分别为淋巴结转移9例(9/11), 肝脏6例(6/11), 肺脏和胰腺各为2例. 但经P选择素L-EGF单克隆抗体注射治疗的SCID小鼠胃癌原位移植术后6 wk, 则肿瘤的脏器和淋巴结转移被抑制. L-EGF单抗治疗组发现1例转移(1/9), 仅发现淋巴结转移, 未发现肝脏等脏器转移. 余8例未发现有肿瘤转移. 经χ2检验, 两组差异显著, P<0.05. 此外, P选择素L-EGF单克隆抗体对胃癌原位移植肿瘤的生长未见影响.
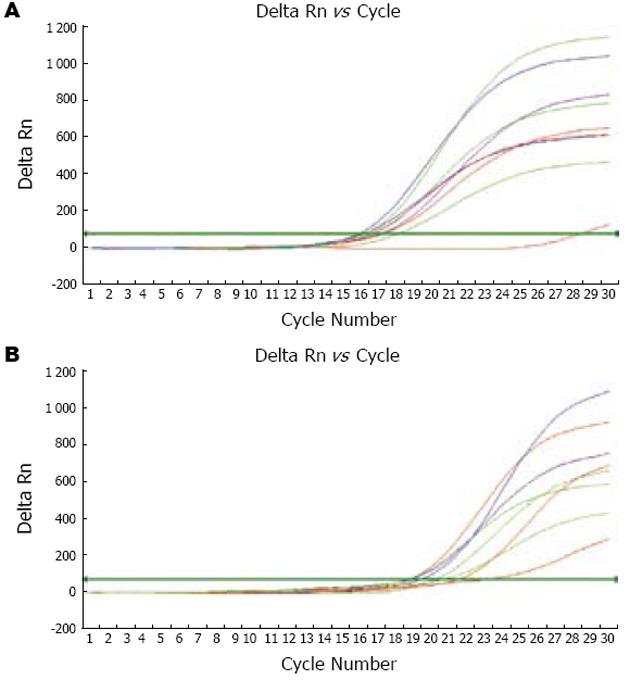
应用荧光定量PCR技术检测胃癌组织P选择素表达, 阈值循环圈数(Ct): 每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系, 起始拷贝数越多, Ct值越小. 结果发现, P选择素的表达明显不同. 生理盐水组11例中有9例P选择素mRNA荧光定量PCR的Ct值较低, 表明这9例P选择素mRNA表达较强, 经病理学检查发现这9例均伴有淋巴结和(或)脏器的肿瘤转移; 2例不伴肿瘤转移者, P选择素mRNA荧光定量PCR的Ct值较高, 表明其P选择素mRNA表达水平较低. 同时发现, L-EGF单抗组9例中有8例P选择素mRNA荧光定量PCR的Ct值较高, 表明这8例的P选择素mRNA表达较低; 1例P选择素mRNA表达与生理盐水组伴肿瘤转移者相近, 此例发现有淋巴结转移, 未发现肝脏等转移. 此外, 10例正常小鼠胃标本P选择素mRNA荧光定量PCR的Ct值较高, 表明正常小鼠胃组织P选择素mRNA表达均较低. 生理盐水组P选择素mRNA表达较正常小鼠胃组织P选择素mRNA表达明显增强, L-EGF单抗组P选择素mRNA表达较生理盐水组低, 各组之间差异有统计学意义(P<0.05)(图1AB, 表1).
| 组别 | n | P选择素mRNA的Ct值 |
| 生理盐水组 | 11 | 17.09±1.40 |
| L-EGF单抗组 | 9 | 20.54±2.20 |
| 正常对照组 | 10 | 28.38±2.63 |
近年来研究表明, 肿瘤的浸润和转移是一个复杂的多环节过程, 其中肿瘤细胞与细胞外基质和血管内皮细胞相互作用在肿瘤转移过程中起关键性的作用. 已知细胞与细胞、细胞与细胞外基质的黏附作用是通过黏附分子介导的. 近年来有关细胞黏附分子与肿瘤转移机制的研究已越来越被人们所重视. 选择素是新近确定的一类黏附分子家族, 其重要成分之一的P选择素(GMP140/颗粒表面膜蛋白, 分子质量140 ku)主要分布于中等大小血管内皮细胞棒状小体(Weibel-Palade)及血小板α颗粒, 并随这些细胞活化而迅速表达于细胞膜表面或释放至血液中[6]. 有关研究表明, P选择素通过介导肿瘤细胞与内皮细胞和血小板之间相互作用, 在肿瘤转移过程中可能起黏附介导作用[7-9].
我们已对60例胃癌患者进行免疫组化研究, 结果发现黏附分子受体P选择素不仅在肿瘤血管内皮上表达, 而且在肿瘤细胞膜上表达, 淋巴结有癌转移者P选择素阳性表达率明显高于无淋巴结转移者, 且阳性表达者的平均存活期和5年生存率明显低于阴性者[3]. 最近研究发现P选择素单克隆抗体对胃癌具有抗转移作用[4]. Tozawa et al[10]的研究表明, 肾细胞癌Lewis X抗原的表达与组织病理学指标和预后显著相关. Ferroni et al[11]测定了181例结肠癌, 34例良性疾病和181例正常对照者的血浆可溶性P选择素水平, 结果发现, 血浆可溶性P选择素水平与肿瘤转移相关, 是预测肿瘤复发的一项独立的预后因子. 研究表明, 选择素表达与肿瘤转移密切相关, 阳性表达者易浸润转移, 因此预后较差.
近年P选择素的分子结构与功能关系已引起重视. 选择素分子含有凝集素样区、表皮生长因子样区(EGF样区)、补体蛋白重复序列区、疏水跨膜区和胞质短尾. 一般认为, P选择素分子胞外区的凝集素结构域可能是P选择素识别配基并介导细胞间黏附的主要活性部位, 但还需要胞外区表皮生长因子结构域的稳定和调节, 增强其黏附亲和力与特异性. 因此, P选择素的凝集素与表皮生长因子结构域的共同区域(L-EGF)可能是其黏附更有效的功能域. 为进一步探讨P选择素在肿瘤转移过程中的作用及其抗黏附治疗意义, 最近应用RT-PCR方法从人血小板克隆出L-EGF基因, 并成功地制备P选择素L-EGF单克隆抗体, 体外实验表明其可特异性结合P选择素, 具有抗活化血小板与中性粒细胞黏附的功能. TNFα诱导血管内皮细胞活化, 从而表达P选择素, 而P选择素L-EGF单克隆抗体可明显抑制活化内皮细胞与中性粒细胞黏附活化[5]. 动物实验研究发现, P选择素L-EGF单克隆抗体通过抑制内皮细胞与中性粒细胞、树突状细胞等的黏附活化, 对肝、肾缺血再灌注损伤具有治疗作用[12].
我们建立了人胃癌组织原位移植SCID小鼠胃癌转移模型, 进行了P选择素L-EGF单克隆抗体抗转移的动物实验研究. 我们发现, 经注射P选择素L-EGF单抗后小鼠的肿瘤转移率显著低于生理盐水对照组, 分别为11.1%与81.8%, L-EGF单抗组未发现肝脏等脏器转移, 两组之间差别显著, P<0.05. 结果表明, P选择素L-EGF单抗抑制了肿瘤的转移. 表明P选择素L-EGF单抗抑制肿瘤转移作用较P选择素单抗进一步增强[4]. Dimitroff et al[13]的免疫组化研究发现, P选择素糖蛋白配体1(PSGL-1)主要表达于骨转移性前列腺肿瘤细胞表面, 表明PSGL-1与前列腺癌的肿瘤转移相关. Enns et al[14]研究结果表明, 选择素与配体sLe(a)相互作用在结肠癌肝转移中起重要作用. Murata et al[15]研究发现, 抑制选择素配体Lewis X表达可抑制结肠癌的转移. Ludwig et al[16]的研究表明, 内皮细胞P选择素表达在实验性黑色素瘤肺转移中起重要作用. 结果表明, 选择素通过介导内皮细胞、血小板与肿瘤细胞的黏附, 在肿瘤转移过程中起重要作用, 其单克隆抗体可抑制肿瘤的转移.
荧光定量PCR技术研究癌组织mRNA基因表达, 可实时定量分析, 因此可较好地研究P选择素mRNA基因表达与肿瘤转移中的关系. 结果发现, 正常对照鼠胃组织P选择素mRNA表达较低, SCID小鼠有癌转移者其胃癌组织中P选择素mRNA表达显著较不伴癌转移者强, 这可能由于在肿瘤转移过程中选择素基因受刺激和激活, 导致其转录水平上调, 后者通过促进癌组织中P选择素黏附分子的合成从而加强肿瘤的转移. 有关研究表明, TNFα、脂多糖、凝血酶等可刺激诱导活化血小板和血管内皮细胞从细胞水平或基因转录水平表达P选择素. 肿瘤细胞可分泌血管渗透因子、IL-1等细胞因子, 后者可刺激内皮细胞棒状小体的释放和细胞膜选择素表达, 而促进肿瘤的转移[4]. 表明, 在肿瘤转移过程中, P选择素合成与释放增强, 从而P选择素表达增强. Borsig et al[17]研究发现, P选择素通过介导肿瘤细胞与血小板和白细胞的黏附作用, 在肿瘤转移中起重要作用. Ferroni et al[11]研究表明, 血浆P选择素水平与结肠癌肿瘤转移相关, 是一项独立的预后指标. 我们发现, P选择素L-EGF单抗组胃癌组织中P选择素mRNA表达显著减低. Sumariwalla et al[18]研究表明, P选择素糖蛋白配体1可抑制炎症细胞TNFα的产生, 已知TNFα可刺激血小板和血管内皮细胞P选择素的表达, 因此, P选择素糖蛋白配体1可能通过抑制炎症细胞TNFα的产生, 从而抑制P选择素的表达. 表明, P选择素L-EGF单克隆抗体可能通过抑制选择素mRNA基因表达而进一步发挥抗转移作用.
总之, P选择素L-EGF单克隆抗体作用于P选择素分子的关键表位, 因此其抗黏附作用更强, 体内应用的副作用可能更少. 进一步研究P选择素L-EGF单克隆抗体的抗肿瘤转移作用及其机制, 将对胃癌和其他肿瘤的抗转移治疗具有重要意义.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Kawamura YI, Kawashima R, Fukunaga R, Hirai K, Toyama-Sorimachi N, Tokuhara M, Shimizu T, Dohi T. Introduction of Sd(a) carbohydrate antigen in gastrointestinal cancer cells eliminates selectin ligands and inhibits metastasis. Cancer Res. 2005;65:6220-6227. [PubMed] [DOI] |
| 2. | Songun I, Litvinov SV, van de Velde CJ, Pals ST, Hermans J, van Krieken JH. Loss of Ep-CAM (CO17-1A) expression predicts survival in patients with gastric cancer. Br J Cancer. 2005;92:1767-1772. [PubMed] [DOI] |
| 4. | Chen J, Zhang Y, Chu Y. Inhibition of human stomach cancer metastasis in vivo by anti-P-selectin monoclonal antibody. Zhonghua Yixue Zazhi. 1998;78:437-439. [PubMed] |
| 5. | Zhou T, Song W, Wang F, Ni PH, Chen N, Zhang DQ, Yu QW. Cloning, expression of the lectin-EGF domain of P-selectin, and preparation of its monoclonal antibody. Shengwu Huaxue Yu Shengwu Wulixue Bao. 2003;35:172-176. [PubMed] |
| 6. | Borsig L. Selectins facilitate carcinoma metastasis and heparin can prevent them. News Physiol Sci. 2004;19:16-21. [PubMed] [DOI] |
| 7. | Zipin A, Israeli-Amit M, Meshel T, Sagi-Assif O, Yron I, Lifshitz V, Bacharach E, Smorodinsky NI, Many A, Czernilofsky PA. Tumor-microenvironment interactions: the fucose-generating FX enzyme controls adhesive properties of colorectal cancer cells. Cancer Res. 2004;64:6571-6578. [PubMed] [DOI] |
| 8. | Magnani JL. The discovery, biology, and drug development of sialyl Lea and sialyl Lex. Arch Biochem Biophys. 2004;426:122-131. [PubMed] [DOI] |
| 9. | Fuster MM, Brown JR, Wang L, Esko JD. A disaccharide pre-cursor of sialyl Lewis X inhibits metastatic potential of tumor cells. Cancer Res. 2003;63:2775-2781. [PubMed] |
| 10. | Tozawa K, Okamoto T, Kawai N, Hashimoto Y, Hayashi Y, Kohri K. Positive correlation between sialyl Lewis X expression and pathologic findings in renal cell carcinoma. Kidney Int. 2005;67:1391-1396. [PubMed] [DOI] |
| 11. | Ferroni P, Roselli M, Martini F, D'Alessandro R, Mariotti S, Basili S, Spila A, Aloe S, Palmirotta R, Maggini A. Prognostic value of soluble P-selectin levels in colorectal cancer. Int J Cancer. 2004;111:404-408. [PubMed] [DOI] |
| 12. | Zhou T, Sun GZ, Zhang MJ, Chen JL, Zhang DQ, Hu QS, Chen YY, Chen N. Role of adhesion molecules and dendritic cells in rat hepatic/renal ischemia-reperfusion injury and anti-adhesive intervention with anti-P-selectin lectin-EGF domain monoclonal antibody. World J Gastroenterol. 2005;11:1005-1010. [PubMed] [DOI] |
| 13. | Dimitroff CJ, Descheny L, Trujillo N, Kim R, Nguyen V, Huang W, Pienta KJ, Kutok JL, Rubin MA. Identification of leukocyte Eselectin ligands, P-selectin glycoprotein ligand-1 and E-selectin ligand-1, on human metastatic prostate tumor cells. Cancer Res. 2005;65:5750-5760. [PubMed] [DOI] |
| 14. | Enns A, Gassmann P, Schluter K, Korb T, Spiegel HU, Sennin-ger N, Haier J. Integrins can directly mediate metastatic tumor cell adhesion within the liver sinusoids. J Gastrointest Surg. 2004;8:1049-1059. [PubMed] [DOI] |
| 15. | Murata K, Miyoshi E, Ihara S, Noura S, Kameyama M, Ishik-awa O, Doki Y, Yamada T, Ohigashi H, Sasaki Y. Atta-chment of human colon cancer cells to vascular endothelium is enhanced by N-acetylglucosaminyltransferase V. Oncology. 2004;66:492-501. [PubMed] [DOI] |
| 16. | Ludwig RJ, Boehme B, Podda M, Henschler R, Jager E, Tandi C, Boehncke WH, Zollner TM, Kaufmann R, Gille J. Endothelial P-selectin as a target of heparin action in experimental melano-ma lung metastasis. Cancer Res. 2004;64:2743-2750. [PubMed] [DOI] |
| 17. | Borsig L, Wong R, Hynes RO, Varki NM, Varki A. Synergistic effects of L- and P-selectin in facilitating tumor metastasis can involve non-mucin ligands and implicate leukocytes as enhan-cers of metastasis. Proc Natl Acad Sci USA. 2002;99:2193-2198. [PubMed] [DOI] |
| 18. | Sumariwalla PF, Malfait AM, Feldmann M. P-selectin glyco-protein ligand 1 therapy ameliorates established collagen- induced arthritis in DBA/1 mice partly through the suppression of tumour necrosis factor. Clin Exp Immunol. 2004;136:67-75. [PubMed] [DOI] |