修回日期: 2005-10-27
接受日期: 2005-10-31
在线出版日期: 2005-12-15
目的: 观察在实验性结肠炎过程中, 小鼠体内促炎细胞因子和抗炎细胞因子活性的变化.
方法: BALB/c小鼠33只随机分为对照组(n = 15)和实验组(n = 18), 小鼠先以DNCB涂腹液涂腹致敏, 然后实验组以DNCB灌肠液灌肠, 对照组以相应体积的乙醇灌肠. 每日观察小鼠体质量和大便性状, 并采用疾病活动指数(DAI)对动物状态进行评分. 所有小鼠处死后观察大体形态改变, 并自病变严重部位取组织标本, HE染色, 镜下观察结肠的病理学改变. 各组小鼠断头取血, 分离出血清, 采用双抗体夹心ELISA法测定血清IL-1, TNF-a, IL-6, IL-4, IL-10的吸光度.
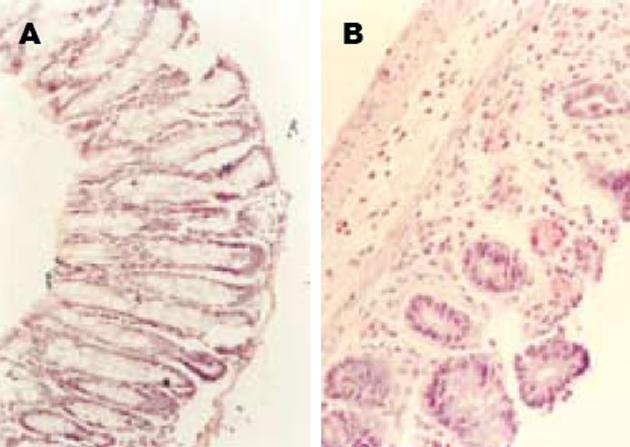
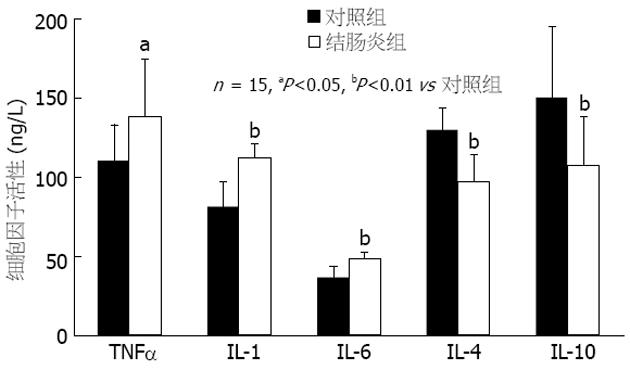
结果: 灌肠24 h后实验组小鼠腹泻百分率达59%, 体质量明显减轻, 死亡20%. 病理学检查对照组小鼠结肠无黏连, 黏膜轻度充血, 无溃疡形成, 镜下组织结构可见, 腺体排列基本整齐; 实验组小鼠腺体数目减少, 组织结构紊乱, 黏膜糜烂, 出血、坏死和大面积深层溃疡. 与对照组相比, 实验组小鼠疾病活动指数(3.82±2.77 vs 1.25±1.65, P<0.05), 组织病理学评分(2.47±1.33 vs 0.38±0.72, P<0.05)显著升高; 促炎细胞因子IL-1(112.9±8.3 ng/L vs 81.2±16.3 ng/L, P<0.01), TNF-a (137.9±36.7 vs 110.3±22.4 ng/L, P<0.05), IL-6(48.2±4.3 ng/L vs 36.1±7.2 ng/L, P<0.01)活性亦显著升高, 而抗炎细胞因子IL-4(96.7±16.5 ng/L vs 130.1±13.1 ng/L, P<0.01)和 IL-10(107.3±31.2 ng/L vs 149.8±45.1 ng/L, P<0.01)活性显著降低.
结论: DNCB诱导的结肠炎与促炎细胞因子水平升高, 抗炎细胞因子水平降低有关.
引文著录: 余万桂, 张恒文, 胡承明, 张道明, 梅林. DNCB 所致结肠炎小鼠血清中细胞因子的活性. 世界华人消化杂志 2005; 13(23): 2762-2765
Revised: October 27, 2005
Accepted: October 31, 2005
Published online: December 15, 2005
AIM: To observe the changes of serum pro-inflammatory and anti-inflammatory cytokine activities in mice with experimental colitis.
METHODS: A total of 33 BALB/c mice were randomly divided into control (n = 15) and experiment group(n = 18). After sensitized by 2, 4-dinitrochlorobenzene (DNCB) smeared on the abdominal skin, the mice in the experiment group were challenged with DNCB enema, while those in the control group were treated with ethanol. The body weight, stool viscosity and hematochezia were observed and accumulated as disease active index (DAI) score; the colon pathological score was achieved by macropathology and HE staining of section prepared for microscopy. The activity of serum IL-1, TNFa, IL-6, IL-4 and IL-10 was determined.
RESULTS: The percentage of diarrhea was 59% in the experiment mice 24 h after DNCB treatment, and serious weight loss was found, 20% mice died. Pathologically, the mice in the control group had normal histological structures and glands, and no ulcer was found except for occasional light mucosal congestion. However, the decrease in the number of glands and disturbance of tissue structure were observed in the mice of experiment group. Moreover, erosion, hemorrhage, necrosis as well as deeper ulcers were easily seen. As compared with those in the control mice, the DAI (3.82 ± 2.77 vs 1.25 ± 1.65, P <0.05), pathologic score (2.47 ± 1.33 vs 0.38 ± 0.72, P <0.05) were significantly increased in the experiment mice. The activities of pro-inflammatory cytokines such as IL-1(112.9 ± 8.3 ng/L vs 81.2 ± 16.3 ng/L, P <0.01), TNF-a(137.9 ±36.7 ng/L vs 110.3 ± 22.4 ng/L, P <0.05), and IL-6(48.2 ± 4.3 ng/L vs 36.1 ± 7.2 ng/L, P <0.01) were significantly increased, while the activities of anti-inflammatory cytokines such as IL-4 (96.7 ± 16.5 ng/L vs 130.1 ± 13.1 ng/L, P <0.01) and IL-10(107.3 ± 31.2 ng/L vs 149.8 ± 45.1 ng/L, P <0.01) were markedly lowered.
CONCLUSION: The pathological progress of colitis induced by DNCB is possiblely related with the increased activities of pro-inflammatory cytokines and decreased activities of anti-inflammatory cytokines.
- Citation: Yu WG, Zhang HW, Hu CM, Zhang DM, Mei L. Activity of cytokines in dinitrochlorobenzene-induced colitis in mice. Shijie Huaren Xiaohua Zazhi 2005; 13(23): 2762-2765
- URL: https://www.wjgnet.com/1009-3079/full/v13/i23/2762.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i23.2762
溃疡性结肠炎(ulcerative colitis, UC)是一种原因不明的慢性非特异性胃肠道疾病. 其发病率无论是在西方国家还是在我国均有逐年升高的趋势[1,2]. 在对其病因和发病机制的研究中, 认为免疫因素与UC关系密切, 特别是促炎细胞因子和抗炎细胞因子的动态平衡对UC的发生发展可能具有决定性作用[3]. 二硝基氯苯(DNCB)是一种小分子化合物, 它可以做为半抗原与组织蛋白结合成完全抗原激发T细胞介导的免疫反应[4]. 我们已经在国内首先建立了DNCB诱发的小鼠肠迟发过敏反应及结肠溃疡模型, 并发现T细胞释放的移动抑制因子在此肠炎中活性明显升高[5-7]. 现检测此结肠炎过程中其他的促炎因子IL-1, TNFa和IL-6, 以及某些抗炎因子IL-4和IL-10活性的改变, 以进一步探讨促炎因子和抗炎因子在溃疡性结肠炎发病中的作用.
健康♂BALB/c小鼠(广州军区武汉陆军总医院动物中心提供), 7-9周龄, 体质量18-21 g. DNCB涂腹液制备: 称取DNCB(北京化学试剂公司)330 mg, 溶于丙酮: 橄榄油(1: 1)混合液10 mL中, 成为终浓度33 g/L, 封好瓶口, 低温保存备用. DNCB灌肠液: 称取DNCB 40 mg溶于600 mL/L乙醇中, 配成浓度为4 g/L DNCB溶液, 瓶好封口, 低温保存备用. IL-1, TNFa, IL-6, IL-4, IL-10的ELISA试剂盒购自北京邦定泰克生物有限公司. 酶标仪(MK 3型, Labsystem Dragon公司); SHZ-82 型水浴箱(江苏省太仓医疗器械厂).
BALB/c小鼠33只随机分为对照组(15只)和实验组(18只); 小鼠腹部剪毛约2.0×1.5 cm, 以33 g/L DNCB涂腹液50 μL涂腹, 1次/d, 连续4 d; d5开始灌肠, 将直径1 mm的硅胶管插入小鼠结肠, 插管尖端距肛门约3-3.5 cm[5], 以 4 g/L DNCB 2 μL/g灌肠1次/d, 连续4 d, 对照组灌以相应体积的600 mL/L乙醇. 每日观察小鼠体质量和大便性状. 并采用疾病活动指数(DAI)[8]对动物状态进行评分: 体质量: 体质量不变为0分, 体质量比正常下降1-5%为1分, 6-10%为2分, 11-15%为3分, 大于15%为4分; 大便黏稠度: 正常为0分, 松散的大便为2分, 腹泻为4分; 大便出血: 正常为0分, 显性出血为2分. 所有小鼠均于d9用颈椎脱臼法处死, 打开腹腔, 分离大肠, 沿肠系膜附着部纵行剪开肠壁, 观察大体形态改变. 并自病变严重部位取组织标本, 置100 g/L甲醛液中固定, 常规石蜡切片(5 μm), HE染色, 镜下观察结肠的病理学改变. 大体形态评分的方法基本参考文献[8]并稍微改进: 结肠无黏连(结肠与其他组织剥离较易)、无溃疡无炎症为0分; 结肠轻度黏连、局部充血为1分; 结肠重度黏连并发现1处溃疡(<1 cm)为2分; 1处以上溃疡(<1 cm)伴炎症为3分; 多处溃疡(>1cm)伴炎症为4分. 镜下病理学评分的方法: 在高倍视野(200倍)下分组对每只小鼠的切片进行观察. 正常结肠黏膜为0级, 隐窝缺损1/3为1级, 隐窝缺损2/3为2级, 固有层覆盖单层上皮伴轻度炎性细胞浸润为3级, 黏膜糜烂、溃疡伴显著的炎性细胞浸润为4级. 各组小鼠断头取血分离血清, 采用双抗体夹心ELISA法测定血清IL-1, TNFa, IL-6, IL-4, IL-10的吸光度A, 波长450 nm. 具体操作均按试剂盒说明进行.
统计学处理 数据用 mean±SD表示, 各组间进行t检验, P<0.05为有统计学意义.
灌肠24 h后实验组小鼠腹泻百分率达59%, 体质量明显减轻, 死亡20%. 与对照组相比, 实验组小鼠疾病活动指数(3.82±2.77 vs 1.25±1.65, P<0.05), 组织病理学评分(2.47±1.33 vs 0.38±0.72, P<0.05)显著升高, 与我们以前的报道相同[5,6]. 灌肠d5处死小鼠, 打开腹腔, 对照组小鼠结肠无黏连, 黏膜轻度充血, 无溃疡形成, 镜下组织结构可见, 腺体排列基本整齐; 实验组小鼠可见较广泛的结肠黏连、近端肠腔扩张及少量白色渗出物, 结肠粘膜充血、坏死、多处溃疡形成, 镜下隐窝缺损明显, 组织结构紊乱, 黏膜糜烂, 出血、坏死和大面积深层溃疡. HE染色镜下可见实验组小鼠肠组织损伤的程度明显加重(图1).
致敏原2, 4-二硝基氯苯(DNCB)能够诱发小鼠出现结肠溃疡. 由于DNCB是通过激活T细胞而诱导结肠炎, 所以在发病机制上与人类的UC有一定的相似性[5]. 在以T细胞激活为特征的肠炎中, IL-5[9], TNF-a[10-12], IL-1, IL-6[12]和IL-16[13]等参与, 但这些都是从UC患者测得[9,11,13], 而与DNCB肠炎有关的细胞因子仅见报道TNF-a[10], 并且不是小鼠. 我们观察到促炎细胞因子IL-1, IL-6和TNFa活性升高, 而抗炎细胞因子IL-4和IL-10活性降低, 提示结肠炎的发病可能与促炎细胞因子活性升高而抗炎细胞因子活性降低有关. 在UC发生过程中, 免疫系统是引起肠道炎症与损伤的重要因素[14], 细胞因子在调节肠道免疫中既有促进炎症发展又有抗炎作用, 促炎细胞因子IL-1, IL-6, TNFa和抗炎细胞因子IL-4, IL-10常处于动态平衡,如果失去平衡, 则会导致肠炎发生[15]. IL-1是一种具有多种生物活性并能作用于体内多种组织和器官的细胞因子, 根据等电点不同, IL-1可分为IL-1a和IL-1β, 人体内IL-1活性主要由后者介导. IL-1的作用由IL-1受体拮抗剂(IL-1ra)控制, 体内外实验均证实IL-1r a能抑制IL-1不同的生物学活性, 有研究发现IL-1和IL-1r a之间的平衡决定IL-1对炎症过程的促进作用[16], 在UC中IL-1可以产生对中性粒细胞等炎症细胞的趋化作用, 吸引其进入肠道病变部位, 从而引起一系列病理改变, 如结肠上皮损伤、小血管炎、隐窝脓肿等, 最终造成UC的发病[17]. TNF-a引起肠道黏膜损伤的可能机制包括释放血小板活化因子、生成白三烯和氧自由基、诱导一氧化氮合酶, 从而产生大量一氧化氮引起细胞损伤; 同时TNF-a启动T、B淋巴细胞活化[18]. IL-1, TNFa及IL-6均可在UC黏膜病变中存在, 特别是活化的IL-6与UC的免疫和临床表现有非常密切的关系.
抗炎细胞因子中最重要的是IL-4和IL-10, DNCB诱导的UC的小鼠血清中抗炎细胞因子IL-4, IL-10活性显著性降低. 大量研究资料证实IL-4能抑制单核巨噬细胞产生IL-1β和TNFa, 下调活化的单核巨噬细胞分泌氧自由基的能力, 而且存在剂量-效应关系[19]. IL-4和IL-10抑制诱生型一氧化氮合酶(iNOS)的表达, iNOS是一个静止的基因, 仅在免疫反应或炎症才被激活, iNOS活性增强, 产生过量的NO, 对肠黏膜有杀伤毒性及促进炎症的作用[20]. IL-4还能抑制前列腺素E2和IL-8的产生. 人IL-10能下调活化的单核细胞和巨噬细胞转录分泌IL-1β, IL-6, IL-8, TNFa和G-CSF. IL-10基因敲除小鼠可自发形成结肠炎. 本实验表明, DNCB诱导的结肠炎小鼠血清中促炎细胞因子IL-1, TNFa和IL-6活性显著地高于对照组, 而抗炎细胞因子IL-4, IL-10活性与对照组组比较有显著性降低, 提示DNCB诱导的结肠炎发病过程可能与促炎细胞因子的水平升高、抗炎细胞因子水平降低有关, 即细胞因子网络平衡被破坏, 故综合运用细胞因子, 重新建立细胞因子网络平衡, 可能是治疗UC的一种有效途径[21-23].
电编: 李琪 编辑: 潘伯荣 审读: 张海宁
| 1. | Russel MG. Changes in the incidence of inflammatory bowel disease: what does it mean? Eur J Intern Med. 2000;11:191-196. [PubMed] [DOI] |
| 2. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] [DOI] |
| 3. | 林 平, 伍 杨, 黄 华, 梅 林. 细胞因子与溃疡性结肠炎. 湖北民族学院学报(医学版). 2003;20:28-30. |
| 4. | Sartor RB. Pathogenesis and immune mechanisms of chronic inflammatory bowel diseases. Am J Gastroenterol. 1997;92:5-11. [PubMed] |
| 5. | Yu WG, Lin P, Pan H, Xiao L, Gong EC, Mei L. Pathophysiological significance of a reaction in mouse gastrointestinal tract associated with delayed-type hypersensitivity. World J Gastroenterol. 2004;10:2254-2258. [PubMed] |
| 9. | Fuss IJ, Neurath M, Boirivant M, Klein JS, de la Motte C, Strong SA, Fiocchi C, Strober W. Disparate CD4+ lamina propria(LP) lymphokine secretion profiles in inflammatory bowel disease. Crohn's disease LP cells manifest increased secretion of IFN-gamma, whereas ulcerative colitis LP cells manifest increased secretion of IL-5. J Immunol. 1996;157:1261-1270. [PubMed] |
| 10. | Mack DR, Lau AS, Sherman PM. Systemic tumor necrosis factor-alpha production in experimental colitis. Dig Dis Sci. 1992;37:1738-1745. [PubMed] [DOI] |
| 13. | Seegert D, Rosenstiel P, Pfahler H, Pfefferkorn P, Nikolaus S, Schreiber S. Increased expression of IL-16 in inflammatory bowel disease. Gut. 2001;48:326-332. [PubMed] [DOI] |
| 14. | Targan SR, Karp LC. Defects in mucosal immunity leading to ulcerative colitis. Immunol Rev. 2005;206:296-305. [PubMed] [DOI] |
| 15. | Ardizzone S, Bianchi Porro G. Biologic therapy for inflammatory bowel disease. Drugs. 2005;65:2253-2286. [PubMed] [DOI] |
| 16. | Mittal RD, Bid HK, Ghoshal UC. IL-1 receptor antagonist(IL-1Ra) gene polymorphism in patients with inflammatory bowel disease in India. Scand J Gastroenterol. 2005;40:827-831. [PubMed] [DOI] |
| 19. | Schreiber S, Heinig T, Panzer U, Reinking R, Bouchard A, Stahl PD, Raedler A. Impaired response of activated mononuclear phagocytes to interleukin 4 in inflammatory bowel disease. Gastroenterology. 1995;108:284-286. [PubMed] [DOI] |
| 20. | Linehan JD, Kolios G, Valatas V, Robertson DA, Westwick J. Immunomodulatory cytokines suppress epithelial nitric oxide production in inflammatory bowel disease by acting on mononuclear cells. Free Radic Biol Med. 2005;39:1560-1569. [PubMed] [DOI] |
| 21. | Barish CF. Alicaforsen therapy in inflammatory bowel disease. Expert Opin Biol Ther. 2005;5:1387-1391. [PubMed] [DOI] |
| 22. | Uhlig HH, Powrie F. The role of mucosal T lymphocytes in regulating intestinal inflammation. Springer Semin Immunopathol. 2005;27:167-180. [PubMed] [DOI] |