修回日期: 2005-06-10
接受日期: 2005-06-16
在线出版日期: 2005-12-15
目的: 观察胃癌组织中KAI 1和nm23-H1蛋白的表达与临床病理生物学的关系, 探讨KAI 1蛋白在胃癌发生发展中的作用.
方法: 应用兔抗人KAI 1多克隆抗体和鼠抗人nm23-H1单克隆抗体对87例手术切除胃癌标本以PV-9000免疫组化二步法进行染色, 用χ2检验进行统计学分析.
结果: 伴有淋巴结转移的胃癌组织中KAI 1蛋白表达阳性率(60%, 39/65)明显低于无淋巴结转移的胃癌组织(95%, 21/22, P<0.05), 早中期胃癌组织中KAI 1蛋白表达阳性率(94%, 16/17)显著高于晚期胃癌组织(63%, 44/70, P<0.05), KAI 1蛋白高表达者其生存期亦较长(P<0.05); 伴有淋巴结转移的胃癌组织中nm23-H1蛋白表达阳性率明显低于无淋巴结转移的胃癌组织(18% vs 77%, P<0.05), 早中期胃癌组织中nm23-H1蛋白表达阳性率明显高于晚期胃癌组织(65% vs 26%, P<0.05).
结论: KAI 1和nm23-H1蛋白均与胃癌侵袭转移有关, 且KAI 1表达与胃癌患者预后密切相关, 将两种指标联合检测, 可作为正确判断胃癌患者预后, 指导临床治疗的分子生物学指标.
引文著录: 孟丽辉, 辛彦, 吴东瑛, 张淑敏. 胃癌组织KAI 1和nm23-H1蛋白的表达意义. 世界华人消化杂志 2005; 13(23): 2726-2730
Revised: June 10, 2005
Accepted: June 16, 2005
Published online: December 15, 2005
AIM: To investigate the expression of KAI 1 and nm23-H1 protein in gastric cancer, and to explore the clinicopath-ological significance of KAI 1 protein in the progression of gastric cancer.
METHODS: Eighty-seven paraffin-embedded specime-ns of gastric cancer were investigated immunohistoche-mically by Envision method with rabbit anti-human KAI 1 polyclonal antibody and mouse anti-human nm23-H1 monoclonal antibody. Statistical analysis was perform-ed using chi-square test.
RESULTS: The positive rate of KAI 1 expression in gastric cancer with lymph node metastasis (60%, 39/65) was significantly lower than that without lymph node metastasis (95%, 21/22, P < 0.05), but the rate was markedly higher in early-stage tissues of gastric cancer than that in late-stage ones (94%, 16/17 vs 63%, 44/70, P < 0.05). The patients with KAI 1 positive tumor tended to have a longer survival time (P < 0.05). The expression of nm23-H1 was notably decreased in gastric cancer with lymph node metastasis in compari-son with that without lymph node metastasis (18% vs 77%, P < 0.05), but nm23-H1 expression rate in early- and meta-phase gastric cancers was higher than that in late-phase gastric cancers (65% vs 26%, P < 0.05).
CONCLUSION: KAI 1 and nm23-H1 are both associat-ed with invasive ability of gastric cancer. Furthermore, KAI 1 is correlated with prognosis of patients with gast-ric cancers. Combined detection of KAI 1 and nm23-H1 may be helpful in predicting the prognosis and further directing the clinical therapy of gastric cancer.
- Citation: Meng LH, Xin Y, Wu DY, Zhang SM. Clinicopathological significance of KAI 1 and nm23-H1 expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2005; 13(23): 2726-2730
- URL: https://www.wjgnet.com/1009-3079/full/v13/i23/2726.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i23.2726
胃癌是我国死亡率最高的恶性肿瘤之一[1-7], 侵袭转移是肿瘤的最重要恶性特征, 也是胃癌治疗失败导致死亡的主要原因. 肿瘤转移是一个多步骤、连续的过程, 受多种癌基因和抑癌基因的调控[8-12]. KAI 1是肿瘤转移抑制基因, 属四跨膜超家族(transmembrance 4 superfamily, TM4SF)的成员, KAI 1/CD82对多种肿瘤的转移具有抑制作用, KAI 1对肿瘤转移的抑制作用可能源于其对细胞运动、转移和增生的影响[13-15]. nm23-H1的mRNA水平与癌细胞转移的关系更为密切, 该基因编码一种具有二磷酸核苷激酶(NDPK)活性的蛋白质, 通过影响微管聚合状态及G蛋白介导的信号传导通路而调节细胞代谢, 从而对肿瘤细胞的增殖、分化、侵袭及转移起重要作用[16-19]. 我们对二种肿瘤转移抑制基因KAI 1/CD82和nm23-H1在胃癌组织中的表达进行比较研究, 探讨其在胃癌侵袭转移中的作用及与胃癌生物学行为和预后的关系, 为临床胃癌转移的有效防治提供科学的依据.
2002-07/2003-06辽宁省肿瘤医院、中国医科大学附属第一医院肿瘤科手术切除胃癌存档蜡块87例. 男60例, 女27例, 年龄26-74(平均56)岁. 早期5例, 中期12例, 晚期70例. 有淋巴结转移65例, 无淋巴结转移22例. 全部病例均无临床辅助检查可见的其他脏器转移癌, 均有5 a以上的跟踪随访. 每例均选择癌组织、癌与正常组织交界处和淋巴结转移癌组织的常规石蜡包埋蜡块各一枚, 制做成4 µm厚的连续切片供检测用. 兔抗人KAI 1多克隆抗体(1∶50)、鼠抗人nm23-H1mAB(1∶100)分别购自Santa Cruz和北京中山生物技术有限公司, PV-9000免疫组化二步法检测试剂盒购自北京中山生物技术有限公司.
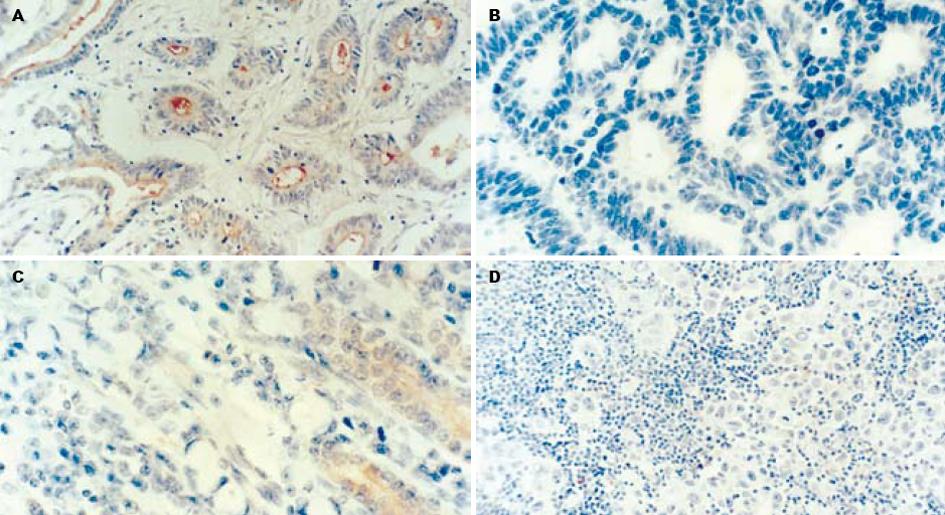
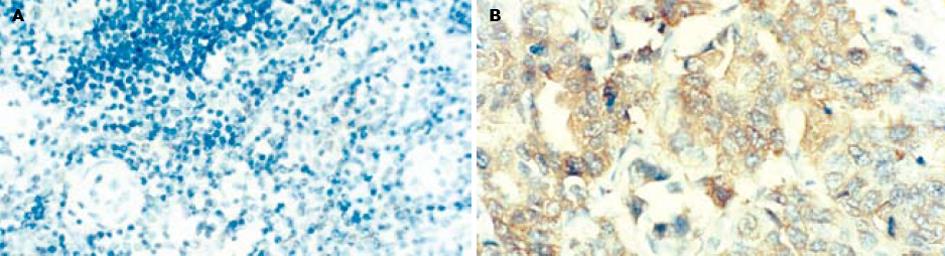
采用PV-9000免疫组化二步法检测KAI 1和nm23-H1蛋白表达. 以中山公司赠送阳性切片为阳性对照, 以PBS代替一抗作阴性对照. KAI 1和nm23-H1蛋白免疫染色阳性信号为定位于细胞质, 呈棕黄色颗粒. 每个标本随机观察5个高位视野, 每个视野计数200个肿瘤细胞, 取平均值. 阳性细胞数<5%为阴性(-), 5-25%为弱阳性(+), 25-50%为中度阳性(++), >50%为强阳性(+++). 为便于结果分析处理, 将(+)-(+++)列为阳性组.
统计学处理 利用χ2检验比较率的差异. P<0.05视为差异有统计学意义.
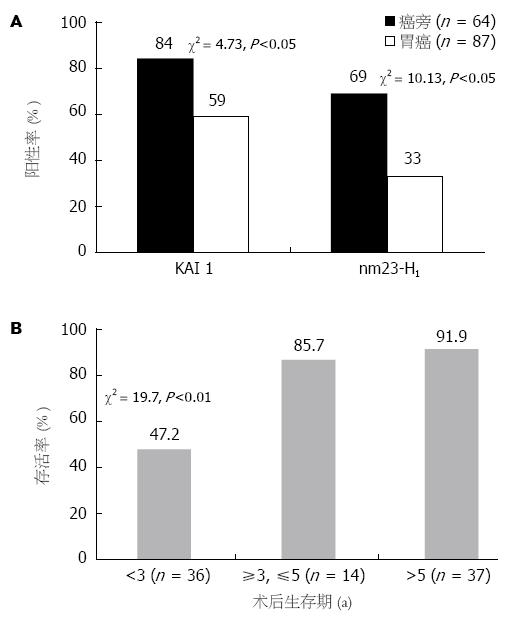
KAI 1蛋白在胃黏膜上皮细胞的胞质中呈阳性表达, 胃癌组织KAI 1蛋白表达阳性率为69%(60/87), 显著低于癌旁组织84%(54/64)(P<0.05); nm23-H1蛋白在胃癌组织中表达阳性率为33%(29/87), 显著低于癌旁组织59%(38/64)(P<0.05, 图1A).
肠型胃癌KAI 1蛋白表达阳性率85%高于弥漫型胃癌64%, 但无统计学意义(P>0.05). 伴有淋巴结转移的胃癌组织中KAI 1蛋白表达阳性率60%明显低于无淋巴结转移的胃癌组织95%(P<0.05), 呈负相关; 早中期胃癌组织中KAI 1蛋白表达阳性率94%明显高于晚期胃癌组织63%(P<0.05). 肠型胃癌nm23-H1蛋白表达阳性率(30%)低于弥漫型胃癌(34%), 但两者无统计学意义(P>0.05). 伴有淋巴结转移的胃癌组织中nm23-H1蛋白表达阳性率(18%)明显低于无淋巴结转移的胃癌组织(77%)(P<0.05), 呈负相关; 早中期胃癌组织中nm23-H1蛋白表达阳性率(65%)明显高于晚期胃癌组织(26%, P<0.05, 表1). KAI 1蛋白表达与胃癌患者生存期密切相关(P<0.01), KAI 1蛋白高表达者其生存期亦较长, (图1B, 图2, 图3).
肿瘤侵袭转移是一系列复杂、多步骤的连续过程, KAI 1基因有直接的抑制肿瘤作用, 在肿瘤的发生进展中的负调控作用已经在多个研究中报道[20-24]. 尽管KAI 1基因确切功能还不清楚, 但目前一致认为KAI 1/CD82对肿瘤转移的抑制作用可能源于其对细胞运动、转移和增生的影响, 这与其可调节细胞的黏附有关[25]. 我们发现, 有淋巴结转移的胃癌组织KAI 1表达阳性率60%明显低于无淋巴节转移者95%, 胃癌组织中KAI 1表达阳性率69%明显低于癌旁组织84%, 提示KAI 1与胃癌淋巴结转移的发生发展有关, KAI 1表达的下调可能促使胃癌细胞获得了恶性转化和侵袭转移的潜能, 这个能力可促使癌细胞扩散以及扩散中的癌细胞在淋巴结内定居, 并有效地形成淋巴结转移. 此外, 也可能KAI 1表达的下调削弱了癌细胞间的黏附能力, 从而促进了癌细胞的扩散. 本研究还发现KAI 1表达与Lauren分型无明显相关(P>0.05), 而与临床病理分期呈正相关, 早中期胃癌患者的癌细胞中KAI 1表达的阳性率明显高于晚期患者(P<0.05). 并且, 胃癌患者的生存期与KAI 1表达的阳性率也呈正相关(P<0.01), 这些结果表明KAI 1蛋白可作为一个客观判断胃癌患者预后的新的分子生物学指标.
人类的nm23基因定位于17号染色体长臂的着丝点附近, 有三种亚型即nm23-H1, nm23-H2, nm23-H3, 其中nm23-H1的mRNA水平与癌细胞转移的关系更为密切, Nakayama et al研究认为在进展期胃癌组织中nm23基因表达无一定规律, 且nm23低表达者预后差, 而Muller et al的研究结果显示nm23阳性表达与胃癌组织学类型分化程度、临床分期有关, 与淋巴结转移无关, 淋巴管血管受侵犯组nm23表达阳性率高于无侵犯组. 并发现nm23表达阳性者预后较阴性表达者差. 本结果显示nm23-H1的阳性表达与Lauren分型无明显相关(P>0.05), 而与有无淋巴结转移以及临床病理分期密切相关(P<0.05), 提示nm23基因表达缺失的胃癌具有更强的侵袭能力, 更容易发生淋巴结转移.
在研究KAI 1蛋白与nm23-H1表达的关系中发现, 经统计学处理二者有密切相关关系, KAI 1阳性表达病例nm23-H1蛋白上调. 本结果显示KAI 1在胃癌的临床分期、病期进展中具有重要作用. nm23-H1表达同样与胃癌组织类型密切相关, 提示KAI 1与nm23-H1可能通过不同作用机制影响胃癌的生长方式, 而KAI 1异常表达可进一步促进病期进展. 由于例数少, 他们在胃癌进展中的作用尚需扩大样本量进行深入的研究. KAI 1和nm23-H1蛋白均与胃癌侵袭转移有关, 且KAI 1表达与胃癌患者预后密切相关, 将两种指标联合检测, 可作为正确判断胃癌患者预后, 指导临床治疗的分子生物学指标. 我们对KAI 1蛋白在胃癌组织中表达的研究, 加深对胃癌转移机制的理解, 结果为深入理解细胞黏附异常及其调控因素在胃癌发生发展中的作用提供了新的研究资料. 通过对胃癌组织中KAI 1、nm23-H1蛋白表达的比较研究, 解释了KAI 1和nm23-H1在胃癌组织中的表达与肿瘤进展的关系, 发现联合应用KAI 1和nm23-H1蛋白检测可用于预测胃癌患者预后, 指导临床治疗.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 1. | Zhang CW, Zou SC, Shi D, Zhao DJ. Clinical significance of preoperative regional intra-arterial infusion chemotherapy for advanced gastric cancer. World J Gastroenterol. 2004;10:3070-3072. [PubMed] [DOI] |
| 2. | Cheng LY, Zhong SZ, Huang ZH. Sentinel lymph node concept in gastric cancer with solitary lymph node metastasis. World J Gastroenterol. 2004;10:3053-3055. [PubMed] [DOI] |
| 3. | Zhang HK, Zhang QM, Zhao TH, Li YY, Yi YF. Expression of mucins and E-cadherin in gastric carcinoma and their clinical significance. World J Gastroenterol. 2004;10:3044-3047. [PubMed] [DOI] |
| 4. | Wang KJ, Wang RT, Zhang JZ. Identification of tumor markers using two-dimensional electrophoresis in gastric carcinoma. World J Gastroenterol. 2004;10:2179-2183. [PubMed] |
| 5. | Lu XG, Zhan LB, Feng BA, Qu MY, Yu LH, Xie JH. Inhibition of growth and metastasis of human gastric cancer implanted in nude mice by d-limonene. World J Gastroenterol. 2004;10:2140-2144. [PubMed] [DOI] |
| 6. | Li YH, Wang C, Meng K, Chen LB, Zhou XJ. Influence of survi-vin and caspase-3 on cell apoptosis and prognosis in gastric carcinoma. World J Gastroenterol. 2004;10:1984-1988. [PubMed] [DOI] |
| 7. | Zhang QX, Ding Y, Li Z, Le XP, Zhang W, Sun L, Shi HR. Com-parison of nuclear matrix proteins between gastric cancer and normal gastric tissue. World J Gastroenterol. 2004;10:1819-1821. [PubMed] [DOI] |
| 8. | Sun XD, Liu XE, Wu JM, Cai XJ, Mou YP, Li JD. Expression and sig-nificance of angiopoietin-2 in gastric cancer. World J Gastroenterol. 2004;10:1382-1385. [PubMed] |
| 9. | Yang XF, Yang L, Mao XY, Wu DY, Zhang SM, Xin Y. Patho-biological behavior and molecular mechanism of signet ring cell carcinoma and mucinous adenocarcinoma of the stomach: a com-parative study. World J Gastroenterol. 2004;10:750-754. [PubMed] [DOI] |
| 10. | Zhang C, Liu ZK. Gene therapy for gastric cancer: a review. World J Gastroenterol. 2003;9:2390-2394. [PubMed] |
| 11. | Xin Y, Li XL, Wang YP, Zhang SM, Zheng HC, Wu DY, Zhang YC. Relationship between phenotypes of cell-function differentiation and pathobiological behavior of gastric carcinomas. World J Gastroenterol. 2001;7:53-59. [PubMed] [DOI] |
| 12. | Han CB, Li F, Zhao YJ, Ma JM, Wu DY, Zhang YK, Xin Y. Va-riations of mitochondrial D-loop region plus downstream gene 1 2S rRNA-tRNA(phe) and gastric carcinomas. World J Gastroenterol. 2003;9:1925-1929. [PubMed] [DOI] |
| 13. | Gao AC, Lou W, Dong JT, Barrett JC, Danielpour D, Isaacs JT. Defining regulatory elements in the human KAI1 (CD 82) metastasis suppressor gene. Prostate. 2003;57:256-260. [PubMed] [DOI] |
| 14. | Liu FS, Dong JT, Chen JT, Hsieh YT, Ho ES, Hung MJ, Lu CH, Chiou LC. KAI1 metastasis suppressor protein is down- regulated during the progression of human endometrial cancer. Clin Cancer Res. 2003;9:1393-1398. [PubMed] |
| 15. | Liu FS, Chen JT, Dong JT, Hsieh YT, Lin AJ, Ho ES, Hung MJ, Lu CH. KAI1 metastasis suppressor gene is frequently down-regulated in cervical carcinoma. Am J Pathol. 2001;159:1629-1634. [PubMed] [DOI] |
| 16. | Almgren MA, Henriksson KC, Fujimoto J, Chang CL. Nucleo-side diphosphate kinase A/nm23-H1 promotes metastasis of NB69-derived human neuroblastoma. Mol Cancer Res. 2004;2:387-394. [PubMed] |
| 17. | Postel EH. Multiple biochemical activities of NM23/NDP kinase in gene regulation. J Bioenerg Biomembr. 2003;35:31-40. [PubMed] [DOI] |
| 18. | Roymans D, Willems R, Van Blockstaele DR, Slegers H. Nucl-eoside diphosphate kinase (NDPK/NM23) and the waltz with multiple partners: possible consequences in tumor metastasis. Clin Exp Metastasis. 2002;19:465-476. [PubMed] [DOI] |
| 19. | Wu DH, Liu L, Chen LH, Ding YQ. KAI1 gene expression in colonic carcinoma and its clinical significances. World J Gastroenterol. 2004;10:2245-2249. [PubMed] |
| 20. | Liu FS, Chen JT, Dong JT, Hsieh YT, Lin AJ, Ho ES, Hung MJ, Lu CH. KAI1 metastasis suppressor gene is frequently down-regulated in cervical carcinoma. Am J Pathol. 2001;159:1629-1634. [PubMed] [DOI] |
| 21. | AmirthaLakshmi S, Pushparaj V, Krishnamurthy V, Biswas J, Krishnakumar S, Shanmugam MP. Tetraspanin protein KAI1 expression in retinoblastoma. Br J Ophthalmol. 2004;88:593-595. [PubMed] [DOI] |
| 22. | Su JS, Arima K, Hasegawa M, Franco OE, Umeda Y, Yanagawa M, Sugimura Y, Kawamura J. Decreased expression of KAI1 metastasis suppressor gene is a recurrence predictor in prim-ary pTa and pT1 urothelial bladder carcinoma. Int J Urol. 2004;11:74-82. [PubMed] [DOI] |
| 23. | Lee JH, Seo YW, Park SR, Kim YJ, Kim KK. Expression of a splice variant of KAI1, a tumor metastasis suppressor gene, influences tumor invasion and progression. Cancer Res. 2003;63:7247-7255. [PubMed] |
| 24. | Wu Q, Ji Y, Zhang MQ, Chen YQ, Chen F, Shi DL, Zheng ZH, Huang YJ, Su WJ. Role of tumor metastasis suppressor gene KAI1 in digestive tract carcinomas and cancer cells. Cell Tissue Res. 2003;314:237-249. [PubMed] [DOI] |
| 25. | Jee B, Jin K, Hahn JH, Song HG, Lee H. Metastasis-suppressor KAI1/CD82 induces homotypic aggregation of human pros- tate cancer cells through Src-dependent pathway. Exp Mol Med. 2003;35:30-37. [PubMed] [DOI] |