修回日期: 2005-10-01
接受日期: 2005-10-19
在线出版日期: 2005-11-28
目的: 研究N-去硫酸肝素对人胃癌重度联合免疫缺陷(SCID)小鼠转移模型肿瘤转移抑制、血管生成和血管内皮生长因子(VEGF)表达的影响 .
方法: 建立人胃癌组织原位移植SCID小鼠转移模型, 随机分成两组. 移植1 wk, 分别从静脉内注射生理盐水(生理盐水组)与N-去硫酸肝素[10 mg/(kg•d)](N-去硫酸肝素组), 2次/wk, 共3 wk. 第6 wk处死动物, 观察肿瘤转移情况, 免疫组化方法检测肿瘤组织微血管密度(MVD)、VEGF的表达 .
结果: 生理盐水组肿瘤转移率为80%, N-去硫酸肝素组转移率为20%, 两组之间差异有统计学意义(P<0.05). 未发现出血等副作用. 生理盐水组平均微血管密度为8.0±3.1, N-去硫酸肝素治疗组平均微血管密度为4.3±1.8. 经统计学处理, 两组之间差别有显著意义(P<0.05). 生理盐水组VEGF阳性表达率明显高于N-去硫酸肝素治疗组, 分别为90%与20%(P<0.05).
结论: N-去硫酸肝素通过抑制肿瘤组织VEGF表达和血管生成, 从而抑制肿瘤的转移, 并且无明显出血等不良反应..
引文著录: 陈金联, 陆金来, 陈明祥, 陈维雄, 朱金水, 陈尼维, 陈国强, 耿建国. N-去硫酸肝素对 SCID 小鼠胃癌血管生成和 VEGF 表达的影响. 世界华人消化杂志 2005; 13(22): 2685-2688
Revised: October 1, 2005
Accepted: October 19, 2005
Published online: November 28, 2005
AIM: To investigate the effect of N-desulfated heparin on tumor metastasis, angiogenesis, and expression of vascular endothelial growth factor (VEGF) after ortho-topic implantation of human gastric carcinoma in mice with severe combined immunodeficiency (SCID).
METHODS: The SCID mice metastasis model was established by in situ implantation of human gastric carcinoma tissue, then the mice were randomly divided into two groups: the normal saline group (treated with normal saline) and NNH group [treated with N-desulfat-ed heparin, 10 mg/(kg·d) iv, 2/wk, for 3 wk]. The mice were sacrificed 6 wk after the implantation. The tumor metastasis, intratumoral microvessel density (MVD), and VEGF expression were evaluated respectively..
RESULTS: The tumor metastasis rates were significan-tly different between normal saline and NNH group (80% vs 20%, P < 0.05). No side effect such as hemorrhage was observed in the mice. The MVD was 8.0 ± 3.1 in the normal saline group and 4.3 ± 1.8 in the NNH group, and there was significant difference between those 2 groups (P < 0.05). The positive rate of VEGF expressi-on was significantly higher in the normal saline group than that in the NNH group (90% vs 20%, P < 0.05).
CONCLUSION: N-desulfated heparin can inhibit the metastasis of gastric cancer through inhibiting the ex-pression of tumor VEGF and angiogenesis with no ob-vious side effect such as hemorrhage
- Citation: Chen JL, Lu JL, Chen MX, Chen WX, Zhu JS, Chen NW, Chen GQ, Geng JG. Effect of N-desulfated heparin on angiogenesis and vascular endothelial growth factor expression in mice with severe combined immunodeficiency. Shijie Huaren Xiaohua Zazhi 2005; 13(22): 2685-2688
- URL: https://www.wjgnet.com/1009-3079/full/v13/i22/2685.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i22.2685
胃癌是我国最常见的恶性肿瘤之一, 严重威胁人类的健康. 肿瘤转移是肿瘤致死的关键因素. 迄今为止, 肿瘤转移缺乏有效的防治方法. 近年研究表明, 肿瘤转移与肿瘤血管生成相关, 肿瘤血管生成是一系列血管生长因子和血管生长抑制因子共同调节的, 其影响患者的预后, 抑制血管的生成可抑制肿瘤转移, 从而改善肿瘤患者的生存期和预后[1-4]. 目前已发现血管内皮生长因子(VEGF)和成纤维生长因子等, 促进肿瘤血管生成. 抑制血管内皮生长因子等促血管生长因子, 可抑制肿瘤的血管生成和肿瘤转移[5-7].
肝素为高度硫酸化的蛋白多糖, 作为抗凝剂, 已被广泛应用于临床. 体外实验发现, 肝素可抑制血管内皮生长因子和成纤维生长因子刺激的血管内皮细胞的增殖和血管的形成. 动物实验发现肝素可抑制实验性肿瘤的转移. 因此, 肝素可能具有抗肿瘤转移作用[8,9]. 然而, 由于肝素强烈的抗凝活性, 限制了他的临床应用. 对肝素进行化学修饰, 可降低其抗凝活性, 但可增强其抗血管生成作用[10]. 我们用人胃癌组织原位移植SCID小鼠建立胃癌转移模型, 旨在探讨N-去硫酸肝素对肿瘤血管生成和转移的抑制作用, 为N-去硫酸肝素抗肿瘤转移的临床应用提供理论基础.
1.1.1 主要试剂: 羊抗人CD34抗体和羊抗人VEGF抗体系Santa Cruz生物技术公司产品.
1.1.2 动物模型: 健康♂重度联合免疫缺陷(SCID)小鼠由中国科学院上海实验动物中心提供, 鼠龄6-7 wk, 体质量20-25 g. 裸鼠皮下传代的人胃癌组织SGC-7901由上海市肿瘤研究所提供, 移植时处死荷瘤裸鼠, 皮肤消毒, 取下肿瘤, 浸入生理盐水中. 采用人胃癌组织原位移植SCID小鼠建立胃癌转移模型. 将动物麻醉后, 依次切开左上腹皮肤、腹壁和腹膜, 仔细暴露胃壁, 在胃大弯中部用剪刀损伤胃浆膜层, 将人胃癌组织块(约5 mm×7 mm)缝在损伤处, 然后将胃送入腹腔内, 缝合腹壁和皮肤[11].
1.2.1 分组: 模型制作后, 动物随机分为N-去硫酸肝素注射组(N-去硫酸肝素组, n = 10)和生理盐水注射组(生理盐水组, n = 10). 术后第1 wk, N-去硫酸肝素组静脉内注射N-去硫酸肝素(中国科学院上海细胞生物学和生化所), 每次10 mg/(kg·d)(以100 μL生理盐水稀释), 2次/wk, 共3 wk. 生理盐水组静脉内注射生理盐水, 每次100 μL, 2次/wk, 共3 wk. 每周SCID小鼠称质量2次.
1.2.2 标本收集和病理学检查: 所有动物于第6 wk末处死. 对胃癌组织、肿大淋巴结与可疑转移脏器进行病理学检查. 肿瘤组织标本以40 g/L甲醛固定, 石蜡包埋后常规切片, HE染色, 光镜下观察肿瘤病理变化, 检测肿瘤转移情况.
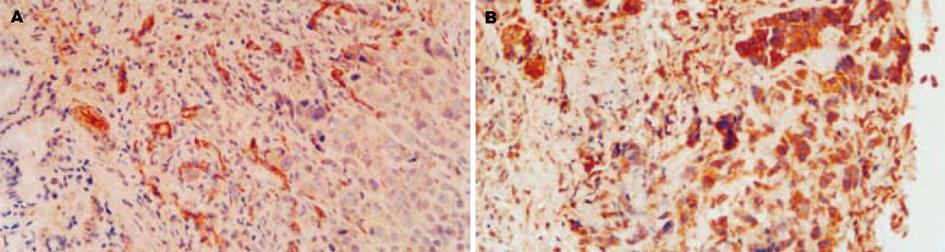
1.2.3 肿瘤平均微血管密度测定: 4 μm厚的石蜡切片脱腊后, 应用免疫组化Envision二步法检测CD34, 一抗浓度为1∶300, 以血管内皮细胞出现棕黄色染色为阳性. 参照Weidner的方法, 计算肿瘤平均微血管密度, 先在低倍光镜(×100)下全面观察切片以确定肿瘤内血管密度最高处. 再在高倍镜(×200)下, 记录5个视野内的微血管数, 取其平均数作为该动物的平均微血管密度值.
1.2.4 肿瘤组织VEGF表达测定: 4 μm厚的石蜡切片脱腊后, 应用免疫组化Envision二步法检测VEGF的表达, 一抗浓度为1∶60, 以肿瘤细胞细胞质内出现棕黄色颗粒为阳性染色. 阳性染色的细胞在10%以下为阳性+, 阳性染色的细胞在10%以上为阳性++, 两者相加为阳性染色数.
统计学处理 应用Student's t检验和χ2精确法检验, P<0.05有显著性差异.
人胃癌SGC-7901组织原位移植SCID小鼠后第6 wk, 见胃癌移植瘤均原位生长良好, 肿瘤向胃腔内突出, 质硬脆; 光镜下见肿瘤组织为低分化胃腺癌组织, 浸润肌层、黏膜下层和黏膜层. 对肿大淋巴结与可疑转移脏器进行病理学检查, 发现淋巴结转移以胃周、肠系膜和主动脉旁淋巴结为主; 各脏器转移以肝脏最为常见, 其次为肺、胰、脾等脏器.
生理盐水组肿瘤转移率为80%, 分别为淋巴结转移8例(8/10), 肝脏转移6例, 其他脏器转移6例. 但经N-去硫酸肝素治疗的小鼠, 则胃癌的淋巴结和脏器的转移明显被抑制. N-去硫酸肝素组发现2例肿瘤转移(2/10), 转移率为20%. 经χ2精确法检验, 生理盐水组肿瘤转移率高于N-去硫酸肝素组, 两组之间差异有统计学意义, P<0.05. N-去硫酸肝素应用对SCID小鼠体质量未见明显影响, 未发现出血等副作用.
光学显微镜下观察, 可见CD34在血管内皮细胞膜和细胞质染色, 出现管腔结构(图1A). 生理盐水组SCID小鼠胃的原位移植瘤血管生成明显, 平均微血管密度为8.0±3.1. N-去硫酸肝素治疗组SCID小鼠胃的原位移植瘤新生血管生成被抑制, 其平均微血管密度为4.3±1.8. 经统计学处理, 两组之间差别有显著意义(P<0.05).
自1971年Folkman提出肿瘤生长依赖新生血管以来, 近年有关肿瘤血管生成与肿瘤生长和转移的研究已受到关注[12,13]. 血管生成是体积大于1-2 mm3实体瘤生长和肿瘤细胞转移的条件, 抗血管生成治疗对改善胃癌患者临床疗效和预后有重要意义[1,3,12,14]. 动物实验研究发现, 肝素除了抗凝作用外, 可抑制血管生成, 因此可能具有抗肿瘤转移作用[8,15]. 然而由于其强烈的抗凝活性, 限制了其在临床应用. 对肝素进行化学修饰, 可降低其抗凝活性, 但可增强其抗血管生成作用. 近年研究表明, 低分子肝素抗凝活性显著下降, 但其结合血管内皮生长因子、成纤维生长因子和肝细胞生长因子等活性显著增强, 因此抑制肿瘤的血管生成作用加强[16]. N-乙酰肝素对肝素酶的抑制作用加强, 抗血管生成和抗转移作用较非修饰肝素显著增强[10]. N-去硫酸肝素为化学修饰肝素, 抗凝活性为肝素的1/76, 但其抗炎作用加强[17]. 目前未见N-去硫酸肝素抗肿瘤转移研究报道. 我们用人胃癌SGC-7901组织原位移植SCID小鼠建立胃癌转移模型, 研究N-去硫酸肝素对胃癌转移及血管生成的影响. 该模型与人类胃癌转移相似, 肿瘤转移率高, 是胃癌转移研究的理想模型. 我们研究发现, 人胃癌组织原位移植SCID小鼠6 wk后, 肿瘤转移率为80%. 但经N-去硫酸肝素治疗后, 肿瘤转移显著被抑制, 转移率为20%, 经χ2检验, 两组之间差别显著(P<0.05). 这与文献报道一致. Szende et al[18]的研究发现, 低分子肝素(Fraxiparine)剂量为57 IU/kg和173 IU/kg, 对两种实验性肿瘤转移模型具有显著的抗转移作用, 肝素以100 IU/kg对肿瘤转移未见明显影响. Amirkhosravi et al[19]研究了低分子肝素(tinzaparin)对黑色素瘤的抗转移作用. 结果发现低分子肝素对黑色素瘤转移的抑制作用为89%(P<0.001). Naggi et al[10]的研究发现N-乙酰肝素的抗凝活性较低, 但抗肿瘤转移作用较未修饰肝素明显增强. Kragh et al[20]研究发现, 非抗凝肝素NAC8000对实验性肿瘤转移模型具有抗转移作用, 且未发现明显出血副作用. 研究结果表明N-去硫酸肝素对胃癌等肿瘤具有抗转移作用.
肿瘤血管生成是肿瘤生长和转移的条件. 肿瘤血管生成机制极其复杂, 肿瘤细胞产生的血管内皮生长因子是重要的促血管生长因子, 通过与受体VEGFR1、VEGFR2结合, 具有特异性促进血管内皮细胞增殖和迁移, 增加血管通透性, 在肿瘤的生长与转移中起到重要的作用[3-6].
我们研究了N-去硫酸肝素对SCID小鼠胃癌血管生成和VEGF的影响. 结果发现, N-去硫酸肝素组的肿瘤平均微血管密度明显低于对照组, 说明N-去硫酸肝素对肿瘤新生血管的生成具有显著的抑制作用. Collen et al[15]的体外研究发现, 肝素与低分子肝素对VEGF刺激的血管内皮细胞增殖和血管形成具有抑制作用. Fernandez et al[21]的研究结果表明, 低分子肝素可抑制肿瘤血管形成. Mousa et al[22]发现, 低分子肝素(tinzaparin)可抑制肿瘤血管生成, 但与促血管生成因子作用无关. Naggi et al[10]的研究表明, N-乙酰肝素等修饰肝素较未修饰肝素具有更强的抗血管生成和抗转移作用. 表明, 肿瘤新生血管大量形成增加了肿瘤细胞转移的机会, 新生的血管通透性较高, 因此增加了肿瘤的转移, 而N-去硫酸肝素通过抑制肿瘤血管生成对胃癌等实体瘤具有抗转移作用.
我们发现, 人胃癌组织原位移植SCID小鼠第6 wk, 肿瘤组织VEGF的阳性率为90%, 但经去硫酸肝素治疗后, 肿瘤细胞VEGF明显被抑制(P<0.05), 说明N-去硫酸肝素对胃癌VEGF具有抑制作用. Kakeji et al[23]研究了VEGF表达与胃癌患者的肿瘤转移和预后的关系, 结果发现, VEGF阳性患者的肿瘤转移明显高于阴性患者, VEGF阳性患者预后较差. Fondevila et al[24]的研究表明VEGF表达与胃癌患者术后肿瘤转移复发和预后相关. Tsujitani et al[4]研究了胃癌患者VEGF表达与微血管密度的关系, 结果发现肿瘤细胞内VEGF阳性表达的微血管密度明显高于阴性患者. Pisano et al[25]的研究表明, 低硫酸化的低分子肝素可抑制VEGF诱导的新生血管形成. 研究结果表明, 肿瘤细胞通过分泌VEGF等促血管生长因子, 促进肿瘤新生血管生成, 从而使肿瘤组织内血管增多, 血管通透性增加, 因此在肿瘤转移中起重要作用, N-去硫酸肝素通过抑制VEGF和肿瘤新生血管形成, 对胃癌等肿瘤具有抗转移作用.
总之, N-去硫酸肝素具有抑制肿瘤血管生成和抗肿瘤转移作用, 但无明显出血等副作用, 表明其抗凝活性低, 因此对胃癌等肿瘤转移的治疗具有重要的临床意义.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Klerk CP, Smorenburg SM, Otten HM, Lensing AW, Prins MH, Piovella F, Prandoni P, Bos MM, Richel DJ, van Tienhoven G. The effect of low molecular weight heparin on sur-vival in patients with advanced malignancy. J Clin Oncol. 2005;23:2130-2135. [PubMed] [DOI] |
| 2. | Castelli R, Porro F, Tarsia P. The heparins and cancer: review of clinical trials and biological properties. Vasc Med. 2004;9:205-213. [PubMed] [DOI] |
| 3. | Shinkaruk S, Bayle M, Lain G, Deleris G. Vascular endothelial cell growth factor (VEGF), an emerging target for cancer chem-otherapy. Curr Med Chem Anti-Canc Agents. 2003;3:95-117. [PubMed] [DOI] |
| 4. | Tsujitani S, Saito H, Maeta Y, Yamaguchi K, Tatebe S, Kondo A, Kaibara N. Neoangiogenesis in patients with gastric carcinoma in relation to the expression of vascular endothelial growth factor and thymidine phosphorylase. Anticancer Res. 2004;24:1853-1859. [PubMed] |
| 5. | Reinmuth N, Parikh AA, Ahmad SA, Liu W, Stoeltzing O, Fan F, Takeda A, Akagi M, Ellis LM. Biology of angiogenesis in tumors of the gastrointestinal tract. Microsc Res Tech. 2003;60:199-207. [PubMed] [DOI] |
| 6. | Petralia GA, Lemoine NR, Kakkar AK. Mechanisms of disease: the impact of antithrombotic therapy in cancer patients. Nat Clin Pract Oncol. 2005;2:356-363. [PubMed] [DOI] |
| 7. | Jung YD, Mansfield PF, Akagi M, Takeda A, Liu W, Bucana CD, Hicklin DJ, Ellis LM. Effects of combination anti-vascular endothelial growth factor receptor and anti-epidermal growth factor receptor therapies on the growth of gastric cancer in a nude mouse model. Eur J Cancer. 2002;38:1133-1140. [PubMed] [DOI] |
| 8. | Tovari J, Bereczky B, Gilly R, Skopal J, Vago A, Timar J. Hep-arin inhibits metastatization of experimental melanoma. Magy Onkol. 2004;48:235-241. [PubMed] |
| 9. | Bobek V, Kovarik J. Antitumor and antimetastatic effect of warfarin and heparins. Biomed Pharmacother. 2004;58:213-219. [PubMed] [DOI] |
| 10. | Naggi A, Casu B, Perez M, Torri G, Cassinelli G, Penco S, Pis-ano C, Giannini G, Ishai-Michaeli R, Vlodavsky I. Modulation of the heparanase-inhibiting activity of heparin through selec-tive desulfation, graded N-acetylation, and glycol splitting. J Biol Chem. 2005;280:12103-12113. [PubMed] [DOI] |
| 11. | Chen JL, Chen WX, Zhu JS, Chen NW, Zhou T, Yao M, Zhang DQ, Wu YL. Effect of P-selectin monoclonal antibody on metastasis of gastric cancer and immune function. World J Gastroenterol. 2003;9:1607-1610. [PubMed] [DOI] |
| 12. | Mousa SA. Low-molecular-weight heparin in thrombosis and cancer. Semin Thromb Hemost. 2004;30:25-30. [PubMed] [DOI] |
| 13. | Zacharski LR. Anticoagulants in cancer treatment: malignancy as a solid phase coagulopathy. Cancer Lett. 2002;186:1-9. [PubMed] [DOI] |
| 14. | Ranieri G, Coviello M, Chiriatti A, Stea B, Montemurro S, Quaranta M, Dittadi R, Paradiso A. Vascular endothelial gro-wth factor assessment in different blood fractions of gastroin-testinal cancer patients and healthy controls. Oncol Rep. 2004;11:435-439. [PubMed] |
| 15. | Collen A, Smorenburg SM, Peters E, Lupu F, Koolwijk P, Van Noorden C, van Hinsbergh VW. Unfractionated and low mole-cular weight heparin affect fibrin structure and angiogenesis in vitro. Cancer Res. 2000;60:6196-6200. [PubMed] |
| 16. | Ono K, Ishihara M, Ishikawa K, Ozeki Y, Deguchi H, Sato M, Hashimoto H, Saito Y, Yura H, Kurita A. Periodate-treated, non-anticoagulant heparin-carrying polystyrene (NAC-HCPS) affects angiogenesis and inhibits subcutaneous induced tumour growth and metastasis to the lung. Br J Cancer. 2002;86:1803-1812. [PubMed] [DOI] |
| 17. | Zhou T, Chen JL, Song W, Wang F, Zhang MJ, Ni PH, Geng JG. Effect of N-desulfated heparin on hepatic/renal ischemia reperfusion injury in rats. World J Gastroenterol. 2002;8:897-900. [PubMed] [DOI] |
| 18. | Szende B, Paku S, Racz G, Kopper L. Effect of Fraxiparine and heparin on experimental tumor metastasis in mice. Anticancer Res. 2005;25:2869-2872. [PubMed] |
| 19. | Amirkhosravi A, Mousa SA, Amaya M, Francis JL. Antime-tastatic effect of tinzaparin, a low-molecular-weight heparin. J Thromb Haemost. 2003;1:1972-1976. [PubMed] [DOI] |
| 20. | Kragh M, Binderup L, Vig Hjarnaa PJ, Bramm E, Johansen KB, Frimundt Petersen C. Non-anti-coagulant heparin inhibits metastasis but not primary tumor growth. Oncol Rep. 2005;14:99-104. [PubMed] |
| 21. | Fernandez PM, Patierno SR, Rickles FR. Tissue factor and fibr-in in tumor angiogenesis. Semin Thromb Hemost. 2004;30:31-44. [PubMed] [DOI] |
| 22. | Mousa SA, Mohamed S. Anti-angiogenic mechanisms and efficacy of the low molecular weight heparin, tinzaparin: anti-cancer efficacy. Oncol Rep. 2004;12:683-688. [PubMed] [DOI] |
| 23. | Kakeji Y, Koga T, Sumiyoshi Y, Shibahara K, Oda S, Maehara Y, Sugimachi K. Clinical significance of vascular endothelial gro-wth factor expression in gastric cancer. J Exp Clin Cancer Res. 2002;21:125-129. [PubMed] |
| 24. | Fondevila C, Metges JP, Fuster J, Grau JJ, Palacin A, Castells A, Volant A, Pera M. p53 and VEGF expression are independent predictors of tumour recurrence and survival following cura-tive resection of gastric cancer. Br J Cancer. 2004;90:206-215. [PubMed] [DOI] |
| 25. | Pisano C, Aulicino C, Vesci L, Casu B, Naggi A, Torri G, Riba-tti D, Belleri M, Rusnati M, Presta M. Undersulfated, low-mol-ecular-weight glycol-split heparin as an antiangiogenic VEGF antagonist. Glycobiology. 2005;15:1C-6C. [PubMed] [DOI] |