修回日期: 2005-09-25
接受日期: 2005-09-30
在线出版日期: 2005-11-28
目的: 探讨δ氨基酮戊酸-光动力疗法(ALA-PDT)诱导SW480细胞钙调素(CaM)和突变型p53基因表达变化.
方法: 将SW480细胞分为4组: 对照组、光照组、ALA组、ALA-PDT组, 采用半定量逆转录聚合酶链反应(RT-PCR)方法检测各组细胞中CaM3和突变型p53基因的表达.
结果: 空白对照组, 激光照射组, ALA组, ALA-PDT后30 min组, ALA-PDT后60 min组以及ALA-PDT后90 min组的CaM3的相对表达量分别为3.97±0.29, 4.28±0.39, 4.51±0.44, 12.60±1.84, 11.39±1.13和12.77±1.35, 空白对照组、激光照射组和ALA组CaM3的相对表达与ALA-PDT组比较具有显著差异(P<0.001), 即ALA-PDT后30-90 min, CaM3表达显著升高; 空白对照组, 激光照射组, ALA组, ALA-PDT后30 min组, ALA-PDT后60 min组以及ALA-PDT后90 min组的p53的相对表达量分别为: 1.12±0.083, 1.53±0.191, 1.23±0.145, 0.47±0.04, 0.42±0.06和0.49±0.38, 空白对照组、激光照射组和ALA组p53的相对表达与ALA-PDT组比较具有显著差异(P<0.001), 即p53表达显著下降.
结论: δ氨基酮戊酸-光动力疗法诱导SW480细胞凋亡机制之一可能与钙调素表达升高和突变型p53表达降低有关.
引文著录: 郑江华, 时德, 陈祖林, 梁平. δ氨基酮戊酸-光动力疗法诱导 SW480 细胞钙调素和突变型 p53的表达变化. 世界华人消化杂志 2005; 13(22): 2677-2680
Revised: September 25, 2005
Accepted: September 30, 2005
Published online: November 28, 2005
AIM: To investigate the expression of calmodulin (CaM) and mutant p53 in human colon carcinoma SW480 cell lines after induced by delta-aminolevulinic acid (ALA)-based photodynamic therapy (PDT).
METHODS: SW480 cells were divided into control, laser light, ALA, and ALA-PDT group. The expression of CaM3 and mutant p53 in SW480 cells were detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The relative contents of CaM3 in the contr-ol, light, ALA group, and ALA-PDT 30, 60, and 90 min group were 3.97 ± 0.29, 4.28 ± 0.39, 4.51 ± 0.44, 12.60 ± 1.84, 11.39 ± 1.13, and 12.77 ± 1.35, respectively. The expression of CaM3 in the ALA-PDT 30-90 min group was significantly increased in comparison with that in the control, light, and ALA group (P <0.001). The relati-ve expression of p53 gene in the control, light, ALA group, and ALA-PDT 30, 60, and 90 min group were 1.12 ± 0.083, 1.53 ± 0.191, 1.23 ± 0.145, 0.47 ± 0.04, 0.42 ± 0.06, and 0.49 ± 0.38, respectively. The expression of p53 in the ALA-PDT 30-90 min group was significantly decreased in comparison with that in the control, light, and ALA group (P <0.001).
CONCLUSION: The increase of calmodulin expression and decrease of mutant p53 expression may be involv-ed in the mechanism of ALA-PDT-induced apoptosis in SW480 cells.
- Citation: Zheng JH, Shi D, Chen ZL, Liang P. Expression of calmodulin and mutant p53 in SW480 cells in response to delta-aminolevulinic acid-based photodynamic therapy. Shijie Huaren Xiaohua Zazhi 2005; 13(22): 2677-2680
- URL: https://www.wjgnet.com/1009-3079/full/v13/i22/2677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i22.2677
光动力疗法(photodynamic therapy, PDT)是指光敏剂选择性地聚集在肿瘤组织中, 接受光照后在细胞内产生活性氧物质, 而导致肿瘤细胞凋亡或坏死的一种治疗方法. 迄今为止, 加拿大、美国、法国、荷兰、德国和日本等国家已先后批准PDT用于一些恶性肿瘤[1]. d氨基酮戊酸(aminolevulinic acid, ALA) 光动力疗法(ALA-PDT)的优势在于使用了d氨基酮戊酸, 一种血红素生物合成的前体物质. 在大多数类型的癌细胞中, 由于胆色素原脱氨基酶活性增加而亚铁鳌合酶活性降低[2], 导致原卟啉Ⅸ(protoporphyrin Ⅸ, Pp Ⅸ)在癌细胞内积累, Pp Ⅸ具有极好的光敏特性, 用与之吸收波段相应的光照射后将导致癌细胞的破坏[3]. ALA-PDT的临床应用主要在于其对癌细胞具有高度特异性且全身应用后的皮肤光敏的副作用时间短[4]. PDT能诱导许多不同细胞系发生凋亡[5], 其细胞毒机制主要依赖于细胞类型、光敏剂及其在细胞内的分布位置. ALA-PDT诱导细胞凋亡的研究也有报道[5], 但其所诱导的细胞凋亡是否存在钙信号途径还不清楚. 我们以前的研究表明ALA-PDT作用SW480细胞后存在细胞内钙离子浓度瞬时升高[6], 并发现细胞凋亡与细胞内钙离子浓度变化密切相关, 为此我们对ALA-PDT作用SW480后细胞内钙调素(calmodulin, CaM)基因CaM3和p53 mRNA的含量变化进行探讨.
光敏剂ALA购于Sigma公司; SW480由第四军医大学实验中心提供; 引物由上海生工合成; RT-PCR试剂盒购于北京鼎国生物技术公司.
1.2.1 PDT处理: 用含有青霉素和链霉素(分别1×105 U/L)和100 mL/L小牛血清的RPMI 1640培养基培养人结肠癌细胞(SW480), 37℃, 50 mL/L CO2, 饱和湿度, 单层贴壁生长. 实验分为4组: 空白对照组, 激光照射组, ALA组及ALA-PDT处理组. 光敏剂ALA用PBS配制成400 mg/L的储存液, 过滤待用, 工作液用无血清培养基稀释为40 mg/L(终浓度). ALA组和ALA-PDT处理组在暗室按预定时间加入ALA, 严格避光条件下继续孵育4 h, 激光照射组和ALA-PDT处理组使用半导体激光仪(西南师范大学激光所, 波长532 nm, 距光斑3 cm处输出功率12 mW)垂直照射培养板30 min. 空白对照组不加ALA且不受激光照射, ALA组加入ALA不受激光照射.
1.2.2 总RNA提取: 取对数生长期2×105个细胞接种到6孔培养板中, 分别为ALA组、激光照射组、空白对照组、ALA-PDT后30 min组、ALA-PDT后60 min组及ALA-PDT后90 min组. 48 h后进行PDT处理, 按预定时间加入1 mL Trizol(北京鼎国生物技术公司)/孔, 适当吹打, 室温放置5 min, 将细胞吸入1.5 mL EP中, 加入0.2 mL氯仿. 用力震荡15 s后室温放置15 min, 4℃, 12000 g离心15 min, 将上层水相移入新的EP管后加0.5 mL异丙醇, 用力混合后室温放置10 min, 4℃, 12000 g离心10 min, 弃上清后加入750 mL/L乙醇洗涤2次, 室温干燥5-10 min, 加入20 μL高压灭菌的DEPC水溶解RNA沉淀. 然后用紫外分光光度计测定浓度和纯度, 并用甲醛变性凝胶电泳检测RNA的完整性.
1.2.3 RT-PCR: 每组取1 μg总RNA于一支0.2 mL的EP管中, 65℃保温10 min, 离心数秒, 放置冰浴中, 按照RT-PCR试剂盒操作说明进行RT反应, 结束后将cDNA放入-20℃备用. PCR体系为25 μL: RT反应产物2 μL、10×PCR buffer 2.5 μL、dNTP 0.5 μL、上下游引物(上海生工合成)各25 pmol、通用引物(GAPDH, 594 bp, 试剂盒自带)0.25 μL、Taq酶0.5 μL, 加高压灭菌的DEPC水补足25 μL. 引物序列、PCR反应条件及产物长短见(表1).
| 基因 | 引物序列 (5'-3') | 退火温度 | PCR产物长度 |
| CaM3 | 上游: CTTGGCGCCGCTTCCTCACATCTG | 63℃ | 104 bp |
| 下游: GCCTCACGCCTACCTGCCCTTACC | |||
| p53 | 上游: TCTGGGACAGCCAAGTCTGT | 58℃ | 435 bp |
| 下游: GGAGTCTTCCAGTGTGATGA |
1.2.4 PCR产物的检测及扩增量的测量: CaM3和p53分别与GAPDH采用Touch-down PCR方法同管扩增, PCR结束后, 取5 μL扩增产物与6×loading buffer 1 μL混合后, 用20 g/L琼脂糖凝胶(含EB)在100 V恒电压下电泳60 min后, 用凝胶成像仪在紫外线照射下直接将电泳图像输入计算机, 用图像分析软件测量目的条带灰度值/单位面积, 结果与相应的GAPDH灰度值/单位面积相除后, 所得的商作为各组被检测基因mRNA的相对含量.
统计学处理 每组重复8次, 所得数据以mean±SD表示, 显著性检验采用χ2检验, 采用SPSS11.5统计软件进行数据处理.
A260/A280值在1.8-2.0之间, 说明RNA有较高的纯度. 1 mL RNA的量为0.5-1.5 mg之间. 10 g/L甲醛变性琼脂糖凝胶变性电泳结果说明RNA没有降解, 较完整.
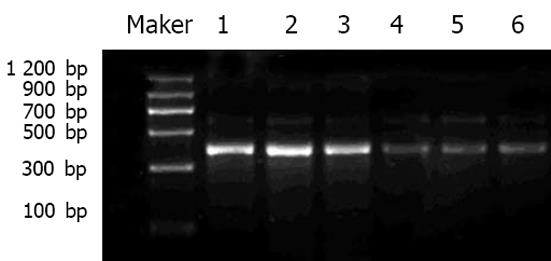
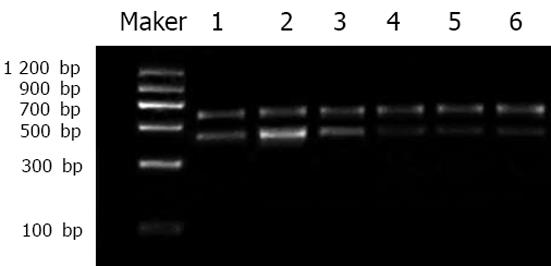
经20 g/L琼脂糖凝胶电泳后, CaM3、p53以及GAPDH基因的产物长度与理论长度一致(图1, 图2). 空白对照组、激光照射组、ALA组、ALA-PDT后30 min组、ALA-PDT后60 min组以及ALA-PDT后90 min组的CaM3相对表达量分别为3.97±0.29, 4.28±0.39, 4.51±0.44, 12.60±1.84, 11.39±1.13和12.77±1.35, 空白对照组、激光照射组和ALA组CaM3的相对表达与ALA-PDT组比较具有显著差异(χ2 = 63.45, P<0.001), 即ALA-PDT后30-90 min, CaM3表达显著升高; 空白对照组、激光照射组、ALA组、ALA-PDT后30 min组、ALA-PDT后60 min组以及ALA-PDT后90 min组的p53相对表达量分别为: 1.12±0.083, 1.53±0.191, 1.23±0.145, 0.47±0.04, 0.42±0.06和0.49±0.38, 空白对照组、激光照射组和ALA组p53的相对表达与ALA-PDT组比较具有显著差异(χ2 = 61.23, P<0.001), 即ALA-PDT后30-90 min, p53表达显著下降.
细胞内游离钙作为重要的第二信使参与多种细胞功能的调节, 钙浓度的改变是细胞生理功能的重要物质基础, 也是多种受体激活后信号传递过程的中心环节. Ca2+信使的靶分子或感受体是Ca2+结合蛋白(CaBPs), CaBPs种类极多, 按照从Ca2+调节反应的性质上分, 有的是起缓冲Ca2+或运输体的作用, 有的是Ca2+直接调节的、与传递信号相关的酶蛋白, 最多的一类是与Ca2+结合后产生构象变化而后作为中介体, 可耦合激活一些下游蛋白激酶、蛋白磷酸酶、钙通道和钙泵等活性, 即钙信号的感受体, 在钙信号途径中起重要作用, 特别是钙信号的多功能感受体-CaM, 是细胞中分布最广、功能最多的一种钙信号的感受体. CaM可以两种方式调节靶蛋白的活性: 一是直接与靶酶结合, 诱导靶酶的活性构象而调节他们的活性, 如Ca2+-ATP酶、PDE 酶、cAMP环化酶等; 二是通过活化依赖Ca2+-CaM的蛋白激酶, 间接影响其活性, 如磷酸化酶、糖原合成酶等, 这种方式在钙信号传递中起着重要作用.
细胞内游离钙离子(Ca2+)浓度异常升高是导致细胞死亡的重要信号[7], 我们以前的实验表明ALA-PDT对 SW480细胞具有很强的杀伤作用, 并能引起细胞内Ca2+ 瞬时生高[6]. 本研究表明ALA-PDT后30-90 min, CaM3 mRNA含量显著高于其他对照组. Grebenova et al[8]用ALA-PDT处理HL60人白血病细胞, 结果发现ALA-PDT处理组细胞的CaM蛋白表达增高, 并导致caspase-3激活. 因此ALA-PDT对SW480细胞的强细胞毒效应可能机制之一是: Ca2+浓度升高刺激CaM从mRNA水平到蛋白水平表达增加, 从而激活caspase-3, 其底物包括Ras-GTP酶激活蛋白(Ras-GAP)、聚腺苷二磷酸核糖基聚合酶[poly(adenosine diphosphate-ribose)polymerase, PARP]和Bap-31[9], DNA依赖的蛋白激酶C[10], caspase活化的DNA酶抑制物(inhibitor of caspase-activated deoxyribonuclease, ICAD)[11], 病灶黏附激酶(focal adhesion kinase, FAK)和核纤层蛋白[12]等; 通过上述蛋白的裂解或活化, 切断与周围细胞的联络、关闭DNA复制和修复、破坏DNA和核结构, 最终造成ALA-PDT对SW480的强细胞毒作用. 另外, Ca2+浓度升高可能直接激活Ca2+依赖核酸内切酶[13], 导致单链和双链DNA断裂, 引起p53表达增加. p53在细胞凋亡中起着重要作用[14], 并对DNA修复有直接和间接作用[15]. p53基因分为野生型和突变型两种, 其产物也有野生型和突变型. 野生型蛋白具有反式激活功能和广普的肿瘤抑制作用, 针对许多不同原因(紫外线照射, 化疗等)的DNA损伤, 野生型p53从转录水平激活或抑制p53反应基因(如Bax、Fas/Apol、p21等). 突变型p53能减少野生型p53特定DNA结合序列并降低野生型p53转录激活[14], 改变细胞对DNA损伤的敏感性, 促进肿瘤细胞恶化. 野生型p53是人类肿瘤中突变率最高的基因, SW480细胞主要表达突变型p53[16], ALA-PDT对SW480细胞的p53是否有抑制作用呢? 我们的实验表明, ALA-PDT后30-90 min, p53 mRNA含量显著低于其他对照组. Zacal et al[17]用PDT处理人结肠癌细胞HT29, 结果发现突变型p53表达降低, 与我们的实验结果一致. 说明ALA-PDT能抑制突变型p53的转录, 从而具有抗肿瘤的作用.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Johansen LS. Photodynamic therapy. A new method for the treatment of cancer. Ugeskr Laeger. 1999;161:3992-3995. [PubMed] |
| 2. | Bartosova J, Hrkal Z. Accumulation of protoporphyrin-IX (PpIX) in leukemic cell lines following induction by 5-amino-levulinic acid (ALA). Comp Biochem Physiol C Toxicol Pharmacol. 2000;126:245-252. [PubMed] |
| 3. | Dougherty TJ, Gomer CJ, Henderson BW, Jori G, Kessel D, Korbelik M, Moan J, Peng Q. Photodynamic therapy. J Natl Cancer Inst. 1998;90:889-905. [PubMed] [DOI] |
| 4. | Peng Q, Warloe T, Berg K, Moan J, Kongshaug M, Giercksky KE, Nesland JM. 5-Aminolevulinic acid-based photodynamic therapy. Clinical research and future challenges. Cancer. 1997;79:2282-2308. [PubMed] [DOI] |
| 5. | Almeida RD, Manadas BJ, Carvalho AP, Duarte CB. Intracell-ular signaling mechanisms in photodynamic therapy. Biochim Biophys Acta. 2004;1704:59-86. [PubMed] |
| 7. | Antoine AF, Faure JE, Dumas C, Feijo JA. Differential contri-bution of cytoplasmic Ca2+ and Ca2+ influx to gamete fusion and egg activation in maize. Nat Cell Biol. 2001;3:1120-1123. [PubMed] [DOI] |
| 8. | Grebenova D, Kuzelova K, Smetana K, Pluskalova M, Cajth-amlova H, Marinov I, Fuchs O, Soucek J, Jarolim P, Hrkal Z. Mitochondrial and endoplasmic reticulum stress-induced apo-ptotic pathways are activated by 5-aminolevulinic acid-based photodynamic therapy in HL60 leukemia cells. J Photochem Photobiol B. 2003;69:71-85. [PubMed] [DOI] |
| 9. | Vantieghem A, Assefa Z, Vandenabeele P, Declercq W, Cour-tois S, Vandenheede JR, Merlevede W, de Witte P, Agostinis P. Hypericin-induced photosensitization of HeLa cells leads to apoptosis or necrosis. Involvement of cytochrome c and proca-spase-3 activation in the mechanism of apoptosis. FEBS Lett. 1998;440:19-24. [PubMed] [DOI] |
| 10. | Granville DJ, Levy JG, Hunt DW. Photodynamic therapy indu-ces caspase-3 activation in HL-60 cells. Cell Death Differ. 1997;4:623-628. [PubMed] [DOI] |
| 11. | Granville DJ, Jiang H, An MT, Levy JG, McManus BM, Hunt DW. Overexpression of Bcl-X(L) prevents caspase-3-mediated activation of DNA fragmentation factor (DFF) produced by treatment with the photochemotherapeutic agent BPD-MA. FEBS Lett. 1998;422:151-154. [PubMed] [DOI] |
| 12. | Carthy CM, Granville DJ, Jiang H, Levy JG, Rudin CM, Thom-pson CB, McManus BM, Hunt DW. Early release of mitochon-drial cytochrome c and expression of mitochondrial epitope 7A6 with a porphyrin-derived photosensitizer: Bcl-2 and BclxL overexpression do not prevent early mitochondrial events but still depress caspase activity. Lab Invest. 1999;79:953-965. [PubMed] |
| 14. | Giaccia AJ, Kastan MB. The complexity of p53 modulation: emerging patterns from divergent signals. Genes Dev. 1998;12:2973-2983. [PubMed] [DOI] |
| 15. | McKay BC, Ljungman M, Rainbow AJ. Potential roles for p53 in nucleotide excision repair. Carcinogenesis. 1999;20:1389-1396. [PubMed] [DOI] |
| 16. | Wang T, Chen F, Chen Z, Wu YF, Xu XL, Zheng S, Hu X. Hono-kiol induces apoptosis through p53-independent pathway in human colorectal cell line RKO. World J Gastroenterol. 2004;10:2205-2208. [PubMed] |
| 17. | Zacal N, Espiritu M, Singh G, Rainbow AJ. Increased BNip3 and decreased mutant p53 in cisplatin-sensitive PDT-resistant HT29 cells. Biochem Biophys Res Commun. 2005;331:648-657. [PubMed] [DOI] |