修回日期: 2005-09-10
接受日期: 2005-09-17
在线出版日期: 2005-11-15
目的: 探讨塞莱昔布对体外培养的结肠癌细胞生长及肝转移瘤模型血管生长因子(VEGF)表达的影响.
方法: 以人结肠癌细胞株HT-29, HCT-116为对象, 体外药物敏感实验(MTT)法检测塞莱昔布对肿瘤细胞的增殖抑制效应, 流式细胞术检测肿瘤细胞各细胞周期分布变化情况, 肿瘤细胞接种裸鼠, 观察肝转移瘤VEGF表达情况.
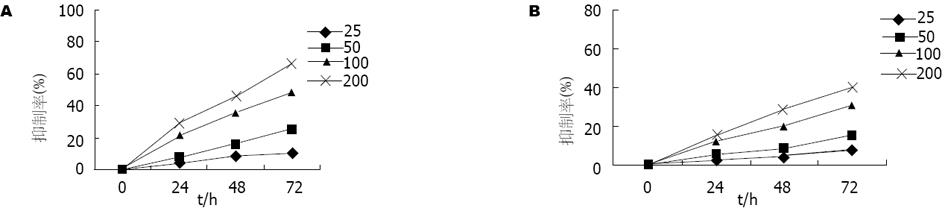
结果: 塞莱昔布对人结肠癌细胞株生长的抑制作用呈时间、剂量依赖性效应, 且对HT-29细胞作用强于HCT-116细胞(P<0.01); 塞莱昔布可改变结肠癌细胞株细胞周期的分布, 明显降低增殖指数(P<0.05). 塞莱昔布具有明显的抑制肝转移瘤VEGF表达的作用(P = 0.00).
结论: 塞莱昔布可通过抑制COX-2酶活性而抑制肿瘤细胞的分裂和增殖, 诱导其凋亡, 并抑制肿瘤血管生成, 干预结肠癌的转移与复发.
引文著录: 张超, 刘伟, 安杰, 刘占奎. 塞莱昔布对结肠癌细胞生长及肝转移瘤血管生长因子表达的影响. 世界华人消化杂志 2005; 13(21): 2623-2626
Revised: September 10, 2005
Accepted: September 17, 2005
Published online: November 15, 2005
AIM: To explore the role of celecoxib in the proliferation and cycle distribution of colon cancer cells cultured in vitro as well as its effect on the expression of vascular endothelial growth factor (VEGF) in the animal model of colon cancer with hepatic metastasis.
METHODS: The human colon cancer cells HT-29 and HCT-116 were employed in the study. After treatment with celecoxib, the inhibitory effect of celecoxib on the proliferation of cancer cells was determined by MTT assay, and the cell cycle distribution was detected by flow cytometry. The tumor cells were inoculated in the nude mice, and the expression of VEGF in the model was detected by immunohistochemistry.
RESULTS: Celecoxib inhibited the proliferation of the tumor cells in a time- and dose-dependent manner. The inhibitory effect on HT-29 cells was stronger than that on HCT-116 cells (P <0.01). Celecoxib changed the cell cycle distribution of both cells, and decreased the proliferation index of cells obviously (P <0.05). Celecoxib significantly inhibited the expression of VEGF in the animal model of colon cancer with hepatic metastasis (P = 0.00).
CONCLUSION: Celecoxib can inhibit the division and proliferation of the tumor cells through inhibiting the activity of COX-2, consequently it play an important role in the prevention of hepatic metastasis and relapse of colon cancer.
- Citation: Zhang C, Liu W, An J, Liu ZK. Effects of celecoxib on cell proliferation and expression of vascular endothelial growth factor in colonic cancer with hepatic metastasis. Shijie Huaren Xiaohua Zazhi 2005; 13(21): 2623-2626
- URL: https://www.wjgnet.com/1009-3079/full/v13/i21/2623.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i21.2623
结肠癌是我国的高发恶性肿瘤, 其治疗技术已取得长足进步, 但术后转移仍是成功根治的最大障碍. 有研究显示结肠癌的血行转移、淋巴转移及复发与环氧合酶-2(cyclooxygenase-2, COX-2)的高表达有关[1,2], 而非甾体类抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)可通过抑制COX活性, 影响结肠肿瘤的发生和发展过程[3,4], 但因抑制COX-1表达而出现胃肠道、肾和血小板功能异常等不良反应, 因此COX-2选择性抑制剂的研究成了新近的热点[5-7]. 我们以COX-2选择性抑制剂塞莱昔布作用于结肠癌细胞, 并将肿瘤细胞接种BALB/c裸鼠, 建立结肠癌肝转移动物模型, 观察肿瘤细胞体外生长、细胞周期分布以及接种动物肝转移瘤VEGF表达的情况, 探讨塞莱昔布干预结肠癌转移与复发的作用机制.
1.1.1 DMEM培养液(Hyclony公司), 小牛血清(Gibco公司), 胰蛋白酶、MTT、DMSO、塞莱昔布(Sigma公司); CO2培养箱(Thermo Forma公司)、流式细胞仪(FACS Beckman, 美国); 兔抗鼠VEGF多克隆抗体、SABC免疫组化试剂盒(即用型)、浓缩型DAB显色试剂盒均购于武汉博士德生物工程有限公司.
1.1.2 细胞株与实验动物: 结肠癌细胞株HT-29(中南大学湘雅医学院肿瘤研究所), 结肠癌细胞株HCT-116(第三军医大学大坪医院病理科向德兵博士惠赠)培养于含100 mL/L小牛血清的DMEM培养液中, 细胞贴壁生长后取对数生长期的细胞以备实验之用. BALB/c-nu/nu裸小鼠36只, 鼠龄4-6 wk, 体质量15-20 g,♀, 购自华中科技大学同济医学院动物研究所, 饲养条件按SPF(无特殊病原体动物, specific pathogen free animals)要求.
1.2.1 体外药物敏感实验: 按照噻唑蓝(MTT)法, 取HT-29和HCT-116细胞按每孔5×103的密度接种于96孔板中, 24 h后更换培养基, 加入不同剂量的塞莱昔布原液, 使其终浓度分别为25, 50, 100, 200 μmol/L[5], 同时设只加等体积溶剂DMSO对照组和不接种细胞的空白对照组, 继续培养24, 48和72 h. 每一浓度每一时间点重复设8孔, 每孔加入MTT液(5 g/L)20 μL, 37℃孵育4 h后弃去上清, 每孔加入DMSO 150 μL, 轻轻振荡10 min, 充分溶解结晶物; 在酶联免疫检测仪上以570 nm波长测定各孔吸光度值(A值). 以时间为横轴, 吸光度值为纵轴绘制细胞生长曲线. 计算不同药物浓度对HT-29和HCT-116两种细胞的生长抑制率. 生长抑制率 = (对照组A值-实验组A值)/对照组A值×100%.
1.2.2 流式细胞法检测: 对数生长期的细胞, 胰酶消化后, 以1.0×108/L的密度传代、接种, 贴壁后加入DMEM培养基培养24 h, 加入新培养液及不同浓度的塞莱昔布原液, 使其终浓度分别为50, 100, 200 μmol/L, 设加等体积溶剂DMSO作为对照组; 继续培养至72 h, 胰酶消化成单细胞悬液, 冰PBS洗涤两次, 800 r/min离心5 min, 弃上清, 缓慢加入-20℃预冷的700 mL/L乙醇, 4℃过夜. 取细胞悬液, PBS洗涤, 1 600 r/min离心5 min后, 弃上清. PI染液1.0 mL染30 min, 混合液过300目滤网以除去杂质, 488 nm激发波长测定样品, 620 nm带通滤片检测PI荧光. 每样本收集多于10 000个荧光信号. MultiCycle软件分析, 计算细胞增殖指数(proliferation index, PI): PI = (S%+G2%)/(G1%+S%+G2%)×100.
1.2.3 动物模型建立及分组: 脾切除法建立结肠癌肝转移动物模型, 36只裸鼠随机分为HT-29组(n = 24)和HCT-116组(n = 12), 两组裸小鼠脾内分别注入HT-29和HCT-116细胞悬液0.1 mL, 细胞含量为1×106个, 注射时间为1 min. HT-29组24只裸鼠随机分为两组, 每组12只, 用灌胃法于次日给予塞来昔布10 mg/(kg·d)溶液. 接种后的小鼠自由进食、饮水, 活跃如常, 体形无改变, 每日观察. HT-29组, 2 wk后小鼠消瘦, 腹部渐膨隆. 行动渐迟缓, 精神差, 摄食量减少. 于接种后第21天即发现HT-29组有一只裸鼠死亡, 40 d所有裸鼠颈椎脱臼处死, 死亡小鼠均剖腹观察腹腔内肿瘤生长情况, 分别取肝脏置于40 g/L甲醛溶液中固定作病理组织学观察和置液氮冻存.
1.2.4 免疫组化结果判定: VEGF主要在肿瘤细胞的胞质内, 内皮细胞也可表达, 含有棕黄色或棕褐色颗粒的细胞被计为阳性细胞. 应用Image-pro plus 4.5免疫组化彩色图像分析系统对免疫组化结果进行定量分析, 以图片中的一个阳性点(单个细胞或小腺腔、细胞团)为基础, 分析、测定整幅图片的阳性点的个数、面积、积分光密度值(IOD)等参数.
统计学处理 所有数据采用SPSS 10.0统计分析软件包进行处理, 所得到的数值均以mean±SD表示, 组间以t检验进行处理, P<0.05为差异显著, P<0.01为差异非常显著.
随着塞莱昔布浓度的增加, 作用时间的延长, 药物对HT-29和HCT-116细胞增殖的抑制率明显增高. 塞莱昔布对HT-29细胞(COX-2高表达)的抑制作用较对HCT-116细胞(COX-2低表达)的作用明显.
传统的NSAIDs大多属COX非选择性抑制剂, 因此在发挥抗炎作用的同时对胃肠道及肾脏产生不良反应[8-10]. 塞莱昔布是COX-2特异性抑制剂. 体外及体内试验均表明他与COX-1的亲和力极弱, 治疗剂量的塞莱昔布不影响COX-1的激活, 从而不影响生理性前列腺素的合成. 因此, 塞莱昔布具有与传统非甾体抗炎药相同的抗炎、镇痛和退热作用, 而没有此类药物的不良反应[11,12].
凋亡是机体维持内环境自稳的重要内容, 细胞对凋亡的抵抗会增加基因突变的机率, 可能导致恶性转化. 近年来的报道显示, NSAIDs对结肠肿瘤生长产生抑制作用, 其机制可能和降低肿瘤细胞增殖力、细胞周期停滞和诱导细胞的凋亡有关[13]. 我们在倒置显微镜下动态观察了塞莱昔布对两种肿瘤细胞生长的影响, 随药物浓度的增加, 培养基中悬浮细胞增多, 细胞质混浊明显. MTT比色法显示塞莱昔布可以抑制HT-29和HCT-116细胞的增殖. 随时间的延长、药物剂量的增加, 其抑制作用也明显增强, 呈现时间-剂量依赖性方式, 且对HT-29细胞的生长抑制作用较HCT-116细胞明显, 提示塞莱昔布对结肠癌细胞作用的敏感程度与细胞COX-2的表达水平密切相关. 为进一步验证塞莱昔布抑制HT-29细胞、HCT-116细胞生长的机制, 我们检测了细胞周期分布和增殖情况, 结果显示塞莱昔布可使两种细胞G0/G1期比例增高, S、G2/M期比例降低, 表明塞莱昔布具有明显的G0/G1期阻滞作用, 并使处于S期的肿瘤细胞明显减少, 从而抑制细胞的生长、诱导其凋亡.
肿瘤组织中COX-2高表达是一种普遍现象, 运用COX-2选择性抑制剂可显著抑制肿瘤组织的血管生成, 这表明COX-2与肿瘤血管生成密切相关. COX-2主要在新生血管内皮细胞、巨噬细胞、成纤维细胞和肿瘤细胞自身表达, 在肿瘤新生血管生成过程中VEGF又起到了重要作用, 那么COX-2与VEGF的关系如何呢? 有资料证实, COX-2可使肿瘤中的VEGF表达上调, 抑制COX-2则可抑制VEGF的表达. Tsujii et al[14]将内皮细胞及表达COX-2的大肠癌细胞联合培养, 可诱导大肠癌细胞产生VEGF, 以旁分泌的形式作用于内皮细胞, 促进内皮细胞迁移及管样结构的形成, 这一过程可被COX-2选择性抑制剂及VEGF抗体抑制. 同时VEGF可诱导大肠癌细胞上调COX-2的表达, 从而形成一个正反馈网络, 协同刺激肿瘤血管生成. 我们用免疫组化法检测到肝脏转移瘤VEGF表达, HT-29组与HCT-116组比较表达增强(P<0.01), 而应用塞莱昔布处理后, 肝脏转移瘤VEGF蛋白表达减弱, 有显著统计学意义和(P<0.05); 塞莱昔布组与HCT-116组比较无显著性差异(P>0.05). 那么COX-2促进VEGF表达上调的途径是什么呢? 有文献表明[15], COX-2通过前列腺素途径促进VEGF的表达上调, 本研究表明COX-2与结肠癌肝转移瘤新生血管生成密切相关, 其高表达可能上调促血管生成因子VEGF的表达; COX-2的选择性抑制剂塞莱昔布对结肠癌肝转移瘤的血管生成有一定的抑制作用. 这提示COX-2在结肠癌肝转移过程中起重要作用, 使用COX-2选择性抑制剂可能是防治结肠癌肝转移的可行性途径之一. 同时本研究也为COX-2选择性抑制剂应用于结肠癌的预防和治疗提供了一定的实验依据.
电编: 张敏 编辑: 张海宁
| 1. | Tomozawa S, Tsuno NH, Sunami E, Hatano K, Kitayama J, Osada T, Saito S, Tsuruo T, Shibata Y, Nagawa H. Cyclooxy-genase-2 overexpression correlates with tumour recurrence, especially haematogenous metastasis, of colorectal cancer. Br J Cancer. 2000;83:324-328. [PubMed] [DOI] |
| 2. | Kakiuchi Y, Tsuji S, Tsujii M, Murata H, Kawai N, Yasumaru M, Kimura A, Komori M, Irie T, Miyoshi E. Cyclooxygenase-2 activity altered the cell-surface carbohydrate antigens on colon cancer cells and enhan-ced liver metastasis. Cancer Res. 2002;62:1567-1572. [PubMed] |
| 3. | DuBois RN, Radhika A, Reddy BS, Entingh AJ. Increased cyclooxygenase-2 levels in carcinogen-induced rat colonic tumors. Gastroenterology. 1996;110:1259-1262. [PubMed] [DOI] |
| 4. | Williams CS, Luongo C, Radhika A, Zhang T, Lamps LW, Nanney LB, Beauchamp RD, DuBois RN. Elevated cyclooxyge-nase-2 levels in Min mouse adenomas. Gastroenterology. 1996;111:1134-1140. [PubMed] [DOI] |
| 5. | Czembirek C, Eder-Czembirek C, Erovic BM, Turhani D, Selz-er E, Thurnher D. Inhibition of cytotoxicity of cisplatin by cy-clooxygenase-2 inhibitor nimesulide in head and neck cancer cell lines. Oncol Rep. 2005;14:1523-1526. [PubMed] |
| 6. | Backhus LM, Petasis NA, Uddin J, Schonthal AH, Bart RD, Lin Y, Starnes VA, Bremner RM. Dimethyl celecoxib as a novel non-cyclooxygenase 2 therapy in the treatment of non-small cell lung cancer. J Thorac Cardiovasc Surg. 2005;130:1406-1412. [PubMed] [DOI] |
| 7. | Hauser B, Froba G, Bracht H, Strater J, Chkhouta AB, Vassilev D, Schoaff MJ, Huber-Lang M, Bruckner UB, Radermacher P. Effects of intrarenal administration of the cox-2 inhibitor parecoxib during porcine suprarenal aortic cross-clamping. Shock. 2005;24:476-481. [PubMed] [DOI] |
| 8. | Takeuchi K, Tanaka A, Ohno R, Yokota A. Role of COX inhibi-tion in pathogenesis of NSAID-induced small intestinal da-mage. J Physiol Pharmacol. 2003;54:165-182. [PubMed] |
| 9. | Shattuck-Brandt RL, Varilek GW, Radhika A, Yang F, Wash-ington MK, DuBois RN. Cyclooxygenase 2 expression is incr-eased in the stroma of colon carcinomas from IL-10(-/-) mice. Gastroenterology. 2000;118:337-345. [PubMed] [DOI] |
| 10. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res. 2000;60:1306-1311. [PubMed] |
| 11. | Tsujii M, DuBois RN. Alterations in cellular adhesion and apoptosis in epithelial cells overexpressing prostaglandin endoperoxide synthase 2. Cell. 1995;83:493-501. [PubMed] [DOI] |
| 12. | Ragel BT, Jensen RL, Gillespie DL, Prescott SM, Couldwell WT. Ubiquitous expression of cyclooxygenase-2 in meningiomas and decrease in cell growth following in vitro treatment with the inhibitor celecoxib: potential therapeutic application. J Neurosurg. 2005;103:508-517. [PubMed] [DOI] |
| 13. | Smith WL, DeWitt DL, Garavito RM. Cyclooxygenases: struc-tural, cellular, and molecular biology. Annu Rev Biochem. 2000;69:145-182. [PubMed] [DOI] |
| 14. | Tsujii M, Kawano S, Tsuji S, Sawaoka H, Hori M, DuBois RN. Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell. 1998;93:705-716. [PubMed] [DOI] |
| 15. | Leahy KM, Ornberg RL, Wang Y, Zweifel BS, Koki AT, Masfe-rrer JL. Cyclooxygenase-2 inhibition by celecoxib reduces proliferation and induces apoptosis in angiogenic endothelial cells in vivo. Cancer Res. 2002;62:625-631. [PubMed] |