修回日期: 2005-08-15
接受日期: 2005-08-26
在线出版日期: 2005-11-15
目的: 检测人胃癌及相应癌旁组织中法尼基转移酶(FTase)β-亚单位mRNA表达和H-ras基因第12密码子点突变探讨FTaseβ-亚单位基因在胃癌中的表达与临床病理特点、H-ras基因突变的关系.
方法: 收集胃癌及相应癌旁正常组织标本43例. 应用半定量逆转录酶-聚合酶链反应(RT-PCR)测定FTase β-亚单位mRNA基因表达水平, 应用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)分析H-ras基因第12密码子点突变情况. 采用秩和检验分析胃癌和癌旁组织的FTase β亚单位mRNA 表达的配对数据的差异; 采用多元逐步回归分析胃癌组织中FTaseβ 亚单位mRNA 表达活性与临床病理特点及H-ras基因突变间的关系.
结果: 胃癌组织中FTase β亚单位mRNA的平均值明显高于癌旁组织(0.89±0.48 vs 0.69±0.40), 两者相比有显著性差异(Z = 2.469, P = 0.014). 在43例胃癌组织中有1例发现突变(1/43, 2.3%), 癌旁组织中未发现突变. 胃癌组织的FTase β亚单位mRNA 表达活性与年龄、肿瘤部位、组织学分级、有无淋巴结转移及有无H-ras基因突变无关, 在女性, 病理分型为印戒细胞癌的胃癌组织中有较高的FTase β亚单位mRNA 表达活性.
结论: FTase β亚单位mRNA在胃癌组织中表达升高. 胃癌组织中H-ras基因第12密码子点突变率低, 在胃癌的发生中不起主要作用, 并且与FTase β亚单位mRNA 的表达无相关.
引文著录: 顾华丽, 田字彬, 王其新. 胃癌组织中法尼基转移酶基因表达与临床病理特点及H-ras突变的关系. 世界华人消化杂志 2005; 13(21): 2565-2569
Revised: August 15, 2005
Accepted: August 26, 2005
Published online: November 15, 2005
AIM: To investigate the expression of farnesyltransferase(FTase) beta-subunit mRNA in gastric cancer tissues and its relations with the clinicopathological features and point mutation in codon 12 of H-ras gene.
METHODS: Specimens were collected from 43 cases of gastric cancer and their corresponding normal tissues. The expression of FTase beta-subunit mRNA was investigated by semi-quantitative reverse transcriptase-polymerase chain reaction (RT-PCR). The point mutation in codon 12 of H-ras gene was detected by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP). Wilcoxon Signed-Rank Test was used to analyze the difference of the matching data of FTase beta-subunit mRNA expression between gastric cancer and normal tissues. Multiple linear regression analysis was used to explore the relations of FTase activity with the clinicopathological features and H-ras mutation in gastric cancer.
RESULTS: The mean level of FTase beta-subunit mRNA expression were significantly higher in gastric cancer tissues than that in the corresponding normal ones(0.89 ± 0.48 vs 0.69 ± 0.40, Z = 2.469, P = 0.014). Of the 43 cases, the mutation of H-ras 12 codon was found in 1 case of cancer tissue(1/43, 2.3%), and no mutation appeared in the all the normal tissues. The expression of FTase beta-subunit mRNA was not related to the age, tumor location, histological differentiation, lymph node metastasis and H-ras 12 codon mutation. But the female patients with signetring cell carcinoma had higher expression of FTase beta-subunit mRNA.
CONCLUSION: The expression of FTase beta-subunit mRNA is up-regulated in gastric cancer. The point mutation in codon 12 of H-ras gene is not related to the expression of FTase beta-subunit mRNA.
- Citation: Gu HL, Tian ZB, Wang QX. Relations farnesyltransferase beta-subunit mRNA expression with clinicopathological features and H-ras mutation in gastric cancer tissues. Shijie Huaren Xiaohua Zazhi 2005; 13(21): 2565-2569
- URL: https://www.wjgnet.com/1009-3079/full/v13/i21/2565.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i21.2565
法尼基转移酶(Farnesyltransferase, FTase)是一种细胞溶质中的酶, 广泛存在于哺乳动物细胞、酵母及卵蛙细胞中, 催化一些细胞多肽翻译后修饰的第一步骤(法尼基化), 底物包括: Ras蛋白, 核纤层蛋白A, B(lamin A, lamin B), 视紫红质激酶(rhodopsin kinase), 磷酰化酶激酶, cGMP磷酸二酯酶的α亚单位和转导素(transducin)的γ亚单位等.FTase是由α和β亚单位组成的异二聚体, α亚单位识别法尼基焦磷酸(FPP), β亚单位结合至Ras蛋白[1,2]. 研究表明, 约30%的人类肿瘤有ras基因突变, 并有Ras蛋白高表达[3], 突变的Ras蛋白可刺激细胞增殖和抑制凋亡从而促使肿瘤发生、发展. Ras蛋白的生物活性与法尼基化修饰有密切关系. 因此, 法尼基转移酶已成为抗癌治疗的一个重要靶标和研究热点. 法尼基转移酶抑制剂正在肺癌、头颈部癌、结肠癌和胰腺癌等实体癌中进行Ⅰ, Ⅱ和Ⅲ期临床试验[4-10]. 近期的研究表明, FTase在多种肿瘤组织中活性增强, 提示FTase可能是肿瘤发生的标志物, 有望成为肿瘤诊断的一项指标[11-13]. 我们检测人胃癌和癌旁组织中法尼基转移酶β-亚单位mRNA表达水平和H-ras基因第12密码子点突变情况, 探讨法尼基转移酶β-亚单位基因在胃癌中的表达及其与临床病理特点、H-ras基因突变的关系, 了解其在胃癌诊断、判断预后的价值, 为法尼基转移酶抑制剂治疗胃癌提供理论依据.
胃癌和癌旁组织标本43例来源于2000-06/2001-06青岛大学医学院附属医院行胃大部切除并经病理证实的胃癌病人. 均于术中取新鲜胃癌组织和相应癌旁组织(距离癌组织5 cm以上), 放入经DEPC(焦碳酸二乙酯)水处理且高压灭菌的15 mL离心管中, -70℃冻存备用. 男35例, 女8例, 年龄31-81(56.9±14.0)岁. 病变部位: 胃窦部23例, 胃底/体部17例, 贲门部3例. 腺癌41例, 印戒细胞癌2例. 高分化1例, 中分化9例, 低分化33例. 临床分期均为进展期. 淋巴结转移32例, 无淋巴结转移11例. UICCⅠ期11例, Ⅱ期28例, Ⅲ期14例. PCR扩增仪480型(美国PE公司); 恒压恒流电泳仪、微型水平电泳槽(Bio-Rad公司); 高速低温台式离心机3K30型(德国Hereaus公司); 紫外投射仪(美国PE公司); 影像分析系统(北京亚力恩明胶分析系统2000); Reverse Transcription System(美国Promega公司); TRIzol D-Hanks液(美国GIBCO公司); 蛋白酶K(德国Merck公司); PCR引物及反应体系, 饱和酚, 氯仿, 异戊醇, Tris, EDTA, 硼酸和琼脂糖等(上海生工生物技术服务有限公司).
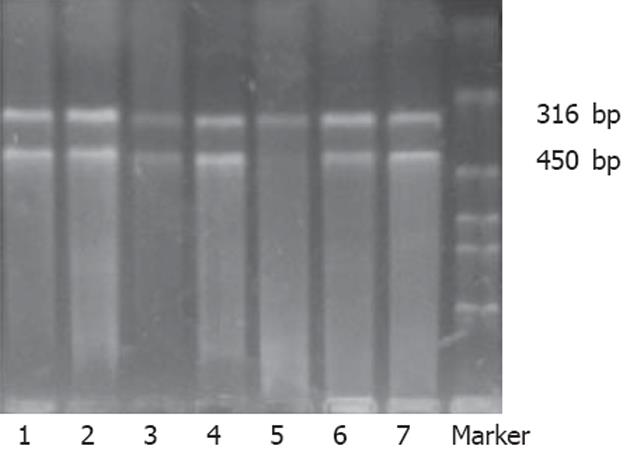
1.2.1 RT-PCR法检测FTase β亚单位mRNA的表达: TRIzol试剂提取组织总RNA, 每例取总RNA 2 μL用AMV反转录酶进行反转录, 反转录所得cDNA用作PCR反应的模板, 扩增FTase β亚单位基因和内参照基因GADPH基因. Ftase βsubunit mRNA基因引物参照文献[11]设计, 引物序列(316 bp): 5'-ATCCAGGCCACTACATACTTT-3'(正义), 5'-GGCTGATAGATTTTTGGTTTG-3'(反义); 内参照基因GADPH基因引物序列(450 bp): 5'-CTCAGACACCATGGGGAAGGTGA-3'(正义), 5'-ATGATCTTGAGGCTGTTGTCATA-3'(反义). 94℃预变性5 min, 然后94℃ 40 s, 56℃ 40 s, 72℃ 1 min扩增35个循环, 最后72℃延伸10 min. 扩增产物5 μL于含溴化乙锭(0.5 mg/L)的15 g/L琼脂糖凝胶中电泳, 紫外投射仪下观察结果并拍照, 以影像分析系统测定的表达比例(Ftase β subunit/GADPH) 进行半定量分析. 大于或等于正常平均值+2 s者确定为过度表达.
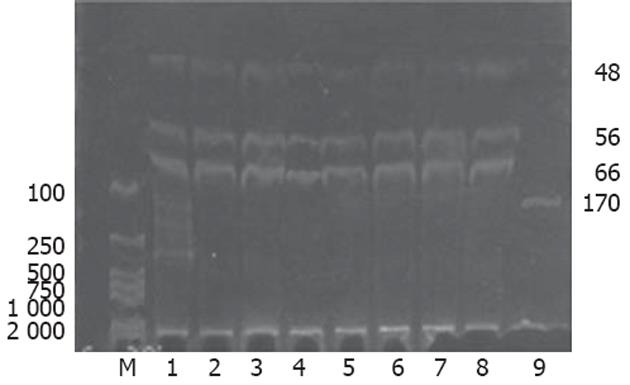
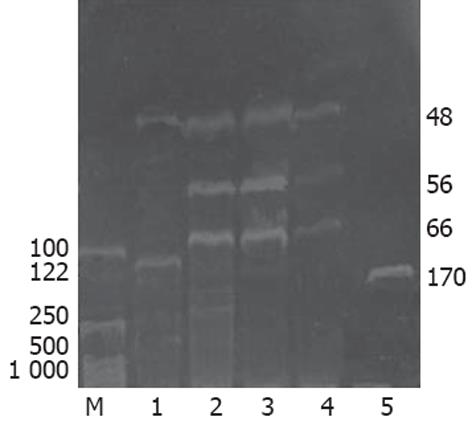
1.2.2 H-ras基因聚合酶链反应-限制性片段长度多态性(PCR-RFLP)分析: 依据制造商说明提取胃癌及癌旁组织的DNA, 每例取DNA模板1 μL进行PCR扩增H-ras基因第12密码子, 引物参照文献[14]设计, 引物序列(170 bp): 5'-CAGGGCCCTCCTTGGCAGG-3'(正义), 5'-GTCGTATTCGTCCACAAAATGG-3'(反义). 94℃预变性5 min, 然后94℃ 30 s, 60℃ 30 s, 72℃ 30 s 扩增35个循环, 最后72℃延伸5 min. 取PCR扩增产物5 μL于含溴化乙锭(0.5 mg/L)的15 g/L琼脂糖凝胶中电泳, 与PCR Marker对照, 紫外投射仪下出现170 bp条带表明扩增成功. 扩增产物用限制性内切酶HpaⅡ酶切, 酶切产物于80 g/L聚丙烯酰胺凝胶电泳, 对照PCR Marker判断扩增产物是否被切开, 野生型可观察到66+56+48 bp三条电泳带, 突变型只能观察到122+48 bp两条电泳带.
统计学处理 应用SPSS10.0 for Windows 软件进行统计学分析. 采用Wilcoxon 秩和检验分析胃癌和癌旁组织的FTase β亚单位mRNA表达的配对数据的差异, P<0.05为有显著性. 采用多元逐步回归分析胃癌组织的FTase β亚单位mRNA 表达活性与临床病理特点各参数、H-ras基因第12密码子点突变间的关系, 前者为应变量, 后者为自变量, P<0.05为有相关关系.
胃癌组织43例中FTase β亚单位mRNA测定的平均数为0.89±0.48, 四分位数间距为0.66-0.96; 癌旁组织中的平均数为0.69±0.40, 四分位数间距为0.56-0.89, 两者相比有显著性差异(Z = 2.469, P = 0.014, 图1). 胃癌组织中有3例过度表达, 癌旁组织中有1例过度表达, 两组过度表达比较无显著性差异(P = 0.069 8).
43对标本H-ras基因第12密码子PCR扩增均成功, 43例胃癌组织中有1例发现突变(1/43, 2.3%), 癌旁组织中未发现突变(图2, 3). 胃癌组织FTase β亚单位mRNA表达活性增高与性别、病理分型有关, 与年龄、肿瘤部位、组织学分级及有无H-ras基因突变无关, 发生在女性、病理分型为印戒细胞癌的胃癌组织有显著升高的FTase β亚单位mRNA表达(表1).
| 临床病理 | n | Ftaseβ亚单位mRNA | t | P |
| <50岁 | 14 | 0.94±0.39 | 0.356 | 0.754 |
| ≥50岁 | 29 | 0.82±0.38 | ||
| 男 | 35 | 0.81±0.28 | 2.566 | 0.014 |
| 女 | 8 | 1.26±0.91 | ||
| 高中分化 | 10 | 1.0±0.41 | 0.797 | 0.430 |
| 低分化 | 33 | 0.86±0.51 | ||
| 胃窦癌 | 23 | 0.96±0.62 | 0.531 | 0.592 |
| 胃底/体癌 | 17 | 0.82±0.28 | ||
| 贲门癌 | 3 | 0.75±0.10 | ||
| 淋巴结转移 | 0.259 | 0.797 | ||
| - | 11 | 0.92±0.49 | ||
| + | 32 | 0.88±0.49 | ||
| UICC | 0.284 | 0.755 | ||
| Ⅰ期 | 11 | 0.95±0.50 | ||
| Ⅱ期 | 28 | 0.92±0.63 | ||
| Ⅲ期 | 14 | 0.81±0.18 |
FTase属于蛋白异戊二烯转移酶超家族, 是细胞增殖所必需和潜在的生长调控者[12]. 目前法尼基转移酶已成为抗癌治疗的一个重要靶标和研究热点. 因此法尼基转移酶已成为抗癌治疗的一个重要靶标和研究热点. 法尼基转移酶抑制剂在肺癌、头颈部癌、结肠癌和胰腺癌等实体癌中正在进行Ⅰ, Ⅱ和Ⅲ期临床试验[4-10]. Khan et al[11]观察到与正常组织比较, 人皮肤基底细胞癌中法尼基转移酶mRNA表达增加; Nagase et al[12]发现人卵巢癌中法尼基转移酶β亚单位mRNA表达过度并与K-ras突变有关; Caruso et al[13]发现人结直肠癌中法尼基转移酶活性高于正常黏膜, 且与K-ras突变有关, 其β亚单位蛋白水平也较正常组织明显增高, 但β亚单位mRNA水平无差异. 以上研究表明, FTase在多种肿瘤组织中活性增强, 提示FTase活性可能是肿瘤发生的标志物, 有望成为肿瘤诊断的一项指标. 我们的结果显示, 胃癌组织中FTase β亚单位mRNA的表达明显高于癌旁组织, 两者相比有显著性差异(Z = 2.469, P = 0.014). FTase活性可能是胃癌发生的标志物.
研究表明, 约30%的人类肿瘤有ras基因突变, 并有Ras蛋白高表达, 突变的Ras蛋白可刺激细胞增殖和抑制凋亡从而促使肿瘤发生、发展. 因此Ras蛋白可作为抗肿瘤治疗的靶点. 业已证明, ras基因群第12、13、61位密码子点突变可使其获得转化细胞的能力, ras基因单点突变足以引发恶性转化. ras基因突变率在不同人类肿瘤有明显不同, 国外文献报道, 最高为胰外分泌腺癌, 达90%, 结肠癌为40%-50%, 肺癌和膀胱癌为40%[3,15], 而胃癌较低在10%以下. 但后者各家报道并不一致, 日本学者报告胃癌主要是K-ras基因点突变, Kihana et al[16]发现43%的胃腺瘤、95%的胃腺癌有K-ras基因点突变, 无H-ras突变; 南朝鲜人群中亦无H-ras突变; 对欧洲胃癌高发区人群研究未发现ras突变[17,18]; Deng et al[19]报道我国胃癌主要为H-ras基因点突变, 达41%. 此后国内多家学者报道胃癌中H-ras基因点突变率为13.6%-33.3%, K-ras基因点突变率为0-4.8%, 与邓国仁的结果相似, 并推测H-ras基因第12密码子点突变是中国人胃癌的特点之一[20,21]. 我们对标本H-ras基因第12密码子PCR扩增均成功, 43例胃癌组织中有1例发现突变(1/43, 2.3%), 癌旁组织中未发现突变. 此结果与国内相关报道并不一致, 原因可能为胃癌的发生发展受诸如饮食、地理环境、种族差异等多因素的影响, 文献报道也证实某些胃癌相关基因(如ras)在不同地域、种族的表达确有差异, 所以虽同为中国人, 因所处地域不同, 饮食习惯差异, 因而H-ras基因的第12位密码子点突变率可以有很大差异.
我们的结果显示, 胃癌组织的FTase β亚单位mRNA 表达活性在女性、病理分型为印戒细胞癌的胃癌组织有显著升高, 与年龄、肿瘤部位、组织学分级、有无淋巴结转移及有无H-ras基因突变无关. 由于女性标本、印戒细胞癌的例数较少, 目前尚难定论女性或印戒细胞癌的胃癌病人FTase表达增高. 理论上, FTase是Ras蛋白在合成后加工修饰的关键酶, 通过它的作用Ras蛋白才可定位于细胞膜内侧, 才可发挥其在调控细胞的增殖、分裂与分化的作用, FTase活性的增高可能是源于ras基因的突变、Ras蛋白的高表达, 这一理论假说在近期的研究[12,13]中得到了证实. 本实验中FTase β亚单位mRNA的表达增高与H-ras基因的第12位密码子点突变无相关, 此结果的出现可能有以下原因: (1)哺乳动物的ras基因家族有3个成员, 分别是H-ras, K-ras, N-ras, 基因突变的最常见的方式就是点突变, 多发生在N端第12, 13和61密码子, 其中又以第12密码子突变最常见. 我们只检测了H-ras的第12位密码子点突变情况, 可能存在此基因其它位点或其他两型基因的不同位点的突变, 而导致Ras蛋白的高表达从而引起FTase β亚单位mRNA 的表达增高; (2)Ras蛋白只是FTase催化底物之一, 是否存在其他生物学因子调节胃癌组织中FTase表达还有待于进一步研究.
电编: 李琪 编辑: 潘伯荣 审读: 张海宁
| 1. | Clarke S. Protein isoprenylation and methylation at carboxyl-terminal cysteine residues. Annu Rev Biochem. 1992;61:355-386. [PubMed] [DOI] |
| 2. | Reiss Y, Seabra MC, Armstrong SA, Slaughter CA, Goldstein JL, Brown MS. Nonidentical subunits of p21H-ras farnesyltransferase. Peptide binding and farnesyl pyrophosphate carrier functions. J Biol Chem. 1991;266:10672-10677. [PubMed] |
| 3. | Lebowitz PF, Prendergast GC. Non-Ras targets of farnesyltransferase inhibitors: focus on Rho. Oncogene. 1998;17:1439-1445. [PubMed] [DOI] |
| 4. | Vogt A, Qian Y, Blaskovich MA, Fossum RD, Hamilton AD, Sebti SM. A non-peptide mimetic of Ras-CAAX: selective inhibition of farnesyltransferase and Ras processing. J Biol Chem. 1995;270:660-664. [PubMed] [DOI] |
| 5. | Wright J, Blatner GL, Cheson BD. Clinical trials referral resource. Clinical trials with the farnesyl transferase inhibitor R115777. Oncology (Williston Park). 1999;13:1527, 1530, 1533. [PubMed] |
| 6. | Adjei AA, Erlichman C, Davis JN, Cutler DL, Sloan JA, Marks RS, Hanson LJ, Svingen PA, Atherton P, Bishop WR. A Phase I trial of the farnesyl transferase inhibitor SCH66336: evidence for biological and clinical activity. Cancer Res. 2000;60:1871-1877. [PubMed] |
| 7. | Van Cutsem E, van de Velde H, Karasek P, Oettle H, Vervenne WL, Szawlowski A, Schoffski P, Post S, Verslype C, Neumann H. Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer. J Clin Oncol. 2004;22:1430-1438. [PubMed] [DOI] |
| 8. | Izbicka E, Campos D, Carrizales G, Patnaik A. Biomarkers of anticancer activity of R115777 (Tipifarnib, Zarnestra) in human breast cancer models in vitro. Anticancer Res. 2005;25:3215-3223. [PubMed] |
| 9. | Morrow PK, Kim ES. New biological agents in the treatment of advanced non-small cell lung cancer. Semin Respir Crit Care Med. 2005;26:323-332. [PubMed] [DOI] |
| 10. | Kim ES, Kies MS, Fossella FV, Glisson BS, Zaknoen S, Statkevich P, Munden RF, Summey C, Pisters KM, Papadimitrakopoulou V. Phase II study of the farnesyltransferase inhibitor lonafarnib with paclitaxel in patients with taxane-refractory/resistant nonsmall cell lung carcinoma. Cancer. 2005;104:561-569. [PubMed] [DOI] |
| 11. | Khan SG, Dummer R, Siddiqui J, Bickers DR, Agarwal R, Mukhtar H. Farnesyltransferase activity and mRNA expression in human skin basal cell carcinomas. Biochem Biophys Res Commun. 1996;220:795-801. [PubMed] [DOI] |
| 12. | Nagase T, Kawata S, Nakajima H, Tamura S, Yamasaki E, Fukui K, Yamamoto K, Miyagawa J, Matsumura I, Matsuda Y. Effect of farnesyltransferase overexpression on cell growth and transformation. Int J Cancer. 1999;80:126-133. [PubMed] [DOI] |
| 13. | Caruso MG, Notarnicola M, Bifulco M, Laezza C, Guerra V, Altomare DF, Memeo V, Lorusso D, Demma I, Di Leo A. Increased farnesyltransferase activity in human colorectal cancer: relationship with clinicopathological features and K-ras mutation. Scand J Gastroenterol. 2003;38:80-85. [PubMed] [DOI] |
| 15. | Grunewald K, Lyons J, Frohlich A, Feichtinger H, Weger RA, Schwab G, Janssen JW, Bartram CR. High frequency of Ki-ras codon 12 mutations in pancreatic adenocarcinomas. Int J Cancer. 1989;43:1037-1041. [PubMed] [DOI] |
| 16. | Kihana T, Tsuda H, Hirota T, Shimosato Y, Sakamoto H, Terada M, Hirohashi S. Point mutation of c-Ki-ras oncogene in gastric adenoma and adenocarcinoma with tubular differentiation. Jpn J Cancer Res. 1991;82:308-314. [PubMed] [DOI] |
| 17. | Koshiba M, Ogawa O, Habuchi T, Hamazaki S, Shimada T, Takahashi R, Sugiyama T. Infrequent ras mutation in human stomach cancers. Jpn J Cancer Res. 1993;84:163-167. [PubMed] [DOI] |
| 18. | Victor T, Du Toit R, Jordaan AM, Bester AJ, van Helden PD. No evidence for point mutations in codons 12, 13, and 61 of the ras gene in a high-incidence area for esophageal and gastric cancers. Cancer Res. 1990;50:4911-4914. [PubMed] |
| 19. | Deng GR, Liu XH, Wang JR. Correlation of mutations of oncogene C-Ha-ras at codon 12 with metastasis and survival of gastric cancer patients. Oncogene Res. 1991;6:33-38. [PubMed] |