修回日期: 2005-05-01
接受日期: 2005-06-01
在线出版日期: 2005-10-28
目的: 用PCA方法选择HBV DNA多聚酶TP区VH抗体.
方法: 从Yeast Display scFv Antibody Library中提取包含scFv抗体库的质粒pPNL6, 扩增VH抗体片段. 以HepG2.2.15细胞分泌的HBV DNA为模板, PCR扩增HBV DNA末端蛋白(TP). 以TP区作为抗原, 用PCA方法进行VH抗体选择.
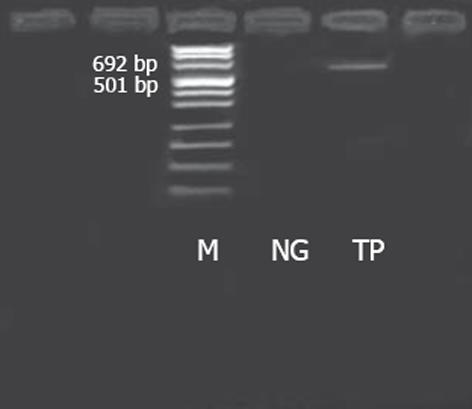
结果: PCR扩增的TP区共540 bp. 对HBV DNA多聚酶TP区进行抗体选择, 用PCA方法从抗体库中选择出3个对应抗体, 根据DNA序列和Werner Müller数据库可标明3个抗体.
结论: 对HBV DNA多聚酶TP区进行抗体选择, 用PCA方法可以从抗体库中较为简便的选择出对应抗体.
引文著录: 于俊岩, 兰林, 王宇明. 用PCA方法选择HBV DNA多聚酶TP区VH抗体. 世界华人消化杂志 2005; 13(20): 2427-2430
Revised: May 1, 2005
Accepted: June 1, 2005
Published online: October 28, 2005
AIM: To isolate the variable fragments of heavy chain (VH) against the terminal protein (TP) region of hepatitis B virus (HBV) polymerase (Pol) with protein fragment complementation assay (PCA).
METHODS: The plasmid pPNL6, which contained scFv antibody library, was extracted from Yeast Display scFv Antibody Library to amplify the VH antibody fragment. The HBV DNA secreted by HepG2.2.15 cells was used as the template to amplify HBV DNA TP. Then the VH antibodies were selected with PCA using the TP region as the antigen.
RESULTS: After amplification, TP region with a length of 540 bp were obtained. Three TP antigen-specific VH antibodies were amplified by PCA, and then they were translated into amino acids according to the DNA sequences and Werner Müller databank.
CONCLUSION: TP region antigen-specific VH antibodies can be directly selected from HBV DNA Pol with PCA.
- Citation: Yu JY, Lan L, Wang YM. Isolation of the variable fragments of heavy chain against the terminal protein region of hepatitis B virus polymerase with protein fragment complementation assay. Shijie Huaren Xiaohua Zazhi 2005; 13(20): 2427-2430
- URL: https://www.wjgnet.com/1009-3079/full/v13/i20/2427.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i20.2427
PCA方法的原理[1]是大肠杆菌中的二氢叶酸还原酶(DHFR)可以特异地被甲氧苄氨嘧啶(TMP)所抑制, 从而阻止嘌呤、胸苷酸、蛋氨酸、泛酸盐的生物合成, 导致细菌裂解. 而鼠的二氢叶酸还原酶(mDHFR)对低浓度的TMP并不敏感, 如果细菌中存在mDHFR就可以恢复以上物质的生物合成, 细菌得以存活. 在PCA方法中, mDHFR基因被分割成两部分: mDHFR(1)和mDHFR(2), 分别与抗原和抗体基因相连. 当编码mDHFR的两个载体被共转化进细菌时, 如果特异性抗原、抗体相互识别, 那么分别与他们相连的mDHFR(1)和mDHFR(2)就会接触而恢复完整的mDHFR酶活性, 细菌得以存活. 抗原或抗体与mDHFR之间的Linker[(Gly4Ser)n]可长可短, 不同的抗原/抗体需要不同的长度, 但是较长的Linker可能产生较高的结合率.
Yeast Display scFv Antibody Library(抗体库)(http: //http://www.biomolecular.org/resources/index.html)由Michael Feldhaus赠送, 抗体载体pBluescript/SK(+)-mDHFR(1)及抗原载体pBluescript/SK(+)-mDHFR(2)由Stephen W. Michnick(加拿大蒙特利尔大学Stephen Michnick实验室: http: //michnick.bcm.umontreal.ca/index_en.php)赠送, 限制性内切酶均购自新英格兰公司, BD In-FusionTM PCR Cloning Kit购自BD Biosciences Clontech, BL21(DE3)pLysS购自Promega, HepG2.2.15细胞由第三军医大学西南医院感染病研究所引进并保存. 引物及测序由上海生物工程公司完成. HepG2.2.15细胞在含10 mL/L胎牛血清的RPMI 1640培养基中(含青霉素100 kU/L, 链霉素100 kU/L), 37℃, 50 mL/L CO2的孵箱中用24孔培养板培养. 收集细胞培养液, 加入PEG8000至终浓度为100 g/L, 冰浴放置4 h, 12 000 g离心30 min, 将沉淀溶解于原培养液体积10 g/L的TNE缓冲液中(10 mmol/L Tris-HCl, pH 7.5; 100 mmol/L NaCl; 1 mmol/L EDTA). 加入SDS至终浓度为10 g/L, 蛋白酶K至终浓度为1 g/L, 50℃孵育2 h. 经酚-氯仿抽提, 乙醇沉淀, 将DNA溶解于TE缓冲液中(10 mmol/L Tris-HCl, pH 8.0; 1 mmol/L EDTA). 作为PCR扩增HBV DNA末端蛋白的模板.
1.2.1 建立抗体库: 从Yeast Display scFv Antibody Library中提取包含scFv抗体库的质粒pPNL6, 扩增VH抗体片段, 正义引物: 5'-ACCGCGGTGGCGGCCGCATGGGTGGTGGTGGTTCTGCTAGC-3',反义引物: 5'-GCCACCAGAGCGGCCGCCACCGGATCCTAGAATTCC-3'. PCR反应体系: MgCl2 2.0 mmol/L, dNTP 0.2 mmol/L, pfu酶6 U, 引物1 μmol/L, 总体积50 μL. PCR反应条件: 95℃ 5 min, 95℃ 30 s, 58℃ 45 s, 75℃ 45 s, 循环35次, 75℃ 10 min. PCR反应产物做琼脂糖凝胶纯化.
1.2.2 建立TP区抗原载体: 以HepG2.2.15细胞分泌的HBV DNA为模板, PCR扩增HBV DNA末端蛋白(terminal protein, TP), 正义引物: 5'-ACCGCGGTGGCGGCCGCGACCACCAAATGCCCCTATC-3',反义引物: 5'-ACCACCGCCACCAGAACCCTTGTTCCCAAGAATATGGTGAC-3', PCR反应体系: MgCl2 2.0 mmol/L, dNTP 0.2 mmol/L, pfu酶6 U, 引物1 μmol/L, 总体积50 μL. PCR反应条件: 95℃ 5 min, 95℃ 45 s, 55℃ 1 min, 75℃ 1 min, 循环35次, 75℃ 10 min. PCR扩增LinkerⅠ, 模板即为引物, 正义引物: 5'-GGTTCTGGTGGCGGTGGTTCTGGTGGTGGCGGTTCTGGTGGCGGCGGCTCC-3', 反义引物: 5'-CTACTTTACTTCCGGAAGAACCACCACCGCCAGAACCACCGCCACCAGAGCCACCACCACCGGAGCCGCCGCCACC-3', PCR反应体系: MgCl 2.0 mmol/L, dNTP 0.2 mmol/L, pfu酶6 U, 引物1 μmol/L, 总体积50 μL. PCR反应条件: 95℃ 5 min, 95℃ 45 s, 65℃ 1 min, 75℃ 1.5 min, 循环35次, 75℃ 10 min. 以TP区、LinkerⅠ为模板, 用TP区正义引物和LinkerⅠ反义引物以PCR扩增TP-LinkerⅠ. PCR反应体系: MgCl2 2.0 mmol/L, dNTP 0.2 mmol/L, pfu酶6 U, 引物1 μmol/L, 总体积50 μL. PCR反应条件: 95℃ 5 min, 95℃ 45 s, 55℃ 1 min, 75℃ 1 min, 循环35次, 75℃ 10 min. PCR反应产物做琼脂糖凝胶纯化. 用BD In-FusionTM PCR Cloning Kit做连接反应(具体按试剂盒手册进行操作), 把TP-LinkerⅠ插入抗原载体pBluescript/SK(+)-mDHFR(2), 即pBluescript/SK(+)-TP-LinkerⅠ-mDHFR(2).
1.2.3 建立抗体载体: PCR扩增LinkerⅡ, 模板即为引物, 正义引物: 5'-ACCGCGGTGGCGGCCGCTCTGGTGGCGGCGGCTCC-3', 反义引物: 5'-GTCGAACCATTCCGGAAGAACCACCACCGCCAGAACCACCGCCACCAGAGCCACCACCACCGGAGCCGCCGCCACC-3', PCR反应体系: MgCl2 2.0 mmol/L, dNTP 0.2 mmol/L, pfu酶6 U, 引物1 μmol/L, 总体积50 μL. PCR反应条件: 95℃ 5 min, 95℃ 45 s, 65℃ 1 min, 75℃ 1.5 min, 循环35次, 75℃ 10 min. 用BD In-FusionTM PCR Cloning Kit做连接反应, 把LinkerⅡ插入抗体载体pBluescript/SK(+)-mDHFR(1), 即pBluescript/SK(+)-LinkerⅡ-mDHFR(1). 再用BD In-FusionTM PCR Cloning Kit做连接反应, 把抗体VH插入载体pBluescript/SK(+)-LinkerⅡ-mDHFR(1), 即pBluescript/SK(+)-VH-LinkerⅡ-mDHF(1).
1.2.4 选择抗体: 用化学法把抗原载体pBluescript/SK(+)-TP-LinkerⅠ-mDHFR(2)转化入大肠杆菌菌株BL21(DE3)pLysS, 即BL21(DE3)pBluescript/SK(+)-TP-LinkerI-mDHFR(2), 用电击转化法把抗体载体pBluescript/SK(+)-VH-LinkerⅡ-mDHFR(1)转化入感受态细胞BL21(DE3)pBluescript/SK(+)-TP-LinkerⅠ-mDHFR(2). 转化条件: Cuvette Gap: 0.1 cm; Voltage: 1.5 kV; Field Strength: 15 kV/cm; Capacitor: 25 uf; Resistor: 200 Ω; Time Constant: 4.0 ms. 共转化20次以完成抗体库的转化. 用PCA方法进行阳性克隆选择: M9选择培养基的制备, 标准M9培养基中含100 mg/L Ampicillin, 1 mmol/L IPTG, 10 mg/L TMP. 把电击转化的细胞转入SOC培养基孵育30 min后, PBS洗涤2次, 以彻底清除SOC培养基. 铺板于M9选择培养基上进行30℃ 24-72 h培养, 存活细菌即为阳性克隆. 对存活细菌进行PCR扩增VH片段, 并对PCR产物进行测序.
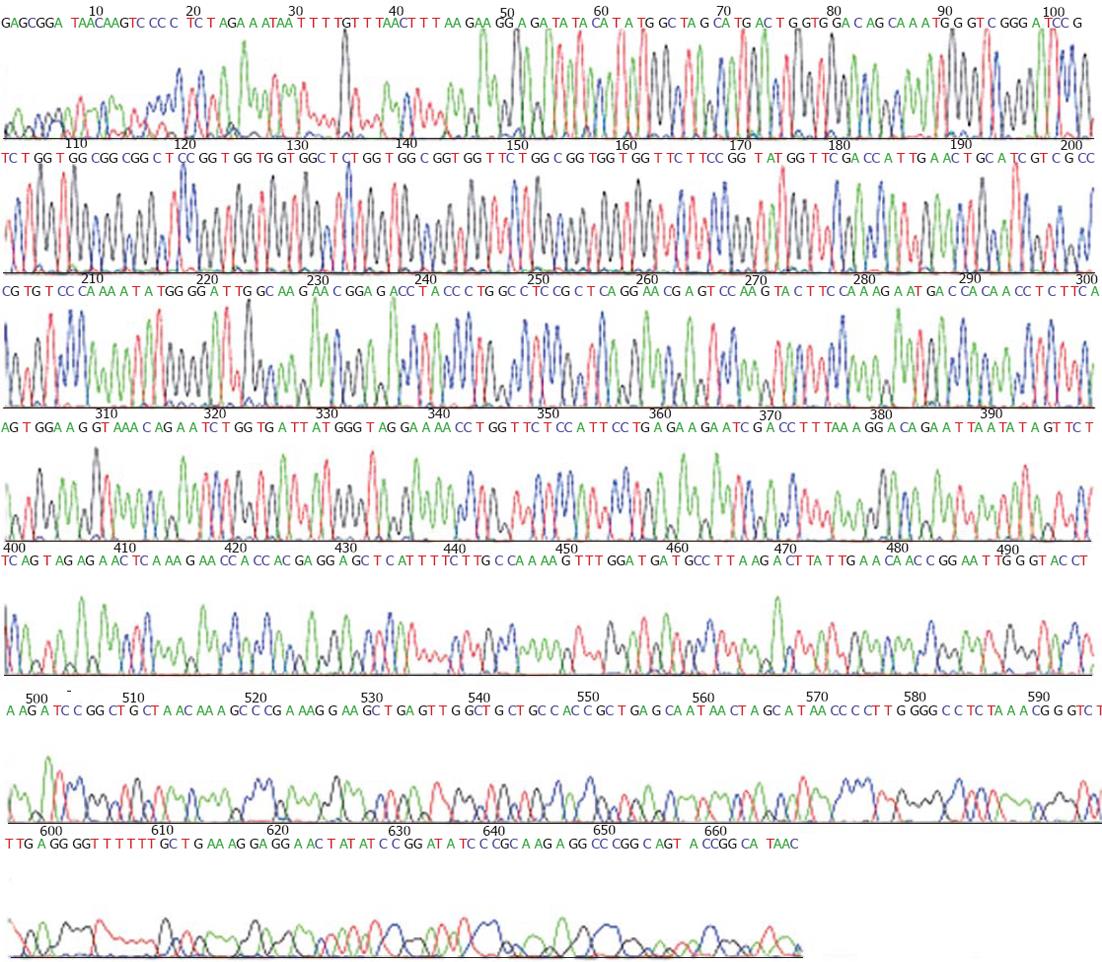
HepG2.2.15细胞培养见图1. 以HepG2.2.15细胞分泌的HBV DNA为模板, PCR扩增TP区, 共540 bp(图2). 测序结果见图3. 用TP区正义引物和LinkerⅠ反义引物以PCR扩增TP-LinkerⅠ, 其中LinkerⅠ长96 bp. PCR扩增与抗体相连的LinkerⅡ, 长63 bp. 在抗体库中共选择出3个TP区相关抗体, 根据DNA序列和Werner Müller数据库(http: //http://www.dnaplot.de/input/human-v.html)标明了3个抗体(图4).
HBV共有4个开放阅读框架(open reading frame, ORF), 编码至少7个病毒蛋白, 其中HBV DNA多聚酶(DNA polymerse, Pol)在病毒复制周期中起着核心作用. 它分为4个功能区, 从氨基端起依次是: 末端蛋白区(1-178 aa)、空隔区(179-336 aa)、逆转录区(337-680 aa)和RNase H区(681-832 aa). HBV多聚酶是一个多功能酶[3], 在病毒的复制周期中发挥着关键作用. 末端蛋白(TP)作为HBV多聚酶的组成部分, 具有多种功能, 主要是由前基因组RNA反转录负链DNA时作为引物; HBV多聚酶虽然在细胞质中合成, 其全部或其裂解形成的TP区可移行至细胞核内, 以完成反转录中的功能. Pol上共有4个抗原表位, 分别位于TP区8-20 aa和20-30 aa、空隔区的225-250 aa和RNase H区的800-832 aa. Putlitz et al[2](1999)报道: 抗TP区的单抗对病毒的前基因组RNA逆转录的作用最强. 因此, Pol的TP区是一个很好的抗原表位, 中和其功能, 将会干扰病毒的复制.
细胞内抗体通常指的是scFv(single chain variable fragments, scFv), 但scFv几乎不能在细胞内发挥作用. 因为scFv在细胞内质网成熟, 而细胞内的还原环境使scFv不能形成二硫键, 这对抗体的正确折叠至关重要, 从而影响scFv的可溶性与稳定性. 而VH抗体不存在这样的缺陷[3], VH抗体不需要链内二硫键也同样具有活性. VH抗体可在原核细胞或真核细胞内表达, 已证明它们有很强的中和抗原的作用[4], 如在抗肿瘤蛋白RAS的三种抗体中: scFv、VH和VL(轻链可变区抗体), VH的活性是scFv的五倍, 而VL实验证明无活性. 还有一点, 在选择特异性抗体中, VH抗体库的多样性要比scFv抗体库的多样性小的多.
从抗体库中选择有效抗体目前有很多方法, 如噬菌体展示技术, 核糖体展示技术, 酵母双杂交技术等[5]. 这些方法各有利弊, 但从我们的实验中可以看出PCA方法在抗体选择中显示出很多优点. 比如作为与抗体结合的抗原不需要表达与纯化, 只需要抗原的基因, 这大大减少了实验难度; 由于抗原抗体的结合是在细胞内自然环境下发生, 所以选择出的抗体特异性最强; 整个实验工作量不大、费时少, 少有假阳性, 在任何实验室都可以开展.
用PCA方法选择出的抗体与抗原的亲和性有待进一步鉴定. 选择出的抗体对HBV DNA复制的抑制作用, 我们将在后续论文中发表.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 1. | Pelletier JN, Arndt KM, Pluckthun A, Michnick SW. An in vivo library-versus-library selection of optimized protein-protein interactions. Nat Biotechnol. 1999;17:683-690. [PubMed] [DOI] |
| 2. | zu Putlitz J, Lanford RE, Carlson RI, Notvall L, de la Monte SM, Wands JR. Properties of monoclonal antibodies directed against hepatitis B virus polymerase protein. J Virol. 1999;73:4188-4196. [PubMed] |
| 3. | Holt LJ, Herring C, Jespers LS, Woolven BP, Tomlinson IM. Domain antibodies: proteins for therapy. Trends Biotechnol. 2003;21:484-490. [PubMed] [DOI] |
| 4. | Bird RE, Hardman KD, Jacobson JW, Johnson S, Kaufman BM, Lee SM, Lee T, Pope SH, Riordan GS, Whitlow M. Single-chain antigen-binding proteins. Science. 1988;242:423-426. [PubMed] [DOI] |
| 5. | Mossner E, Koch H, Pluckthun A. Fast selection of antibodies without antigen purification: adaptation of the protein fragment complementation assay to select antigen-antibody pairs. J Mol Biol. 2001;308:115-122. [PubMed] [DOI] |