修回日期: 2004-11-28
接受日期: 2004-12-08
在线出版日期: 2005-01-15
目的: 调查HCV肝炎、肝硬化组织核心蛋白、突变P53、Mdm2、P21waf1的表达以及他们间的相关性, 探讨HCV核心蛋白对突变P53、Mdm2、P21waf1的表达作用及意义.
方法: 收集HCV表达阳性的肝炎、肝硬化组织23例, 采用免疫组织化学EnVision法检测HCV感染的肝炎、肝硬化组织中核心蛋白、突变P53、Mdm2、P21waf1的表达, 用统计学方法及临床联系分析他们之间的关系.
结果: 核心蛋白、突变P53、Mdm2、P21waf1的阳性表达主要定位于细胞核中; 核心蛋白阳性表达的组织中突变P53、Mdm2、P21waf1阳性率分别为87%、91.3%、13.0%; 四组间的Kruskal-Wallis检验P = 0.000, 差异有显著性意义, 核心蛋白与P53、P21waf1间的Mann-Whitney U秩和检验P值分别为0.041、0.000; HCV-c蛋白与突变P53、Mdm2、P21waf1阳性强度二者间相关性Pearson检验P值分别为0.011、0.067、0.2, 相关系数rp分别为0.71、0.493、0.45.
结论: HCV核心蛋白可能促进P53突变, 同时间接促进Mdm2并共同抑制了P21waf1表达; 核心蛋白、突变P53、Mdm2的共同作用可促进肝细胞增生、非典型性增生.
引文著录: 黄立军, 邓南生, 王小平, 张志培. HCV核心蛋白、P53、Mdm2、P21waf1在HCV肝炎、肝硬化中的表达及意义. 世界华人消化杂志 2005; 13(2): 261-264
Revised: November 28, 2004
Accepted: December 8, 2004
Published online: January 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 261-264
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/261.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.261
丙肝病毒(HCV)可引起无症状携带至慢性肝炎、肝硬化、肝癌等一些列疾病, 极大部分HCV感染患者难以康复, 导致慢性肝炎, 有些国家HCV感染已被确定为导致肝细胞癌(HCC)的主要原因[1]. 大部分感染HCV患者的血清、肝组织中, 甚至有些肝癌组织中能检出HCV RNA; 慢性HCV感染还能引起自身免疫综合征、免疫复合物病. 不幸的是HCV介导疾病发展的许多重要问题仍不清楚. 核心蛋白对细胞生长的调节起着重要得作用, 如参与细胞蛋白的相互作用、参于细胞信号传导、致癌和脂质代谢. 核心蛋白对P53/P21waf1有调节作用, 有人认为核心蛋白促进野生P53的转录和表达, 上调P21waf1的表达[2-4], 而有的报道则认为核心蛋白抑制野生P53的转录, 下调P21waf1的表达[5]. 因此我们收集了HCV核心蛋白表达阳性的肝炎肝硬化组织石蜡块, 通过免疫组织化学方法检测核心蛋白、P53、Mdm2和P21waf1蛋白的表达, 探讨HCV核心蛋白与P53、Mdm2和P21waf1表达之间的关系及意义, 为研究HCV导致慢性肝炎、肝细胞转化及恶变的分子机制提供临床依据.
收集1998-2003西京医院外周血检验HCV阳性患者的经手术切除或活检肝脏标本23例(19例肝炎后肝硬化, 4例慢性肝炎), 其中男18例, 女5例, 年龄25-65岁(平均年龄47.22×11.67岁), 所有标本均用10 g/L甲醛固定、脱水, 常规石蜡包埋. HCV核心蛋白抗体购自博士德生物工程商品化的产品; P53、Mdm2抗体购自Santa Crus生物技术公司; P21waf1抗体购自迈新公司; EnVisionTM免疫组化试剂盒购自西安基因公司.
收集的标本经5 μm连续切片, 60 ℃过夜, 分别做HE和免疫组化染色. 免疫组化染色采用两步法(EnVisionTM), 核心蛋白抗体用1:50稀释, P53和P21waf1抗体用1:100稀释. 具体步骤如下: 切片脱蜡至水, PBS洗涤; 用尿素消化30 min, PBS洗涤; 30 g/L过氧化氢封闭30 min以灭活内源性过氧化物酶, PBS洗; 然后用柠檬酸缓冲液进行微波修复抗原, 自然冷却, PBS洗; 羊血清封闭15 min, 擦干周围液体加一抗4 ℃过夜; 从冰箱取出37 ℃复温30 min, 用自来水冲洗抗体, PBS洗涤; 加入抗鼠或抗兔的二抗(EnVisionTM), 37 ℃恒温反应50 min; 加DAB显色, 在显微镜观察终止显色. 用苏木精轻微复染, 脱水透明封片, 光镜下观察. 对照组设阳性、阴性、和空白对照: 用已知阳性表达组织作为阳性对照; 正常肝组织作核心蛋白的阴性对照; 以PBS代替一抗作为空白对照.
1.2.1 阳性判断: HCV核心蛋白、P53、Mdm2和P21waf1的阳性表达主要在核、核膜上, 核心蛋白偶见于胞质中表达; 每例均随机观察5个高倍视野(×400), 进行半定量积分判断结果: 阳性细胞≤5%为 0分, 6-25%为1分, 26-50%为2分, 51-75%为3分, >75为4分; 阳性强度黄色为1分, 棕黄为2分, 棕褐色为3分. 将细胞阳性率与染色强度二者积分相乘: 0分为阴性(-), 1-4分为弱阳性(+), 5-8分为中度阳性(++), 9-12分为强阳性(+++). 采用SPSS 10.0软件进行统计学处理, 四组间采用多组等级资料Kruskal-Wallis秩和检验, 二组间采用二组等级资料Mann-Whitney U秩和检验, HCV核心蛋白与P53、Mdm2、P21waf1蛋白表达的两相关性用双向有序R碈表χ2检验, 以Pearson积矩相关系数来计算相关系数rp.
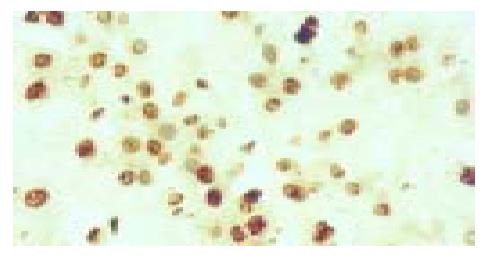
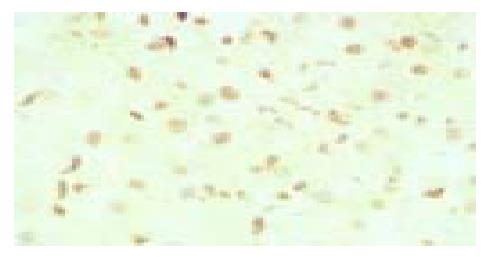
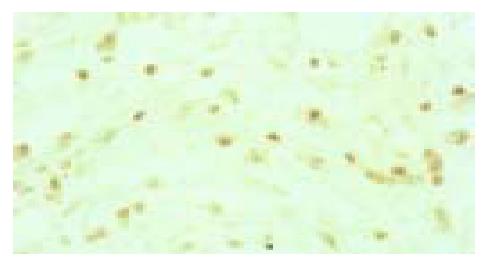
所有组织的HCV核心蛋白都呈阳性表达, 这些组织主要表现为结节性肝硬化, 有的仍有慢性活动性肝炎表现, 有非典型性肝细胞增生、非典型胆管样细胞增生的表现; 核心蛋白、P53、Mdm2和P21waf1的阳性表达主要定位于细胞核中(图1, 图2, 图3, 图4). P53、Mdm2的阳性表达率分别为87%(20/23)、91.3%(22/23), 而P21的阳性率只有13%(3/23), 四组间的阳性强度等级资料Kruskal-Wallis秩和检验H = 44.08, P = 0.000, 有显著差异; HCV核心蛋白与P53、P21waf1各两组间Mann-Whitney秩和检验P值分别为P = 0.041、P = 0.000(表1); HCV核心蛋白与P53、Mdm2和P21waf1阳性强度相关性Pearson检验χ2值分别为16.51、8.79、5.95, P值分别为0.011、0.067、0.2, 相关系数rp分别为0.71、0.493、0.45(表2, 表3, 表4).
| group | n | 阳性强度 | 阳性率(%) | |||
| - | + | ++ | +++ | |||
| HCV-C | 23 | 0 | 10 | 8 | 5 | 100 |
| P53 | 23 | 3 | 12 | 7 | 1 | 87.0 |
| Mdm2 | 23 | 2 | 17 | 4 | 0 | 91.3 |
| P21 | 23 | 20 | 2 | 1 | 0 | 13.0 |
| HCV core表达 | P53 表达 | n | |||
| - | + | ++ | +++ | ||
| + | 3 | 6 | 1 | 0 | 10 |
| ++ | 0 | 6 | 2 | 0 | 8 |
| +++ | 0 | 0 | 4 | 1 | 5 |
| n | 3 | 12 | 7 | 1 | 23 |
| HCV核心蛋白表达 | Mdm2表达 | 总数 | ||
| - | + | + | ||
| + | 1 | 9 | 0 | 10 |
| ++ | 1 | 6 | 1 | 8 |
| +++ | 0 | 2 | 3 | 5 |
| 总数 | 2 | 17 | 4 | 23 |
| HCV核心蛋白表达 | P21waf1表达 | n | ||
| - | + | ++ | ||
| + | 10 | 0 | 0 | 10 |
| ++ | 7 | 1 | 0 | 8 |
| +++ | 3 | 1 | 1 | 5 |
| 总数 | 20 | 2 | 1 | 23 |
HCV常导致各种肝脏疾病, 引起慢性肝炎、脂肪变性(是HCV引起的主要特征之一)、肝硬化和肝癌, 在许多国家里是导致肝细胞癌的主要因素. 在HCV的蛋白中核心蛋白是细胞信号传导最强的信号"转换器"[6-8]. 核心蛋白有核定位信号、磷酸化位点、核浆定位及DNA结合区的存在, 是一种有基因调节功能的蛋白; 核心蛋白能与许多细胞因子作用, 促进细胞增生、增生, 诱导细胞永生化和细胞转化; P53/P21waf1是抑制细胞生长、增生, 促使细胞停止和肿瘤发生的重要信号通路, 对核心蛋白与P53/P21waf1通路之间的关系还没有明确的结论, 有人认为核心蛋白抑制P53依赖的P21waf1蛋白表达, 有人则认为能促进P53转录和表达, 上调P21waf1蛋白的表达[9]. 本实验所收集到的HCV核心蛋白阳性表达病例在病理诊断上主要表现慢性肝炎、结节性肝硬化、脂肪变, 非典型性胆管样和肝细胞增生, 表明HCV的确可引起慢性肝脏疾病和肝细胞转化. 那么, 核心蛋白与突变P53、Mdm2、P21waf1这些细胞因子的关系如何呢?
体外实验表明, HCV核心蛋白下调P53启动子活性, 抑制P53蛋白的表达同时也抑制P21waf1启动子, 从而抑制细胞凋亡, 促进细胞生长[10-11]; 而核心蛋白是否引起P53基因的突变, 导致突变P53蛋白的表达, 是值的探讨并进一步研究的问题. 虽然还没见到有关HCV核心蛋白导致P53突变的报道, 但是我们的实验表明, 突变P53与核心蛋白的表达趋于一致; P53和核心蛋白间的双向有序相关性检验P = 0.011, 有显著性意义, 从统计学上讲二者的表达是有关联的. 所以, 突变P53的表达与核心蛋白存在着一种必然的联系. 核心蛋白很有可能促进P53的突变, 因为突变的P53能直接引起细胞的永生化和癌的发生. P53突变后有3个机制促进细胞生长和肿瘤的发生: (1)野生P53功能丢失(LOF); (2)优势否定效应(DNE); (3)获得性功能(GOF). 突变P53不具备野生型的功能, 使得P53不能与DNA结合引起反式激活, 使下游的几个目标基因P21waf1、Bax、Bcl-2启动子不能激活, 失去了对细胞的凋亡作用, 失去了对细胞生长的抑制作用. 突变P53蛋白稳定, 不易被泛素通路Mdm2蛋白降解, 且稳定地积蓄在细胞中, 而突变P53仍有小聚合的能力, 可与野生的发生杂合型聚合, 有效封闭野生P53与DNA的结合从而抑制野生P53对细胞生长和肿瘤的抑制效应, 因此, 即使细胞中有野生P53的存在, 这种否定效应(DNE)也会使野生P53失去作用[12]. 突变P53获得性功能是指他获得了与野生P53相反的功能, 他能激活本被野生P53抑制的启动子或基因, 如VEGF、PCNA、Bcl-2、c-myc启动子, 促进细胞生长、转化, 恶性转化机率增高[13-14].
Mdm2(murine double minute 2基因产物, 染色体位于12q13-14)被称为原癌基因, 在调节野生P53的稳定性和活性起着十分重要的作用. 研究认为Mdm2起着泛素E3连接酶作用, 促进野生P53泛素化和降解, 也能通过自身泛素化来调节自身的稳定[15-17]. 正常细胞中(非应激条件下), 野生P53的调节存在着负反馈环, 使得P53存活时间很短. 野生P53蛋白是mdm2基因的转录激活剂, Mdm2蛋白的表达反过来与野生P53蛋白结合, 起泛素E3连接酶的功能, 使P53偶联到多聚泛素上, Mdm2与P53结合后还能封闭P53的转录活性[18-22]. Mdm2有出胞核序列, Mdm2与P53结合后引导野生P53出胞核, 在胞质中通过泛素通路26S蛋白酶体降解野生P53蛋白[23-24], 使P53维持低水平状态, 保持细胞正常增生. 本实验中的Mdm2的阳性表达高达91.3%, 这种高表达的结果可导致即使组织有野生P53蛋白的表达也不能发挥对细胞的停滞、衰老和凋亡作用. 突变P53和Mdm2的共同作用几乎使组织失去了对细胞增生抑制, 很可能是本实验观察到的组织持续增生或有非典型性增生的重要原因.
P21waf1基因位于P53基因的下游, 是P53的目标基因, 许多信号, 如DNA损伤、辐射、缺氧等可激活P53转录表达, P53蛋白通过反式激活P21waf1启动子, 引起P21waf1蛋白的表达. P21waf1在P53介导的细胞周期停止、凋亡中起着重要的作用, 他通过结合周期蛋白-CDKs复合物(包括CyclinA-CDK2、CyclinE-CDK2、CyclinD-CDK4、CyclinD-CDK2), 抑制酶的活性阻止细胞从G1期进入S期. P21waf1启动子有P53的结合位点, 在正常情况下, 主要依赖P53通路来促进P21waf1的表达, 抑制各种Cyclin-CDK复合物的激酶活性[3]. 但是, 在转化细胞中往往缺乏P21waf1的表达, 表明P21waf1的减少和缺失在细胞转化和肿瘤发生中起重要作用. 我们结果显示, 在HCV感染的肝炎、脂肪变、肝硬化中P21waf1的表达缺失是很普遍的, 也说明他的表达缺失在慢性肝炎、肝细胞转化和癌变中起着一定的作用. 那么在HCV感染组织中HCV或其核心蛋白对P21waf1起着怎样的作用呢?
有两种机制可能引起P21waf1的下调或缺失. 我们知道P21waf1的表达主要通过野生P53反式激活而非突变P53的作用所致, 而HCV感染的组织中核心蛋白可抑制P53野生的转录和表达[25-26]. 因此, 在本研究中P21waf1的表达缺失, 首先是野生P53被抑制或发生P53突变, 不能正常激活P21waf1的转录和表达. 其次, 可能还存在另外一种因素来调节P21waf1的表达. 有人报道, 野生P53阴性的细胞也能诱导P21waf1的表达[3], 说明还有一非依赖于P53的通道诱导P21waf1的表达. 本实验HCV核心蛋白阳性组织中P21waf1表达缺失, HCV核心蛋白与P21表达的相关性P值为0.2, 即核心蛋白与P21waf1的表达不存在线性关系, 说明另有因素抑制或下调P21waf1的表达, 这一作用很可能有HCV核心蛋白参与, 因为核心蛋白是一很强的细胞基因调节因子, 并能与许多细胞蛋白发生作用[1]. 现也有报道[27] HCV核心蛋白可抑制P21waf1启动子的活性降低P21waf1mRNA的转录和合成. 本实验中有P21waf1蛋白3例呈阳性表达, 其表达是否与组织仍有野生P53的表达有关, 还是通过Smad和Sp1激活肿瘤生长因子(TGFβ)诱导P21waf1转录[28-30], 其机制仍不清楚.
总之, HCV核心蛋白很可能促进P53的突变, 也间接提高了Mdm2的表达水平, 从而抑制了野生P53和P21waf1的转录和表达, 促进肝细胞增生、增生、转化和恶变. 所以, HCV核心蛋白是导致慢性肝炎、脂肪变性、肝硬化、肝细胞永生化和恶性变的重要因素, 但其作用机制有待进一步研究证实.
编辑: 张海宁
| 1. | Ray RB, Ray R. Hepatitis C virus core protein: intriguing properties and functional relevance. FEMS Microbiol Lett. 2001;202:149-156. [PubMed] |
| 2. | Otsuka M, Kato N, Lan K, Yoshida H, Kato J, Goto T, Shiratori Y, Omata M. Hepatitis C virus core protein enhances p53 function through augmentation of DNA binding affinity and transcriptional ability. J Biol Chem. 2000;275:34122-34130. [PubMed] |
| 3. | Kao CF, Chen SY, Chen JY, Wu Lee YH. Modulation of p53 transcription regulatory activity and post-translational modification by hepatitis C virus core protein. Oncogene. 2004;23:2472-2483. [PubMed] [DOI] |
| 4. | Gong GZ, Jiang YF, He Y, Lai LY, Zhu YH, Su XS. HCV NS5A abrogates p53 protein function by interfering with p53-DNA binding. World J Gastroenterol. 2004;10:2223-2227. [PubMed] |
| 5. | Shi YZ, Hui AM, Takayama T, Li X, Cui X, Makuuchi M. Reduced p21(WAF1/CIP1) protein expression is predominantly related to altered p53 in hepatocellular carcinomas. Br J Cancer. 2000;83:50-55. [PubMed] |
| 6. | Kato N, Yoshida H, Ono-Nita SK, Kato J, Goto T, Otsuka M, Lan K, Matsushima K, Shiratori Y, Omata M. Activation of intracellular signaling by hepatitis B and C viruses: C-viral core is the most potent signal inducer. Hepatology. 2000;32:405-412. [PubMed] |
| 7. | Taniguchi H, Kato N, Otsuka M, Goto T, Yoshida H, Shiratori Y, Omata M. Hepatitis C virus core protein upregulates transforming growth factor-beta 1 transcription. J Med Virol. 2004;72:52-59. [PubMed] |
| 8. | Bataller R, Paik YH, Lindquist JN, Lemasters JJ, Brenner DA. Hepatitis C virus core and nonstructural proteins induce fibrogenic effects in hepatic stellate cells. Gastroenterology. 2004;126:529-540. [PubMed] |
| 9. | Jung EY, Lee MN, Yang HY, Yu D, Jang KL. The repressive activity of hepatitis C virus core protein on the transcription of p21(waf1) is regulated by protein kinase A-mediated phosphorylation. Virus Res. 2001;79:109-115. [PubMed] |
| 10. | Dubourdeau M, Miyamura T, Matsuura Y, Alric L, Pipy B, Rousseau D. Infection of HepG2 cells with recombinant adenovirus encoding the HCV core protein induces p21(WAF1) down-regulation -- effect of transforming growth factor beta. J Hepatol. 2002;37:486-492. [PubMed] |
| 11. | Miyazaki M, Sakaguchi M, Akiyama I, Sakaguchi Y, Nagamori S, Huh NH. Involvement of interferon regulatory factor 1 and S100C/A11 in growth inhibition by transforming growth factor beta 1 in human hepatocellular carcinoma cells. Cancer Res. 2004;64:4155-4161. [PubMed] |
| 12. | Blagosklonny MV. p53 from complexity to simplicity: mutant p53 stabilization, gain-of-function, and dominant-negative effect. Faseb J. 2000;14:1901-1907. [PubMed] |
| 14. | Olivier M, Hussain SP, Caron de Fromentel C, Hainaut P, Harris CC. TP53 mutation spectra and load: a tool for generating hypotheses on the etiology of cancer. IARC Sci Publ. 2004;157:247-270. [PubMed] |
| 15. | Xirodimas DP, Chisholm J, Desterro JM, Lane DP, Hay RT. P14ARF promotes accumulation of SUMO-1 conjugated (H)Mdm2. FEBS Lett. 2002;528:207-211. [PubMed] |
| 16. | Ghimenti C, Fiano V, Chiadò-Piat L, Chiò A, Cavalla P, Schiffer D. Deregulation of the p14ARF/Mdm2/p53 pathway and G1/S transition in two glioblastoma sets. J Neurooncol. 2003;61:95-102. [PubMed] |
| 17. | Korgaonkar C, Zhao L, Modestou M, Quelle DE. ARF function does not require p53 stabilization or Mdm2 relocalization. Mol Cell Biol. 2002;22:196-206. [PubMed] |
| 18. | Yin Y, Stephen CW, Luciani MG, Fåhraeus R. p53 Stability and activity is regulated by Mdm2-mediated induction of alternative p53 translation products. Nat Cell Biol. 2002;4:462-467. [PubMed] |
| 19. | Huang Y, Tyler T, Saadatmandi N, Lee C, Borgstrom P, Gjerset RA. Enhanced tumor suppression by a p14ARF/p53 bicistronic adenovirus through increased p53 protein translation and stability. Cancer Res. 2003;63:3646-3653. [PubMed] |
| 20. | Ghosh A, Stewart D, Matlashewski G. Regulation of human p53 activity and cell localization by alternative splicing. Mol Cell Biol. 2004;24:7987-7997. [PubMed] |
| 21. | Capoulade C, Bressac-de Paillerets B, Lefrère I, Ronsin M, Feunteun J, Tursz T, Wiels J. Overexpression of MDM2, due to enhanced translation, results in inactivation of wild-type p53 in Burkitt's lymphoma cells. Oncogene. 1998;16:1603-1610. [PubMed] |
| 22. | Xia L, Paik A, Li JJ. p53 activation in chronic radiation-treated breast cancer cells: regulation of MDM2/p14ARF. Cancer Res. 2004;64:221-228. [PubMed] |
| 23. | Lain S, Lane D. Improving cancer therapy by non-genotoxic activation of p53. Eur J Cancer. 2003;39:1053-1060. [PubMed] |
| 24. | Laín S. Protecting p53 from degradation. Biochem Soc Trans. 2003;31:482-485. [PubMed] |
| 25. | Zondervan PE, Wink J, Alers JC, IJzermans JN, Schalm SW, de Man RA, van Dekken H. Molecular cytogenetic evaluation of virus-associated and non-viral hepatocellular carcinoma: analysis of 26 carcinomas and 12 concurrent dysplasias. J Pathol. 2000;192:207-215. [PubMed] |
| 26. | van Dekken H, Wink J, Alers JC, de Man RA, IJzermans JN, Zondervan PE. Genetic evaluation of the dysplasia-carcinoma sequence in chronic viral liver disease: a detailed analysis of two cases and a review of the literature. Acta Histochem. 2003;105:29-41. [PubMed] |
| 27. | Marusawa H, Hijikata M, Chiba T, Shimotohno K. Hepatitis C virus core protein inhibits Fas- and tumor necrosis factor alpha-mediated apoptosis via NF-kappaB activation. J Virol. 1999;73:4713-4720. [PubMed] |
| 28. | Otsuka M, Kato N, Taniguchi H, Yoshida H, Goto T, Shiratori Y, Omata M. Hepatitis C virus core protein inhibits apoptosis via enhanced Bcl-xL expression. Virology. 2002;296:84-93. [PubMed] |
| 29. | Mori M, Uchida M, Watanabe T, Kirito K, Hatake K, Ozawa K, Komatsu N. Activation of extracellular signal-regulated kinases ERK1 and ERK2 induces Bcl-xL up-regulation via inhibition of caspase activities in erythropoietin signaling. J Cell Physiol. 2003;195:290-297. [PubMed] |
| 30. | Woo JH, Kim YH, Choi YJ, Kim DG, Lee KS, Bae JH, Min DS, Chang JS, Jeong YJ, Lee YH. Molecular mechanisms of curcumin-induced cytotoxicity: induction of apoptosis through generation of reactive oxygen species, down-regulation of Bcl-XL and IAP, the release of cytochrome c and inhibition of Akt. Carcinogenesis. 2003;24:1199-1208. [PubMed] |