修回日期: 2004-11-10
接受日期: 2004-11-17
在线出版日期: 2005-01-15
目的: 应用c-fos作为神经通路的指示物, 探讨SP能神经通路在IBS发病机制中的可能作用.
方法: 应用冰水灌胃法建立便秘型肠易激综合征(C-IBS)大鼠模型, 模型组与对照组各10只大鼠. 通过免疫组化方法研究两组大鼠直肠球囊扩张后肠道肌间神经丛、腰骶段脊髓背角、下丘脑及前扣带回SP和c-fos表达, 对染色切片进行计算机病理图像分析.
结果: 模型组回盲部及结肠肌间神经丛SP阳性表达的不透光率密度均显著高于对照组(分别为176.6 vs 155.5, 172.3 vs 152.0, P<0.05), 脊髓背角、下丘脑及前扣带回SP阳性表达的面积均显著高于正常对照组(分别为169318 vs 137655, 144728 vs 114403, 145117 vs 117612, P<0.05), 脊髓背角、下丘脑及前扣带回SP阳性表达的不透光率密度均显著高于正常对照组(分别为182.1 vs 160.2, 128.3 vs 117.9, 127.9 vs 114.5, P<0.05). 模型组回盲部及结肠肌间神经丛、脊髓背角、下丘脑及前扣带回c-fos阳性表达的面积均显著高于正常对照组(191712 vs 154363, 73597 vs 41179, 46258 vs 33238, 302369 vs 204563, 708506 vs 409856, P<0.05), 模型组回盲部及结肠肌间神经丛、脊髓背角、下丘脑及前扣带回c-fos阳性表达的不透光率密度均显著高于正常对照组(120.9 vs 109.0, 101.3 vs 92.2, 125.4 vs 88.7, 115.5 vs 88.6, 120.6 vs 105.1, P<0.05). 相关分析显示: 模型组肠道、脊髓、下丘脑、前扣带回SP表达与c-fos表达之间密切相关(r = 0.594-0.721, P<0.05).
结论: SP在中枢及肠道可能参与C-IBS的病理生理过程, 而且SP能神经通路可能是参与肠道感觉或运动功能调节的神经传导通路之一.
引文著录: 王巍峰, 杨云生, 孙刚, 彭丽华. 肠易激综合征大鼠P物质能神经通路的改变. 世界华人消化杂志 2005; 13(2): 214-218
Revised: November 10, 2004
Accepted: November 17, 2004
Published online: January 15, 2005
AIM: To investigate the expression of substance P (SP) and c-fos in the enteric nervous system (ENS) and central nervous system (CNS) of a rat model of constipation-predominant irritable bowel syndrome (C-IBS), and to explore the possible role of SP-immunoreactive nerve fibers in IBS.
METHODS: The rat model was established by intragastrical injection with ice-cold water (0-4 ℃). The expressions of SP and c-fos in the ENS and CNS of model group (n = 10) and control group (n = 10) were detected by immunohis-tochemistry, and analyzed semi-quantitatively by computerized color image analyzer. The statistical differences of the opacity density (OD) and immunoreactive areas (IA) between the two groups were examined by t-test.
RESULTS: The expressions of SP in ileocecus, colonic myenteric plexus, spinal dorsal horn, hypothalamus, and the fore part of gyrus cinguli were significantly higher in model group than those in the corresponding regions of control group (OD: 176.6 vs 155.5, 172.3 vs 152.0, 182.1 vs 160.2, 128.3 vs 117.9, 127.9 vs 114.5, P < 0.05; IA: 169318 vs 137655, 144728 vs 114403, 145117 vs 117612 except in ileocecus and colonic myenteric plexus, P < 0.05). The expression of c-fos in the above tissues was significantly higher in model group than that in the corresponding regions in control group (OD: 120.9 vs 109.0, 101.3 vs 92.2, 125.4 vs 88.7, 115.5 vs 88.6, 120.6 vs 105.1, P<0.05; IA: 191712 vs 154363, 73597 vs 41179, 46258 vs 33238, 302369 vs 204563, 708506 vs 409856, P < 0.05). There was a close correlation between the expression of SP and c-fos in the same region (r = 0.594-0.721, P < 0.05).
CONCLUSION: The abnormal SP immunoreactive nerve fibers may be involved in the pathogenesis of IBS. SP containing neural pathway may play an important role in the regulation of the gastrointestinal function.
- Citation: Wang WF, Yang YS, Sun G, Peng LH. Change of substance P containing neural pathway in rat model of irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 214-218
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/214.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.214
肠易激综合征(irritable bowel syndrome, IBS)常见, 但病因和发病机制尚不完全清楚, 已经提出的发病机制有肠道动力异常、内脏感觉异常、脑肠肽相互作用、神经免疫机制、神经免疫内分泌网络失调机制[1]等. IBS患者血浆及肠道内多种脑肠肽/胃肠激素有异常变化, 回盲部肥大细胞也有异常改变, 还有学者报道在PET及fMRI脑扫描中发现IBS患者的一些脑中枢功能状态也发生了变化, 提示IBS可能存在神经、内分泌、甚至免疫方面的异常. 但在人体开展IBS患者肠道肌层及中枢神经系统神经递质的研究非常困难. 为深入探讨IBS的发病机制, 我们利用冰水灌胃方法建立的便秘型肠易激综合征(C-IBS)大鼠模型为研究对象[2], 采用SP抗体进行免疫组化染色, 用c-fos作为神经通路的指示物, 研究SP能神经在肠道肌层及中枢神经系统的分布, 以探讨其在IBS发病机制中的可能作用.
出生4 wk的雄性Wistar大鼠20只, 体质量120-150 g, 军事医学科学院实验动物中心提供. 兔抗SP抗体为武汉博士德生物公司产品. 抗体稀释液, 正常山羊血清封闭液, 生物素化羊抗兔IgG, SABC试剂盒为武汉博士德生物公司产品. 兔抗c-fos抗体, DAB, 胰酶, 苏木素, PBS为北京中山生物公司产品.
采用彭丽华et al[2]建立的C-IBS大鼠模型为研究对象. 20只大鼠随机分为2组, 模型组10只, 每日给予0-4 ℃冰水2 mL灌胃1次, 共14 d; 灌胃停止后正常饲养. 正常对照组10只, 每日正常饲食饮水. 第28 d处死取回盲部、距肛门3 cm处的结肠、脊髓腰骶段(L5-S2)、大脑组织, 40 g/L甲醛固定, 常规石蜡包埋切片. 其中大脑组织按Paxinos-Watson图谱于前囟后方1.5 mm至前囟后方5.0 mm连续冠状切片. 然后应用1:100稀释的兔抗SP, c-fos抗体, 按SABC免疫组化法进行标记, 操作步骤按试剂说明. DAB室温显色5-10 min, 镜下控制反应时间, 以着棕色者为染色阳性. 染色结果应用计算机病理图像分析系统, 对切片中各抗体呈阳性反应的面积、不透光率密度(opacity density, OD)进行半定量分析. A值代表组织染色强度, 即A值越大, 染色越强. 每张切片随机取两个视野进行分析, 取其平均值.
统计学处理 采用SPSS11.5软件分析, 计数资料用均数±标准差mean±SD描述, 组间资料进行t检验, 计数资料相关分析用直线相关分析. P<0.05为差异显著.
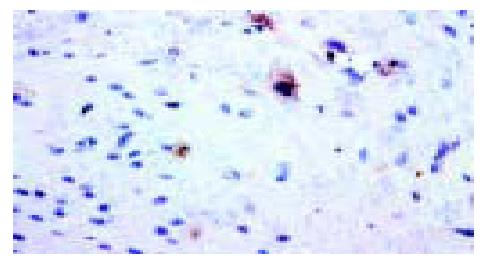
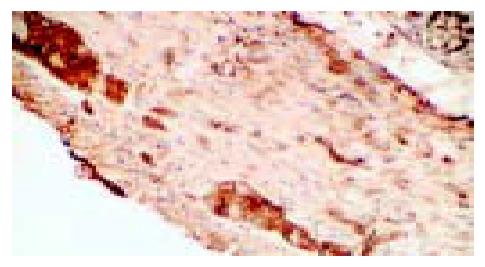
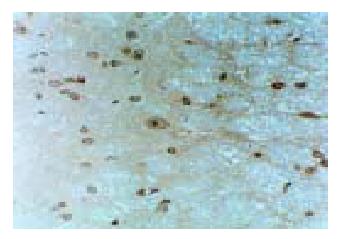
IBS大鼠模型和正常对照组大鼠回盲部及结肠肌间神经丛中SP染色呈较强的棕黄色反应, 肌间神经丛沿肌束走行方向分布, 呈梭状、团状, 神经元密集, 细胞核较大(图1). IBS大鼠模型和正常对照组大鼠SP能神经元在脊髓分布较多的区域有后角Rexed I, II, V板层, 其余板层也有少量阳性细胞, 呈棕黄色至褐色(图2). IBS大鼠模型和正常对照组大鼠SP染色可见下丘脑及前扣带回较多SP阳性表达区域, 集中于神经元, 细胞形状不一, 呈褐色至深棕色(图3). IBS大鼠模型回盲部、结肠SP阳性表达的不透光率密度值较正常对照组明显增高(P<0.05, 表1); IBS大鼠模型回盲部、结肠SP阳性表达的面积较正常对照组均无明显差异(P>0.05). IBS大鼠模型脊髓后角SP阳性表达的不透光率密度值、阳性面积较正常对照组明显增高(P<0.05). IBS大鼠模型下丘脑与扣带回SP阳性表达的不透光率密度值、阳性面积较正常对照组明显增高(P<0.05).
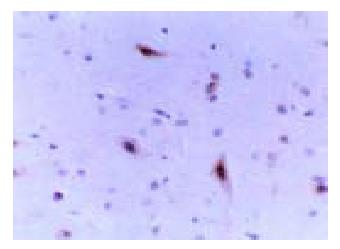
在肠道肌间神经丛可见c-fos阳性神经元, 沿肌束走行方向分布(图4). 脊髓灰质中可见大量c-fos阳性神经元, 多位于脊髓背角RexedI-II区、RexedⅧ区以及RexedVII区(图5). 下丘脑及前扣带回可见大量c-fos表达, 胞核阳性, 呈黄至棕色(图6). IBS模型组c-fos阳性表达的不透光率密度值、阳性面积均明显高于正常对照组(P<0.05, 表2).
| 部位 | 正常对照组 | IBS模型组a | ||
| 阳性面积 | 不透光率密度 | 阳性面积 | 不透光率密度 | |
| 回盲部 | 154363±63462 | 109.0±9.0 | 191712±71405 | 120.9±8.5 |
| 结肠 | 41179±11762 | 92.2±7.5 | 73597±41613 | 101.3±11.3 |
| 脊髓背角 | 33238±4587 | 88.7±23.2 | 46258±4642 | 125.4±23.3 |
| 下丘脑 | 204563±89698 | 88.6±10.3 | 302369±103026 | 115.5±12.1 |
| 前扣带回 | 409856±189652 | 105.1±10.4 | 708506±224561 | 120.6±23.2 |
模型组结肠肌间神经丛SP阳性表达的不透光率密度与c-fos阳性表达的不透光率密度之间密切相关(r = 0.670, P<0.05); 模型组脊髓SP表达与c-fos表达密切相关(r = 0.594-0.672, P<0.05); 下丘脑及前扣带回SP阳性面积与c-fos阳性面积密切相关(r = 0.649-0.721, P<0.05, 表3).
| 指标 | r | P |
| 回盲部SP与c-fos阳性表达的不透光率密度 | 0.411 | >0.05 |
| 回盲部SP与c-fos阳性表达的面积 | 0.357 | >0.05 |
| 结肠SP与c-fos阳性表达的不透光率密度 | 0.670 | <0.05 |
| 结肠SP与c-fos阳性表达的面积 | 0.329 | >0.05 |
| 脊髓SP与c-fos阳性表达的不透光率密度 | 0.594 | <0.05 |
| 脊髓SP与c-fos阳性表达的面积 | 0.672 | <0.05 |
| 下丘脑SP与c-fos阳性表达的不透光率密度 | 0.383 | >0.05 |
| 下丘脑SP与c-fos阳性表达的面积 | 0.721 | <0.05 |
| 前扣带回SP与c-fos阳性表达的不透光率密度 | 0.578 | <0.05 |
| 前扣带回SP与c-fos阳性表达的面积 | 0.649 | <0.05 |
c-fos基因是一种即刻早基因, 表达产物fos被认为是伤害性感受神经元兴奋的标志物[3-4], c-fos技术被用于神经通路的研究[5-6]. SP能神经纤维主要分布在肠壁肌层[7]. 目前对IBS患者P物质变化的研究结果不一[8-10]. 类似相悖的情况也出现在慢传输型便秘的研究中[11-12]. 这可能是因为SP参与肠道运动调节的形式很复杂, 如经典内分泌途径、旁分泌、神经内分泌形式等. 我们发现SP在肠道肌层表达增强, 以前未曾有报道.
目前一些研究提示肠道黏膜或肌层轻度炎症[13-14]、肥大细胞激活[15]等因素可导致从肠道传入脊髓的伤害性信号增多, 可能是IBS内脏高敏感性的一种原因. 脊髓及脑对传入信号的异常放大或整合可能是内脏高敏感性的另一种原因[16-17]. 有多种递质在脊髓水平调节疼痛或非疼痛性内脏感觉[18-19], 常见的有SP, VIP, GABA, 谷氨酸等. 一般认为SP属于伤害性刺激的神经递质. 脊髓内SP阳性神经纤维一部分终止于脊髓内核团, 一部分投射到躯体及内脏, 还有一部分是来自脑干的分支. 已证明SP在突触后敏感化过程中起重要作用, SP可直接作用于突触后细胞致后角神经元兴奋性增高[20]. 我们发现大鼠模型中脊髓后角SP免疫活性和对照组比较有明显增高, 提示此模型中SP改变可能影响脊髓后角功能, 进而影响内脏传入神经功能或内脏感觉等, 其确切的作用有待进一步的研究证实.
高级中枢尤其是边缘系统在IBS中发病机制中的作用受到一定的关注. 有报道脑PET和fMRI检查发现直肠扩张时IBS患者脑内功能区域活动增强或减弱[21-25], 可能与IBS的发病机制有关. 这些功能区域包括下丘脑, 前扣带回, 脑干及小脑等. 众所周知, 边缘系统包括下丘脑, 大脑的扣带回, 海马等结构, 他是许多内脏活动初级中枢的调节者. 至于大脑这些核团功能状态改变的生化基础未见有进一步的研究. 以往的神经生物学试验发现在这些神经中枢及传导通路中有多种神经递质的参与, 如SP, 去甲肾上腺素, 乙酰胆碱等. 而且, 在脑内SP与其他神经递质之间存在着明显的相互调节, 有实验显示大鼠侧脑室注入SP, 可刺激多巴胺、去甲肾上腺素及5-羟色胺在脑内不同部位的合成[26]. 本实验中发现此IBS大鼠模型中SP在下丘脑及扣带回表达增多, 提示此模型中边缘系统的SP神经生化发生了改变, 并可能在大脑中枢的水平参与肠道功能的调节.
以上研究发现, C-IBS模型中SP在肠道肌层、脊髓后角、下丘脑和扣带回表达均增强, 进一步相关分析显示c-fos表达与SP表达密切相关, 这提示从肠道肌间神经丛到脊髓后角到边缘系统可能存在一条SP能神经传导通路. 虽然以前研究已经发现肠道神经丛有外来SP能神经纤维, 脊髓中存在传入及传出的SP能神经, 大脑也有下传的SP能神经, 但是否形成一条神经通路未得到确定. SP在中枢及外周神经系统均为兴奋性神经递质, 且常与其他兴奋性神经递质共存, 这提示上述SP能神经传导通路可能为一种兴奋性神经传导通路. 目前已知SP既参与内脏痛觉信号传导, 也参与胃肠动力的调节, 这些功能有可能是通过此通路实现的. 鉴于此有必要应用神经束行径示踪等技术深入研究SP能神经传导行径及中枢内SP能神经核团的纤维联系, 探讨与其他神经传导通路的相互作用方式. 最近已发现多种速激肽受体(即P物质的受体)拮抗剂, 如TAK-637对IBS具有治疗作用[27], 对SP神经通路的研究也有助于揭开这类药物的作用机制.
在近年的研究中有学者提出IBS发病机制"神经可塑性"(neural plasticity)的概念. 神经可塑性[28-30]是在经过刺激或训练以后, 神经系统结构与功能上发生的适应性变化, 在宏观上表现为脑功能、行为表现及精神活动的改变; 在微观上表现为神经突触, 神经化学物质, 神经电生理等方面的变化. 本实验中C-IBS大鼠模型神经递质在脑、脊髓、肠神经系统发生了改变, 提示在后天的胃肠诱因刺激下可发生神经系统生理、生化改变, 为IBS发病机制可能存在所谓的"神经可塑性"改变提供了新的依据.
总之, 正常情况下肠道神经递质通过神经免疫内分泌网络与胃肠激素、细胞因子等相互调控, 使胃肠道功能处于动态的平衡中. 近年来越来越多的临床研究及基础研究发现IBS患者肠道中神经系统、内分泌系统、免疫系统的多种细胞及活性物质可能发生变化, 为IBS肠道神经、免疫、内分泌网络失调机制[1]提供越来越多的间接或直接证据. 但在其中哪种物质起到始动作用或关键作用尚需要做大量的工作来证实.
编辑: 潘伯荣 审读: 张海宁
| 1. | 杨 云生. 肠易激综合征神经免疫内分泌网络调控机制. 胃肠病学和肝病学杂志. 2002;11:320-322. |
| 3. | Mönnikes H, Rüter J, König M, Grote C, Kobelt P, Klapp BF, Arnold R, Wiedenmann B, Tebbe JJ. Differential induction of c-fos expression in brain nuclei by noxious and non-noxious colonic distension: role of afferent C-fibers and 5-HT3 receptors. Brain Res. 2003;966:253-264. [PubMed] |
| 4. | Nakagawa T, Katsuya A, Tanimoto S, Yamamoto J, Yamauchi Y, Minami M, Satoh M. Differential patterns of c-fos mRNA expression in the amygdaloid nuclei induced by chemical somatic and visceral noxious stimuli in rats. Neurosci Lett. 2003;344:197-200. [PubMed] |
| 5. | Murphy M, Greferath U, Nag N, Nithianantharajah J, Wilson YM. Tracing functional circuits using c-Fos regulated expression of marker genes targeted to neuronal projections. Front Biosci. 2004;9:40-47. [PubMed] |
| 6. | Martinez M, Calvo-Torrent A, Herbert J. Mapping brain response to social stress in rodents with c-fos expression: a review. Stress. 2002;5:3-13. [PubMed] |
| 7. | Hökfelt T, Pernow B, Wahren J. Substance P: a pioneer amongst neuropeptides. J Intern Med. 2001;249:27-40. [PubMed] |
| 11. | Tzavella K, Riepl RL, Klauser AG, Voderholzer WA, Schindlbeck NE, Müller-Lissner SA. Decreased substance P levels in rectal biopsies from patients with slow transit constipation. Eur J Gastroenterol Hepatol. 1996;8:1207-1211. [PubMed] |
| 13. | Spiller RC, Jenkins D, Thornley JP, Hebden JM, Wright T, Skinner M, Neal KR. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut. 2000;47:804-811. [PubMed] |
| 14. | Törnblom H, Lindberg G, Nyberg B, Veress B. Full-thickness biopsy of the jejunum reveals inflammation and enteric neuropathy in irritable bowel syndrome. Gastroenterology. 2002;123:1972-1979. [PubMed] |
| 16. | Coffin B, Bouhassira D, Sabaté JM, Barbe L, Jian R. Alteration of the spinal modulation of nociceptive processing in patients with irritable bowel syndrome. Gut. 2004;53:1465-1470. [PubMed] |
| 17. | Hobson AR, Sarkar S, Furlong PL, Thompson DG, Aziz Q. A cortical evoked potential study of afferents mediating human esophageal sensation. Am J Physiol Gastrointest Liver Physiol. 2000;279:G139-G147. [PubMed] |
| 18. | Barbara G, De Giorgio R, Stanghellini V, Cremon C, Corinaldesi R. A role for inflammation in irritable bowel syndrome? Gut. 2002;51 Suppl 1:i41-i44. [PubMed] |
| 19. | McLeod AL, Krause JE, Ribeiro-Da-Silva A. Immunocytochemical localization of neurokinin B in the rat spinal dorsal horn and its association with substance P and GABA: an electron microscopic study. J Comp Neurol. 2000;420:349-362. [PubMed] |
| 20. | Zubrzycka M, Janecka A. Substance P: transmitter of nociception (Minireview). Endocr Regul. 2000;34:195-201. [PubMed] |
| 21. | Ringel Y, Drossman DA, Turkington TG, Bradshaw B, Hawk TC, Bangdiwala S, Coleman RE, Whitehead WE. Regional brain activation in response to rectal distension in patients with irritable bowel syndrome and the effect of a history of abuse. Dig Dis Sci. 2003;48:1774-1781. [PubMed] |
| 22. | Mertz H, Morgan V, Tanner G, Pickens D, Price R, Shyr Y, Kessler R. Regional cerebral activation in irritable bowel syndrome and control subjects with painful and nonpainful rectal distention. Gastroenterology. 2000;118:842-848. [PubMed] |
| 23. | Kern MK, Jaradeh S, Arndorfer RC, Jesmanowicz A, Hyde J, Shaker R. Gender differences in cortical representation of rectal distension in healthy humans. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1512-G1523. [PubMed] |
| 24. | Silverman DH, Munakata JA, Ennes H, Mandelkern MA, Hoh CK, Mayer EA. Regional cerebral activity in normal and pathological perception of visceral pain. Gastroenterology. 1997;112:64-72. [PubMed] |
| 25. | Bonaz B, Baciu M, Papillon E, Bost R, Gueddah N, Le Bas JF, Fournet J, Segebarth C. Central processing of rectal pain in patients with irritable bowel syndrome: an fMRI study. Am J Gastroenterol. 2002;97:654-661. [PubMed] |
| 26. | Potargowicz E, Traczyk WZ. Role of substance P in central control of ovulation in female rats. Endocr Regul. 1999;33:161-167. [PubMed] |
| 27. | Furness JB. TAK-637. Takeda. Curr Opin Investig Drugs. 2001;2:1437-1440. [PubMed] |
| 28. | Bennett MR. The concept of long term potentiation of transmission at synapses. Prog Neurobiol. 2000;60:109-137. [PubMed] |
| 29. | Trojan S, Pokorný J. Theoretical aspects of neuroplasticity. Physiol Res. 1999;48:87-97. [PubMed] |
| 30. | Simos PG, Papanicolaou AC, Breier JI, Fletcher JM, Wheless JW, Maggio WW, Gormley W, Constantinou JE, Kramer L. Insights into brain function and neural plasticity using magnetic source imaging. J Clin Neurophysiol. 2000;17:143-162. [PubMed] |