修回日期: 2004-11-07
接受日期: 2004-11-12
在线出版日期: 2005-01-15
目的: 建立一种适于膜片钳技术(PCT)的大鼠肝Kupffer细胞的急性分离方法.
方法: 经门静脉插管, 用无Ca2+, Mg2+ K-H原位灌注液冲洗后, Ⅳ型胶原酶原位循环灌注消化, Percoll不连续密度梯度离心, 分离制备大鼠肝Kupffer细胞, 选择性贴壁纯化. 用体内、体外吞噬功能(炭素墨水或聚苯乙烯乳珠)实验鉴定制备的肝Kupffer细胞. 用全细胞膜片钳记录技术测定Kupffer细胞电流.
结果: 分离获得的大鼠肝Kupffer细胞形态多样, 典型的为多角形或星形, 细胞分离产量为2.5-3.5×106/g, 细胞纯度90%, 贴壁率为39.4%. 用台盼蓝染色鉴定, 细胞活性大于90%, 多数细胞明显吞噬颗粒. 易用于PCT, 且记录到钙池操纵的Ca2+ 通道电流(store-operated Ca2+ channel currents, Isoc).
结论: 用胶原酶原位循环灌注消化, 结合Percoll不连续密度梯度离心和选择性贴壁纯化, 成功分离制备出高产、纯度高的适于PCT的肝Kupffer细胞.
引文著录: 刘亮, 张宗明, 张驰, 姜楠. 适于膜片钳技术的大鼠肝Kupffer细胞急性分离和鉴定. 世界华人消化杂志 2005; 13(2): 202-206
Revised: November 7, 2004
Accepted: November 12, 2004
Published online: January 15, 2005
AIM: To establish a method for isolation of rat liver Kupffer cells suitable for patch clamp technique (PCT).
METHODS: Liver Kupffer cells were isolated from Sprague-Dawley rats by in situ perfusion via the portal vein with Ca2+/Mg2+-free Krebs buffer followed by collagenase IV digestion. Then Percoll Isopyknic gradient centrifugation was performed. Kupffer cells were purified after selective adhesion. The cells were identified by endocytosis (ink and latex beads) experiments in vivo and in vitro. The electric current in Kupffer cells was recorded by whole-cell patch-clamp recording technique.
RESULTS: The isolated Kupffer cells showed polymorphism with typical polygon-like and star-like shapes. A total of 2.5-3.5×106 cells were collected per gram of rat liver. The purity and adhesion rate were 90% and 39.4%, respectively. The activity is over 90%. The isolated and purified rat Kupffer cells were easy to be used in whole-cell PCT, and the store-operated Ca2+ current was successfully recorded in the cells.
CONCLUSION: The Kupffer cells suitable for PCT were successfully isolated from rats by enzyme digestion combined with gradient centrifugation and adhesion purification.
- Citation: Liu L, Zhang ZM, Zhang C, Jiang N. Fresh isolation and identification of the rat liver Kupffer cells suitable to patch clamp technique. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 202-206
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/202.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.202
肝Kupffer细胞是组成机体单核-巨噬细胞系统最大的群体, 占总量的80%-90%, 执行多种生物学功能. 用膜片钳技术直接记录肝Kupffer细胞的离子通道电流, 对于深入了解Kupffer细胞的功能特性, 探讨其与某些肝脏疾病、胆道疾病、全身性炎性反应等相关疾病的发生机制及防治均具有十分重要的意义. 肝Kupffer细胞的分离较难, 国外应用细胞淘析器或分离剂Nycodenz等成功分离Kupffer细胞, 然而由于设备昂贵或试剂来源不易而难于在我国广泛应用, 特别是膜片钳技术对于急性分离细胞的完整性和活性要求很高[1], 迄今为止, 国内外尚无理想的适于膜片钳技术的肝Kupffer细胞急性分离方法. 我们拟建立一种适用于膜片钳技术的大鼠肝Kupffer细胞急性分离方法, 为进一步从细胞水平研究Kupffer细胞的功能特性和调节机制奠定方法学基础.
Spraqae-Dawley大白鼠, 鼠龄4-8wk, 质量200-300 g, ♂. 由中国科学院上海实验动物中心提供. 胶原酶Ⅳ型(collangenase IV), Percoll分离液, N-2-羟乙基哌嗪-N-2-乙磺酸(HEPES), 乙二醇-双(2-氨基乙基)四乙酸(EGTA), trypan blue, 聚苯乙烯乳珠(latex beads, 直径1.1 μm), 均为美国Sigma公司产品; DMEM(美国Gibco公司); 小牛血清(上海华美生物工程公司). 其余均为国产分析纯试剂. 无Ca2+, Mg2+ K-H原位灌注液(mmol/L):KCl 5, KH2PO4 1, NaCl 115, HEPES 25, EGTA 0.5[1]. 含0.2 g/L Ⅳ型胶原酶的K-H灌注消化液(mmol/L):KCl 5, KH2PO4 1, NaCl 115, HEPES 25, CaCl2-H2O 1, 胶原酶IV 0.2 g/L[1]. 含0.5 g/L胶原酶IV的孵育液(mmol/L):KCl 5, KH2PO4 1, NaCl 115, HEPES 25, CaCl2-H2O 1, 胶原酶IV 0.5 g/L. 磷酸缓冲盐溶液(PBS, g/L):KCl 0.2, KH2PO4 0.2, NaCl 8.0, Na2HPO4-2H2O 2.08[2]. DMEM培养液: 含HEPES 25 mmol/L, Glutamine 2 mmol/L. -20 ℃保存, 临用前加入100 mL/L新鲜灭活小牛血清(FCS)、青霉素100 kU/L、链霉素 100 mg/L. Percoll分离液: 用10 mL无菌的85 g/L NaCl(1.5 mol/L)稀释90 mL Percoll液(1:9), 得到100%的Percoll溶液(300 mOsmol/L, pH 7.4), 4 ℃保存. 临用前用无菌生理盐水将Percoll配成30% (V/V, 密度为1044.8 g/L)和70% (V/V, 1096.8 g/L)的浓度.
电子蠕动泵(保定兰格恒流泵有限公司), 倒置显微镜(Zeiss Axiovert 200, 美国), 高速冷冻离心机(eppendoff, 德国), 水浴振荡箱(上海跃进医疗仪器厂), CO2培养箱(Nuaire, 美国), 抽滤除菌系统(真空泵、储液罐、滤膜0.22 μm), 培养皿(Nuncon, 美国). 硬质玻璃电极(Would Precision, 美国), MP-285三维微操纵器(Sutter Instrument Co. 美国), Axopatch 200B膜片钳放大器及pClamp9.0软件包(AXON Instrument, 美国), 防震台及静电屏蔽罩(IOI Technology Corporation Limited), MODEL P-97微电极拉制仪(Sutter Instrument Co. 美国).
1.2.1 Kupffer细胞的分离和培养: 大鼠用10 g/L戊巴比妥ip(5 mL/kg体重)麻醉, 同时予以1 U/g的肝素ip. 15 min后, 固定于操作台上, 腹部用80 g/L的硫化钠脱毛, 安尔碘消毒手术野皮肤, 打开腹腔后分别显露门静脉和下腔静脉, 于下腔静脉内注入1 MU/L的肝素1 mL, 进一步肝素化抗凝, 游离门静脉, 结扎远端, 剪开血管, 置入直径4 mm的硅胶管, 深度不宜超过第一肝门. 立即用预热37 ℃的无Ca2+, Mg2+ K-H原位灌注液灌注, 用电子蠕动泵控制流速为40 mL/min. 剪开胸腔, 夹闭下腔静脉. 快速灌注1-2 min, 待肝脏由于灌注液的充盈而膨胀, 出现均匀性颜色苍白后, 再剪开肝下下腔静脉, 放出积血积液, 同时置入直径6-8 mm的硅胶管, 供引流用. 总计快速灌注冲洗5 min, 以流出液变清和肝表面呈黄白色为准. 冲洗完成后, 取含0.2 g/L Ⅳ型胶原酶的K-H灌注消化液100 mL, 预热37 ℃. 电子蠕动泵控制流速20 mL/min, 继续从门静脉插管灌注, 经下腔静脉流出, 收集后循环灌注2-3次, 总的消化时间为10 min. 待肝变软、塌陷、弹性消失, 棉签压迫凹陷不易恢复, 肝被膜下出现空泡时, 表明灌注消化完全. 将肝脏摘下, 置入预热37 ℃含0.5 g/L胶原酶IV的孵育液50 mL中, 剔除肝包膜和结缔组织, 使细胞散落. 孵育时间20 min, 其间水浴振荡200 r/min. 孵育液用200目的不锈钢筛网滤过, 得到肝组织细胞悬液. 将上述肝组织细胞悬液以500 r/min离心10 min, 获得细胞团块. 加入PBS液50 mL, 充分吹打悬浮后, 再以50 r/min离心2 min, 保留上清液. 此时的沉淀为肝实质细胞团块, 而上清液即为非实质肝细胞悬液(NPC). 将得到的NPC以500 r/min离心5 min, 获得沉淀, 再经PBS液洗涤2次, 最终悬浮于DMEM液40 mL中. 取10 mL的离心管若干支, 仔细将Percoll分离液铺层: 底层为70%的Percoll 2 mL, 密度是1096.8 g/L; 中层为30%的Percoll 2 mL, 密度是1044.8 g/L;顶层为NPC细胞悬液2 mL. 铺层时尽量减少振荡, 保持每层之间界面清晰. 放入高速冷冻离心机, 离心(4 ℃, 800 r/min, 20 min). 取出离心管后, 可见30%和70%界面之间有一白膜状的细胞层面, 此层即为富含Kupffer细胞的NPC细胞, 用尖吸管轻轻将此层细胞吸入, 移入另一试管中[4], 加入PBS液, 以500 r/min离心5 min, 反复2次. 最终细胞悬浮于4 mL DMEM液中, 取部分用于计数和鉴定. 用苔盼蓝染色检测细胞活性, 并计数细胞量. 将获得的细胞以1×108/L的密度接种于3.5 mm的培养皿中, 每个培养皿预先放置含小牛血清的DMEM液1.5 mL. 置入37 ℃, 50 mL/L CO2, 950 mL/L O2, 950 mL/L湿度的CO2的培养箱内, 培养60 min后取出, 洗去非贴壁细胞, 获得纯化的Kupffer细胞. 贴壁的Kupffer细胞即可进行全细胞膜片钳记录.
1.2.2 Kupffer细胞的全细胞膜片钳记录 玻璃微电极拉制后尖端直径为1-2 μm, 充满电极内液后阻抗为4-8M标准电极外液成分(mmol/L):NaCl 145, MgCl2 2, CaCl2 10, CsCl 1, KCl 2.8, glucose 10, HEPES 10, 用NaOH调pH至7.4. 标准细胞内液成分(mmol/L):CsCl 120, MgCl2 1, EGTA 10, HEPES 10, Thapsigargin 2 μmol/L, 用CsOH调pH至7.3. 记录在20-24 ℃的室温下进行. 实验用Axopatch 200B膜片钳放大器, 当电极尖端与细胞膜之间形成高阻封接(大于1 G后, 负压或电击破膜, 使电极内液与细胞内液相通, 调节放大器的电容-慢控制(C-slow)和电导-串联控制(G-series)来抵消瞬时电流, 并记录调节值. 电流或电压信号经放大器放大后通过接口Labmaster TL-1与一台奔腾4计算机相连, 经3 kHz滤波, 采样频率为50 kHz, 设定钳制电位(holding potential, HP)为0mV, 实验电位(test potential, TP)为-120-+60mV, 持续时间50 ms. 信号采集与贮存, 结果分析等均借助计算机用pCLAMP 9.0软件完成.
统计学处理 计量数据以mean±SD表示, 多组间差异采用方差分析, 两组组间差异用Dunnett T检验, P<0.05为差异显著.
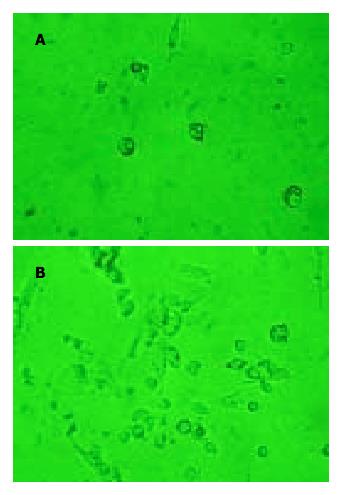
本法分离得到的Kupffer细胞产量(2.5-3.5) ×106/g, 细胞纯度90%, 以4 g/L台盼蓝染色, 细胞活性大于90%. 倒置显微镜下, 急性分离得到的Kupffer细胞为折光性很强的圆球, 直径为10 μm, 远小于肝细胞(肝细胞直径约为21 μm). 胞核大, 呈圆形或肾性, 胞质少. 完整的细胞形态在标准细胞外液中可以维持8-12 h. 在328 nm波长的紫外光照射下, 未观察到细胞的自发荧光. 在培养皿中加入含微量的碳素墨水(高温消毒)或含109个/L聚苯乙烯乳珠(latex beads, 直径1.1 μm)的DMEM培养液, 6 h后分别在相差显微镜下观察到Kupffer细胞内吞噬的炭素颗粒或聚苯乙烯乳珠(图1); 或者取鼠肝前12-24 h, 经鼠尾静脉注射含100 g/L碳素墨水的DMEM液(已消毒)1 mL, 分离Kupffer细胞过程中, 发现肝脏稍变黑; 梯度离心后, 见30%-70%的Percoll界面有一层黑色物; 培养细胞贴壁清洗后, 相差显微镜下同样可见Kupffer细胞内的吞噬炭素颗粒(图1).
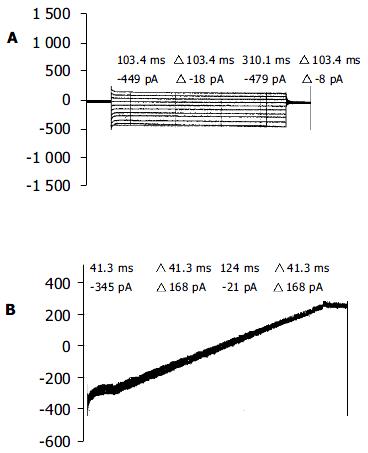
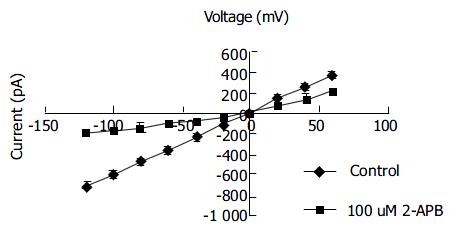
分离完整的大鼠肝Kupffer细胞易于形成全细胞膜片钳记录, 封接成功率高达80%以上(N>1000), 在电压钳制条件下, 用标准电极内液和电极外液, 可测得一种延迟性的内向电流, 当加入2 μmol/L thapsigargin+10 mmol/L EGTA耗竭细胞内钙池5-10 s后, 在-100 mV钳制电位下, 平均电流幅度为-650±50 mV(N = 12), 反转电位(reverse potential)为0~+10mV, 具有明显的内向整流性. (图2) 经过特异性药理学检测, 证实该电流主要为钙离子(Ca2+)负载(当电极外液中的Ca2+ 由10 mmol/L螯合至100 nmol/L时, 该内向电流几乎完全消失, N = 7), 对Ca2+ 具有高度选择性, 并可被2-APB特异性地抑制(电极外液中加入100 μmol/L 2-APB后, 在-100 mV钳制电位时电流幅度为-162±11 pA, N = 5)(图3). 表明记录的电流为钙池操纵的Ca2+ 通道电流(store-operated Ca2+ channel currents, Isoc).
分离完整、表面光洁、活性好、存活时间较长的Kupffer细胞是膜片钳记录成功的关键. 参考有关文献, 结合实验条件反复改进, 我们摸索出一种简单、快速、产量大且活性好的适于膜片钳记录的大鼠肝Kupffer细胞的急性分离方法, 其要点为:鼠龄4-8 wk. 灌注冲洗速率40 mL/min; 原位消化灌注0.2 g/L Ⅳ型胶原酶速率20-30 mL/min, 为节约酶量, 可采用循环灌注, 根据消化程度适当增加灌注次数以延长酶作用时间. 孵育是增加细胞产量、提高细胞活性的关键环节: (1)孵育时间: 1 h内, 孵育时间的长短对提高细胞产量有明显关系, 二者呈正相关; 孵育时间超过1 h, 细胞产量增加不明显. 另外, 孵育时间的延长, 也使细胞离体时间和酶作用时间的延长, 导致细胞活性下降. 本实验的孵育时间选用20 min. (2)酶解: 大多数文献[5-7]均采用"ronase-collagenase"的消化方式, 但Pronase E对肝细胞破坏作用的浓度和时间都很难掌握, 并且有文献证明对Kupffer细胞膜造成损害[8]. 而且肝细胞破坏后的产物DNA, 使细胞黏连聚集形成絮状物, 需使用DnasesⅠ溶解, 进一步增加了用酶的复杂性和对细胞膜的破坏. 实验证明孵育过程中仅用0.5 g/L Ⅳ型胶原酶, 并通过将解离液中Ca2+ 浓度降低终止酶解, 可获得足够多的分散细胞. 对于如何在不破坏细胞完整性的基础上剔除肝细胞, 我们运用差速离心法. 根据肝细胞的漂浮密度(>1096 g/L)明显大于Kupffer细胞漂浮密度(1040-1060 g/L)的特点, 首先用50 r/min的离心力去除肝细胞团块, 继之以500 r/min的离心力即可得到非实质肝细胞, 而Kupffer即存在于这一层次当中. Percoll是一种优良的梯度材料, 能够耐受高压和高温, 广泛用于各种肝组织细胞的分离, 不表现任何细胞毒性[9]. 我们经反复实验, 在Percoll为1044.8 g/L和1096.8 g/L界面之间可获得纯度和数量较满意的Kupffer细胞[4]. 每克鼠肝可提取的Kupffer细胞的数量在2×106以上. 经Percoll不连续密度梯度离心后获得Kupffer细胞纯度约为70%, 将细胞接种于玻璃培养皿中, 发现Kupffer细胞15 min后即开始贴壁, 1 h胞膜开始伸展, 牢固贴附于培养皿底部. 在细胞接种30-60 min后, 弃去上清液后可以去除绝大多数非贴壁的内皮细胞和小淋巴细胞, 获得高纯度的Kupffer细胞, 经鉴定纯度大于90%[10]. 在细胞分离过程中, 温度也是影响细胞产量和活性的重要因素: (1)灌注液体要预热37 ℃, 因为0-4 ℃灌注液所造成的冷缺血虽然有益于保护肝组织细胞, 但低温的灌注液也是低氧的, 而且降低了酶的活性; (2)孵育液预热至37 ℃, 是酶活性的最佳作用温度, 也有益于保持细胞生理活性; (3)离心过程保持4 ℃的条件能快速去除细胞间的钾, 增加细胞间的钠, 并且减少膜蛋白的损伤[11].
酶能够不可逆地破坏生物膜上的蛋白质, 而各种离子通道本身就是蛋白质. 选用酶消化加梯度离心分离法分离大鼠肝Kupffer细胞同样存在上述问题, 容易造成细胞结构的破坏和生物活性的丧失. 因此, 急性分离的肝Kupffer细胞, 既要保存其形态学特征, 又要保存其生理学特征, 才能供电生理学研究使用. 我们分离的大鼠肝Kupffer细胞具有较大的细胞核, 且细胞质较少, 鉴定具有明显的吞噬颗粒, 用全细胞膜片钳技术记录到一种被细胞内钙池耗竭激活的、具有明显内向整流特性的阳离子电流, 对Ca2+具有高度的选择性, 能被2-APB或SKF96365特异性阻滞, 考虑为钙池操纵的Ca2+ 通道电流(Isoc). 因为SOC通道是非兴奋细胞Ca2+ 内流的主要通道[12-13], 表明该分离方法能较好地保存大鼠肝Kupffer细胞主要离子通道的功能.
编辑: 潘伯荣 审读: 张海宁
| 1. | Knook DL, Blansjaar N, Sleyster EC. Isolation and characterization of Kupffer and endothelial cells from the rat liver. Exp Cell Res. 1977;109:317-329. [PubMed] |
| 2. | Goto M, Lemasters JJ, Thurman RG. Activation of voltage-dependent calcium channels in Kupffer cells by chronic treatment with alcohol in the rat. J Pharmacol Exp Ther. 1993;267:1264-1268. [PubMed] |
| 3. | Nnalue NA, Shnyra A, Hultenby K, Lindberg AA. Salmonella choleraesuis and Salmonella typhimurium associated with liver cells after intravenous inoculation of rats are localized mainly in Kupffer cells and multiply intracellularly. Infect Immun. 1992;60:2758-2768. [PubMed] |
| 5. | Ramadori G, Neubauer K, Odenthal M, Nakamura T, Knittel T, Schwögler S, Meyer zum Büschenfelde KH. The gene of hepatocyte growth factor is expressed in fat-storing cells of rat liver and is downregulated during cell growth and by transforming growth factor-beta. Biochem Biophys Res Commun. 1992;183:739-742. [PubMed] |
| 6. | Hendriks HF, Brouwer A, Knook DL. Isolation, purification, and characterization of liver cell types. Methods Enzymol. 1990;190:49-58. [PubMed] |
| 7. | Valatas V, Xidakis C, Roumpaki H, Kolios G, Kouroumalis EA. Isolation of rat Kupffer cells: a combined methodology for highly purified primary cultures. Cell Biol Int. 2003;27:67-73. [PubMed] |
| 8. | Ikejima K, Enomoto N, Seabra V, Ikejima A, Brenner DA, Thurman RG. Pronase destroys the lipopolysaccharide receptor CD14 on Kupffer cells. Am J Physiol. 1999;276:G591-G598. [PubMed] |
| 9. | Smedsrød B, Pertoft H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. J Leukoc Biol. 1985;38:213-230. [PubMed] |
| 11. | Kolb HA, Adam G. Regulation of ion permeabilities of isolated rat liver cells by external calcium concentration and temperature. J Membr Biol. 1976;26:121-151. [PubMed] |