修回日期: 2004-11-07
接受日期: 2004-11-25
在线出版日期: 2005-01-15
目的: 探讨凝血栓蛋白1(THBS1)基因启动子CpG岛异常甲基化, 蛋白表达与大肠腺癌及其临床病理特征的关联, 并分析THBS1基因蛋白表达与其甲基化的相关性.
方法: 应用免疫组化和甲基化特异性PCR技术分别检测大肠腺癌94例及其残端正常黏膜组织中, THBS1基因启动子CpG岛甲基化和蛋白表达情况.
结果: 大肠腺癌和癌旁组织中, THBS1蛋白表达率(61.7% vs 77.7%), CpG岛甲基化率(25.5% vs 11.7%)的差异均有显著性(前者χ2 = 5.67, P = 0.017, 后者χ2 = 5.93, P = 0.015), 老年患者肿瘤组织中THBS1蛋白表达率明显低于非老年患者(48.8% vs 72.5%, χ2 = 5.55, P = 0.018), 甲基化率明显高于非老年患者(37.2% vs 15.7%, χ2 = 5.68, P = 0.017), 直径≥3 cm的肿瘤组织中THBS1蛋白表达率显著低于直径<3 cm的肿瘤(53.4% vs 75.0%, χ2 = 4.37, P = 0.037), 甲基化率显著高于直径<3 cm的肿瘤(32.6% vs 13.9%, χ2 = 4.16, P = 0.041), C期和D期肿瘤组织中THBS1蛋白表达率显著低于A期或B期肿瘤(44.4% vs 73.3%, 72.1%, χ2 = 7.36, v = 2, P = 0.025)、甲基化率显著高于A期或B期肿瘤(41.7% vs 13.3%, 16.3%, χ2 = 8.04, v = 2, P = 0.018), 大肠腺癌THBS1蛋白阴性与阳性表达的组织之间, 启动子CpG岛甲基化率的差异有显著性(0% vs 66.7%, P<0.0005).
结论: THBS1基因异常甲基化是其蛋白表达缺失的主要原因之一, 并在大肠癌的发生发展中起重要作用.
引文著录: 张友才, 陈永平, 李骥, 王晓东, 邓长生, 朱尤庆, 龚玲. 大肠腺癌THBS1 CpG岛甲基化及其蛋白表达的研究. 世界华人消化杂志 2005; 13(2): 189-193
Revised: November 7, 2004
Accepted: November 25, 2004
Published online: January 15, 2005
AIM: To investigate the relationship among the aberrant methylation of the promoter CpG islands of thrombospondin 1 (THBS1) gene, its protein expression, and the clinicopathological features of colorectal adenocarcinoma (CRAC).
METHODS: The methylation status of promoter CpG islands and the protein expression of THBS1 gene in the tumors and the adjacent normal mucosal tissues of 94 patients with colorectal adenocarcinoma were detected by methylation-specific polymerase chain reaction (MSP) and immunohistochemical technique, respectively.
RESULTS: The rate of THBS1 gene protein expression (61.7% vs 77.7%, P = 0.017) and CpG island methylation (25.5% vs 11.7%, P = 0.015) in tissues of CRAC were significantly different from those in cancer-adjacent tissues. The rate of THBS1 protein expression was markedly different between the elderly and non-elderly CRAC patients (48.8% vs 72.5%, P = 0.018), between the tumors with larger size (≥3 cm in diameter) and small size (53.4% vs 75.0%, P = 0.037), as well as between the tumors in Dukes C, D stages and Dukes A or B stages (44.4% vs 73.3% or 72.1%, P = 0.025). The rate of THBS1 CpG island methylation was higher the in elderly CRAC patients than that in the non-elderly CRAC ones (37.2% vs 15.7%, P = 0.017), in the large size tumor than that in small one (32.6% vs 13.9%, P = 0.041), and in Dukes C, D stages than that in Dukes A or B stages (41.7% vs 13.3%, 16.3%, P = 0.018). The rate of THBS1 CpG island methylation was significantly different between CRAC with positive and negative protein expression (0% vs 66.7%, P < 0.0005).
CONCLUSION: The aberrant methylation of THBS1 gene is the main cause for the loss of its protein expression, which plays an important role in the carcinogenesis of CRAC.
- Citation: Zhang YC, Chen YP, Li J, Wang XD, Deng CS, Zhu YQ, Gong L. CpG island methylation and expression of thrombospondin 1 gene in colorectal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 189-193
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/189.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.189
新生血管形成(angiogenesis)是恶性肿瘤发病机制中的关键因素. 凝血栓蛋白(thrombospondin, THBS)1为首次发现于血小板α颗粒的成分, 可由肿瘤细胞、巨噬细胞、单核细胞和内皮细胞等多种细胞合成, 是最强的血管生成负性调节物之一[1-3], 能调节细胞的黏附, 移行, 增生和分化, 诱导血小板聚集和抑制血管生成[4-7]. 最近的研究表明, THBS1参与恶性肿瘤的发生, 其表达水平与肿瘤的进展呈负相关[8-10]. 现探讨THBS1基因表达和启动子CpG岛甲基化与大肠腺癌及其临床病理特征的关联, 并分析THBS1基因甲基化与其蛋白表达的相关性.
武汉大学中南医院2001-06/2002-12手术切除大肠腺癌标本94例, 所有患者均为湖北地区汉族人, 其中石蜡标本63例, 新鲜组织31例(取1/2组织立即常规石蜡包埋), 以残端正常黏膜组织为对照组, 所有标本均常规连续切片(厚4-5 μm), 并做HE染色确定诊断. 男58例, 女36例, 平均年龄59.2±11.2岁, 其中老年患者(≥60岁)43例, 肿瘤位于近端(盲肠, 升结肠和横结肠)大肠者24例, 肿瘤直径<3 cm者36例, 高分化腺癌31例, 中度分化性腺癌45例, 低分化腺癌18例, Dukes分期A期15例, B期43例, C期和D期共36例.
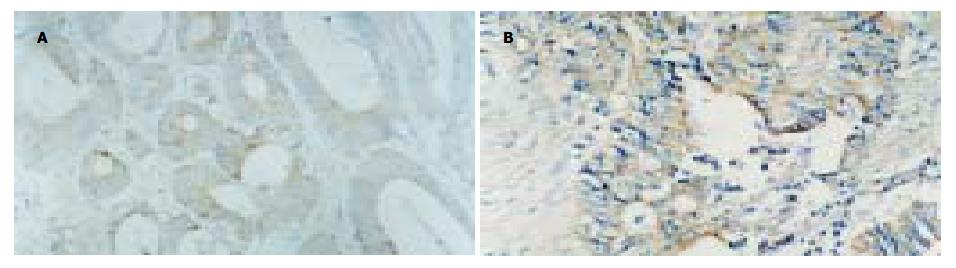
1.2.1 免疫组化检测THBS1蛋白表达: THBS1蛋白检测采用免疫组化SP法. THBS1单克隆抗体为美国Maxim公司产品, SP试剂盒为美国Zymed公司产品(均购于福州迈新生物技术公司). 实验步骤按试剂盒说明书进行, 特异性第一抗体原液1:50稀释. 阴性对照为PBS代替特异性第一抗体, 阳性对照为膀胱癌阳性切片. 对染色阳性的细胞, 高倍镜下选取5个有代表性的视野, 每个视野计100个肿瘤细胞, 以阳性染色细胞及间质占肿瘤细胞数及间质的5%以下, 5-50%, 50%以上分别判定为-, +, ++, 为便于统计, 将后二者统归于阳性[10].
1.2.2 THBS1基因5'CpG岛甲基化检测: 将冰冻新鲜组织和石蜡组织连续切片10-15张, 厚度5 μm, 装入1.5 mL Ep管. 二甲苯脱蜡后, 用乙醇去除残留二甲苯. 采用蛋白酶K消化, 酚-氯仿抽提法提取基因组DNA. 取1 μg DNA(DNA量少于1 μg时加入鲑鱼精DNA作载体)溶于双蒸水45 μL中, 加2.0 mol/L NaOH 5 μL, 37 ℃变性10 min. 再加入新鲜配制的10 mmol/L的氢醌30 μL及3 mol/L亚硫酸氢钠(pH 5.0)520 μL, 液体石蜡覆盖, 在50 ℃孵育16 h后冷冻去除液体石蜡, 用Wizard DNA Clean-up Systerm(美国Promega公司)纯化. 向已纯化的DNA(约50 μL)中加入0.6 mol/L NaOH 50 μL, 室温放置10 min. 加入1/10体积的乙酸钠和2倍体积无水乙醇, -20 ℃过夜, 12000 g速离心10 min沉淀DNA, 加700 mL/L冷乙醇1 mL, 12000 g速离心10 min, 弃上清, 自然风干, 用双蒸水50 μL溶解DNA, -20 ℃贮存备用. 甲基化(THBS1-M)和非甲基化(THBS1-U)引物分别用于扩增THBS1基因5'CpG岛甲基化和非甲基化的等位基因. THBS1-M引物序列为: 5'-CGGTCGTCGTTTATTGGTC-3'和5'-TAAACTCGCAAACCAACTCG-3'. THBS1 -U引物序列为: 5'-GTTTGGTTGTTGTTTATTGGTTG-3'和5'-CCTAAACTCACAAACCAACTCA-3'. 反应条件: 94 ℃预变性5 min后, 94 ℃变性45 s, 63 ℃退火30 s(用非甲基化引物扩增时, 退火温度为56 ℃), 72 ℃延伸45 s, 35个循环后, 72 ℃再延伸5 min, 取PCR反应产物5 μL, 用120 g/L聚丙烯酰胺凝胶电泳, 1.8 g/L硝酸银染色分析电泳结果. THBS1基因5'CpG岛甲基化和非甲基化扩增产物, 用20 g/L低溶点琼脂糖凝胶是电泳, 树脂纯化系统纯化后, 送上海博亚生物技术有限公司进行序列分析.
统计学处理 以χ2及Fisher精确检验分析不同研究对象间THBS1基因蛋白表达和甲基化率的差异. 采用SPSS11.5统计软件包分析.
THBS1蛋白阳性呈棕黄色, 颗粒状, 团块状或带状分布于细胞质和细胞外间质中, 无背景着色(图1A-B). 在大肠腺癌组织94例中, THBS1蛋白阳性表达率为61.7%(58), 以强阳性多见(强阳性率为40.4%), 癌旁组织中为77.7%(73), 强阳性染色较少(阳性率为19.1%), 其阳性表达率的差异有显著性(χ2 = 5.67, P = 0.017). 提示, 大肠腺癌组织中THBS1蛋白表达显著下降, THBS1蛋白表达缺失与大肠腺癌的发生有关. 老年患者肿瘤组织中THBS1蛋白阳性表达率明显低于非老年患者(72.5% vs 48.8%, χ2 = 5.55, P = 0.018), 直径≥3 cm的肿瘤组织中THBS1蛋白阳性表达率显著低于直径<3 cm的肿瘤(53.4% vs 75.0%, χ2 = 4.37, P = 0.037), C期和D期肿瘤组织中THBS1蛋白阳性率显著低于A期或B期肿瘤(44.4% vs 73.3%, 72.1%, χ2 = 7.36, v = 2, P = 0.025), 不同部位肿瘤组织之间, 不同分化程度肿瘤组织之间THBS1蛋白阳性表达率的差异均无显著性. 提示, THBS1蛋白阳性表达率下降以老年患者, 直径≥3 cm的肿瘤, C期和D期的肿瘤多见, 与肿瘤发生的部位和肿瘤的分化程度无关(表1).
| 研究对象 | n | 蛋白表达阳性 | 甲基化 | |
| 大肠腺癌 | 94 | 58(61.7) | 24(25.5) | |
| 发病年龄 | <60岁 | 51 | 37(72.5) | 8(15.7) |
| ≥60岁 | 43 | 21(48.8)a | 16(37.2)a | |
| 肿瘤部位 | 近端 | 24 | 13(54.2) | 9(37.5) |
| 远端 | 70 | 45(64.3) | 15(21.4) | |
| 肿瘤大小 | <3 cm | 36 | 27(75.0) | 5(13.9) |
| ≥3 cm | 58 | 31(53.4)a | 19(32.6)a | |
| 分化程度 | 高分化 | 31 | 21(67.7) | 6(19.4) |
| 中分化 | 45 | 28(62.2) | 11(24.4) | |
| 低分化 | 18 | 9(50.0) | 7(38.9) | |
| Dukes分期 | A期 | 15 | 11(73.3) | 2(13.3) |
| B期 | 43 | 31(72.1) | 7(16.3) | |
| C+D期 | 36 | 16(44.4)a | 15(41.7)a |
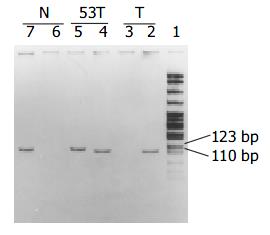
以研究对象基因组DNA为模板, 经MSP扩增后, 其甲基化和非甲基化扩增产物分别长111和115 bp. 其中第53号肿瘤标本, 甲基化和未甲基化产物均为阳性(图2). 大肠腺癌组织中, THBS1基因启动子CpG岛甲基化率为25.5%(24), 癌旁组织中为11.7%(11), 其甲基化率的差异也有显著性(χ2 = 5.93, P = 0.015), 提示大肠腺癌组织中THBS1基因甲基化率升高, THBS1基因甲基化可能参与大肠腺癌的发生. 老年患者肿瘤组织中THBS1基因甲基化率明显高于非老年患者(37.2% vs 15.7%, χ2 = 5.68, P = 0.017), 直径≥3 cm的肿瘤组织中THBS1基因甲基化率显著高于直径<3 cm的肿瘤(32.6% vs 13.9%, χ2 = 4.16, P = 0.041), C期和D期肿瘤组织中THBS1基因甲基化率显著高于A期或B期肿瘤(41.7% vs 13.3%, 16.3%, χ2 = 8.04, v = 2, P = 0.018), 而不同部位肿瘤组织之间, 不同分化程度肿瘤组织之间THBS1基因甲基化率的差异均无显著性. 提示, THBS1基因甲基化率升高以老年患者, 直径≥3 cm的肿瘤, C期和D期的肿瘤多见, 与肿瘤发生的部位和肿瘤的分化程度无关.
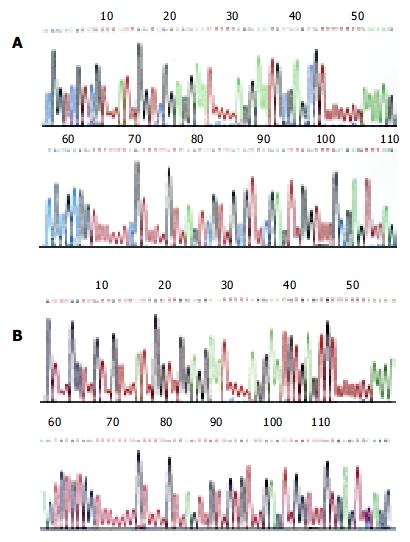
在THBS1蛋白阴性表达的大肠腺癌组织36例中, 其CpG岛甲基化率为66.7%(24), 58例THBS1蛋白阳性表达的大肠腺癌组织中, 则均呈未甲基化状态(甲基化率为0.0%), 其甲基化率的差异有显著性(P<0.0005). 提示, THBS1蛋白表达缺失与该基因启动子CpG岛甲基化显著相关, THBS1基因CpG岛甲基化是该基因蛋白表达缺失的主要原因. 随机选取甲基化和未甲基化扩增产物, 纯化后测序, 结果如图3所示, 与GenBank中THBS1野生型序列比较: 甲基化序列中, 除胞嘧啶-鸟嘌呤(C-G)二核苷酸以外, 其他处的C均变为胸腺嘧啶(T), 非甲基化序列中, 所有的C均变为T(112位碱基除外). 此结果与MSP原理完全一致, 证实用MSP法检测基因甲基化状况的可靠性.
THBS1在肿瘤发生发展中的作用与p53[11-12], 金属蛋白酶[13-15], 细胞因子等有关[16-18]. 野生型p53可以通过刺激THBS1表达, 后者作用于膜受体CD36, 并活化Fyn, Src酪氨酸激酶, 诱导内皮细胞凋亡, 抑制瘤体内血管新生而实现抑癌作用. 另外, TSP-1还可介导细胞与基质, 细胞与细胞的黏附, 从而抑制了肿瘤的浸润和转移[19-20]. THBS1表达与一些恶性肿瘤生物学行为, 转移发生及预后密切有关, 阳性表达者多分化好, 不易转移[8-10]且预后良好[21-24]. 本研究结果表明, THBS1蛋白表达缺失与大肠腺癌的发生有关, 老年患者肿瘤组织中THBS1蛋白表达率明显低于非老年患者, 直径<3 cm和Dukes A或B期的肿瘤组织中, THBS1蛋白表达率明显高于直径≥3 cm和Dukes C期和D期的肿瘤, 而不同部位, 不同分化程度的肿瘤组织中THBS1蛋白表达率相似. 此与上述观点不尽相同, 可能与不同类型的肿瘤, 不同种族的研究对象THBS1表达有差异有关.
THBS1基因启动子CpG岛甲基化与大肠癌及其临床病理特征关联的报道少见, 国内未见报道. 国外学者报道[25-28], 大肠癌组织中THBS1基因甲基化率为8.6-16.0%, 微卫星不稳定性阳性大肠癌中的比例显著升高(27-37.5%). 本研究结果, 湖北地区汉族大肠腺癌组织中甲基化率为25.5%. 分层研究: 分别与非老年患者(15.7%), 直径<3 cm(13.9%)和Dukes A(13.3%) 或B期(16.3%) 的肿瘤组织比较, 老年患者(37.2%), 直径 = 3 cm的肿瘤(32.6%)和Dukes C期和D期的肿瘤(41.7%)组织中THBS1基因甲基化率明显升高, THBS1基因甲基化与肿瘤发生部位和分化程度无明显关联.
DNA甲基化有两种类型: A型甲基化(Type A for aging), 又称衰老相关性甲基化, 在正常组织和肿瘤组织中均可见到; C型甲基化(Type C for cancer- specific), 又称肿瘤特异性甲基化, 仅见于肿瘤组织. 一般在研究基因表达与甲基化关联时, 常指C型甲基化, 以细胞株或肿瘤组织为研究对象. Yang et al[29]报道在所有TSP-1 mRNA表达缺失的成神经细胞瘤细胞株中, THBS1基因的启动子CpG岛均为甲基化, 应用5氮杂脱氧胞苷诱导THBS1基因去甲基化后, THBS1蛋白重新表达, 证明THBS1基因启动子CpG岛甲基化是该基因蛋白表达缺失的主要原因. 大肠癌组织中THBS1基因蛋白表达与其启动子CpG岛甲基化的相关性尚未见报道. 本研究结果提示, 58例THBS1阳性表达的标本中, 该基因无一例甲基化, 而36例THBS1表达缺失的组织中, 甲基化率为66.7%, 其甲基化率的差异有显著性(P<0.005), 也证实了THBS1蛋白表达缺失与该基因启动子CpG岛甲基化密切相关. 但是, 本组肿瘤标本中, 12例THBS1蛋白表达缺失, 而该基因启动子CpG岛呈未甲基化状态, 提示除启动子CpG岛甲基化以外, 一些其他的因素如基因变异, 转录后修饰等也可引起该基因表达缺失.
本实验中第53号标本甲基化和未甲基化均为阳性, 一般的解释为: 该基因可能存在不完全甲基化状况; 肿瘤组织中混杂的非肿瘤细胞, 经MSP(用未甲基化引物)扩增后, 也可有阳性产物. 该标本THBS1蛋白表达为阴性, 因此, 第53号标本应该定义为甲基化阳性. Herman et al[30]的研究中, HT29大肠癌细胞株, 肿瘤组织中, hMLH1基因也存在甲基化、未甲基化均为阳性的现象. 理论上, 经亚硫酸氢钠修饰后, 未甲基化序列中应该无C存在, 甲基化CpG岛以外的C均应变为T. 与GenBank公布的野生型序列比较(Accession J04835, GI:339671第2201-2315), 本测序结果与理论预测序列一致(未甲基化112位碱基除外), 从图3B可看到112位蓝色的波峰(C)后面存在一个红色的波峰(T), 甲基化测序结果为T(第109号碱基, 图3B), GenBank中为C, 因此应该解释为单碱基的错配, 而不是DNA序列中CpG岛以外的C呈甲基化的现象.
编辑: 潘伯荣 审读: 张海宁
| 1. | Naganuma H, Satoh E, Kawataki T, Amagasaki K, Satoh H, Nukui H. Cell density regulates thrombospondin-1 production in malignant glioma cells. J Neurooncol. 2003;63:147-153. [PubMed] |
| 2. | Rice AJ, Steward MA, Quinn CM. Thrombospondin 1 protein expression relates to good prognostic indices in ductal carcinoma in situ of the breast. J Clin Pathol. 2002;55:921-925. [PubMed] |
| 3. | Yee KO, Streit M, Hawighorst T, Detmar M, Lawler J. Expression of the type-1 repeats of thrombospondin-1 inhibits tumor growth through activation of transforming growth factor-beta. Am J Pathol. 2004;165:541-552. [PubMed] |
| 4. | Yoshida Y, Oshika Y, Fukushima Y, Tokunaga T, Hatanaka H, Kijima H, Yamazaki H, Ueyama Y, Tamaoki N, Miura S. Expression of angiostatic factors in colorectal cancer. Int J Oncol. 1999;15:1221-1225. [PubMed] |
| 5. | Lawler J. Thrombospondin-1 as an endogenous inhibitor of angiogenesis and tumor growth. J Cell Mol Med. 2002;6:1-12. [PubMed] |
| 6. | Filleur S, Volpert OV, Degeorges A, Voland C, Reiher F, Clézardin P, Bouck N, Cabon F. In vivo mechanisms by which tumors producing thrombospondin 1 bypass its inhibitory effects. Genes Dev. 2001;15:1373-1382. [PubMed] |
| 7. | Tsuchida T, Kijima H, Tokunaga T, Oshika Y, Hatanaka H, Fukushima Y, Abe Y, Kawai K, Yoshida Y, Miura S. Expression of the thrombospondin 1 receptor CD36 is correlated with decreased stromal vascularisation in colon cancer. Int J Oncol. 1999;14:47-51. [PubMed] |
| 8. | Hawighorst T, Oura H, Streit M, Janes L, Nguyen L, Brown LF, Oliver G, Jackson DG, Detmar M. Thrombospondin-1 selectively inhibits early-stage carcinogenesis and angiogenesis but not tumor lymphangiogenesis and lymphatic metastasis in transgenic mice. Oncogene. 2002;21:7945-7956. [PubMed] |
| 9. | Maeda K, Nishiguchi Y, Yashiro M, Yamada S, Onoda N, Sawada T, Kang SM, Hirakawa K. Expression of vascular endothelial growth factor and thrombospondin-1 in colorectal carcinoma. Int J Mol Med. 2000;5:373-378. [PubMed] |
| 10. | Maeda K, Nishiguchi Y, Kang SM, Yashiro M, Onoda N, Sawada T, Ishikawa T, Hirakawa K. Expression of thrombospondin-1 inversely correlated with tumor vascularity and hematogenous metastasis in colon cancer. Oncol Rep. 2001;8:763-766. [PubMed] |
| 11. | Tokunaga T, Nakamura M, Oshika Y, Tsuchida T, Kazuno M, Fukushima Y, Kawai K, Abe Y, Kijima H, Yamazaki H. Alterations in tumour suppressor gene p53 correlate with inhibition of thrombospondin-1 gene expression in colon cancer cells. Virchows Arch. 1998;433:415-418. [PubMed] |
| 12. | Fontanini G, Boldrini L, Calcinai A, Chinè S, Lucchi M, Mussi A, Angeletti CA, Basolo F, Bevilacqua G. Thrombospondins I and II messenger RNA expression in lung carcinoma: relationship with p53 alterations, angiogenic growth factors, and vascular density. Clin Cancer Res. 1999;5:155-161. [PubMed] |
| 13. | Cinatl J, Kotchetkov R, Scholz M, Cinatl J, Vogel JU, Driever PH, Doerr HW. Human cytomegalovirus infection decreases expression of thrombospondin-1 independent of the tumor suppressor protein p53. Am J Pathol. 1999;155:285-292. [PubMed] |
| 14. | Kaio E, Tanaka S, Oka S, Hiyama T, Kitadai Y, Haruma K, Chayama K. Clinical significance of thrombospondin-1 expression in relation to vascular endothelial growth factor and interleukin-10 expression at the deepest invasive tumor site of advanced colorectal carcinoma. Int J Oncol. 2003;23:901-911. [PubMed] |
| 15. | Albo D, Shinohara T, Tuszynski GP. Up-regulation of matrix metalloproteinase 9 by thrombospondin 1 in gastric cancer. J Surg Res. 2002;108:51-60. [PubMed] |
| 16. | Friedl P, Vischer P, Freyberg MA. The role of thrombospondin-1 in apoptosis. Cell Mol Life Sci. 2002;59:1347-1357. [PubMed] |
| 17. | Rodriguez-Manzaneque JC, Lane TF, Ortega MA, Hynes RO, Lawler J, Iruela-Arispe ML. Thrombospondin-1 suppresses spontaneous tumor growth and inhibits activation of matrix metalloproteinase-9 and mobilization of vascular endothelial growth factor. Proc Natl Acad Sci USA. 2001;98:12485-12490. [PubMed] |
| 18. | Qian X, Rothman VL, Nicosia RF, Tuszynski GP. Expression of thrombospondin-1 in human pancreatic adenocarcinomas: role in matrix metalloproteinase-9 production. Pathol Oncol Res. 2001;7:251-259. [PubMed] |
| 19. | Miyanaga K, Kato Y, Nakamura T, Matsumura M, Amaya H, Horiuchi T, Chiba Y, Tanaka K. Expression and role of thrombospondin-1 in colorectal cancer. Anticancer Res. 2002;22:3941-3948. [PubMed] |
| 20. | Graf R, Apenberg S, Freyberg M, Friedl P. A common mechanism for the mechanosensitive regulation of apoptosis in different cell types and for different mechanical stimuli. Apoptosis. 2003;8:531-538. [PubMed] |
| 21. | Sargiannidou I, Zhou J, Tuszynski GP. The role of thrombospondin-1 in tumor progression. Exp Biol Med (Maywood). 2001;226:726-733. [PubMed] |
| 22. | Park WS, Park JY, Oh RR, Yoo NJ, Lee SH, Shin MS, Lee HK, Han S, Yoon SK, Kim SY. A distinct tumor suppressor gene locus on chromosome 15q21.1 in sporadic form of colorectal cancer. Cancer Res. 2000;60:70-73. [PubMed] |
| 23. | Hamano Y, Sugimoto H, Soubasakos MA, Kieran M, Olsen BR, Lawler J, Sudhakar A, Kalluri R. Thrombospondin-1 associated with tumor microenvironment contributes to low-dose cyclophosphamide-mediated endothelial cell apoptosis and tumor growth suppression. Cancer Res. 2004;64:1570-1574. [PubMed] |
| 24. | Toyota M, Ohe-Toyota M, Ahuja N, Issa JP. Distinct genetic profiles in colorectal tumors with or without the CpG island methylator phenotype. Proc Natl Acad Sci USA. 2000;97:710-715. [PubMed] |
| 25. | Lee S, Hwang KS, Lee HJ, Kim JS, Kang GH. Aberrant CpG island hypermethylation of multiple genes in colorectal neoplasia. Lab Invest. 2004;84:884-893. [PubMed] |
| 26. | Yamamoto H, Min Y, Itoh F, Imsumran A, Horiuchi S, Yoshida M, Iku S, Fukushima H, Imai K. Differential involvement of the hypermethylator phenotype in hereditary and sporadic colorectal cancers with high-frequency microsatellite instability. Genes Chromosomes Cancer. 2002;33:322-325. [PubMed] |
| 27. | Toyota M, Ahuja N, Ohe-Toyota M, Herman JG, Baylin SB, Issa JP. CpG island methylator phenotype in colorectal cancer. Proc Natl Acad Sci USA. 1999;96:8681-8686. [PubMed] |
| 28. | Ahuja N, Mohan AL, Li Q, Stolker JM, Herman JG, Hamilton SR, Baylin SB, Issa JP. Association between CpG island methylation and microsatellite instability in colorectal cancer. Cancer Res. 1997;57:3370-3374. [PubMed] |
| 29. | Yang QW, Liu S, Tian Y, Salwen HR, Chlenski A, Weinstein J, Cohn SL. Methylation-associated silencing of the thrombospondin-1 gene in human neuroblastoma. Cancer Res. 2003;63:6299-6310. [PubMed] |
| 30. | Herman JG, Umar A, Polyak K, Graff JR, Ahuja N, Issa JP, Markowitz S, Willson JK, Hamilton SR, Kinzler KW. Incidence and functional consequences of hMLH1 promoter hypermethylation in colorectal carcinoma. Proc Natl Acad Sci USA. 1998;95:6870-6875. [PubMed] |