修回日期: 2005-09-25
接受日期: 2005-09-30
在线出版日期: 2005-10-15
目的: 检测腹泻型IBS(D-IBS)和便秘型IBS(C-IBS)动物模型肠肌间神敬缘囊种菩陨窬递质一氧化氮(NO)的差异, 来探讨肠肌间神敬陨窬递质的改变对IBS亚型的影响.
方法: 采用乙酸灌肠加束缚应激的方法造成D-IBS动物模型, 同时设立灌肠对照和空白对照. 采用冰水每日灌胃共14 d的方法造成C-IBS动物模型, 同时设立灌胃对照和空白对照. 检测各组大鼠粪便性状、内脏敏感性及肠肌间神敬砸种菩陨窬递质No的含量.
结果: 在高容量球囊扩张时, D-IBS组大鼠的腹肌收缩次数比C-IBS组及灌肠、空白对照组均明显增多(1.2 mL: 7.22±2.01 vs 2.77±0.78, 2.89±1.17, 3.59±1.08; 1.6 mL: 8.11±1.94 vs 2.89±1.67, 2.44±1.42, 2.89±1.22, P<0.05). 在低容量球囊扩张时, C-IBS组大鼠的腹肌收缩次数比对照组及D-IBS组明显减少(0.4 mL: 0.44±0.22 vs 2.44±0.67; 0.8 mL: 1.56±0.74 vs 6.31±1.74, P<0.05). C-IBS组和灌胃对照组的粪粒数、粪便湿重及粪便含水量均小于空白对照组(2.00±0.66, 2.33±0.50 vs3.67±1.00; 0.80±0.32, 1.69±0.49 vs 2.14±0.27; 39.24±3.11, 40.67±2.84 vs 48.38±2.79, P<0.05); D-IBS组粪便湿重和粪便含水量均高于灌肠和空白对照组(2.31±0.72 vs 1.52±0.58, 1.57±0.56, P<0.05; 65.31±3.31 vs 53.41±2.73, 55.78±3.99, P<0.05). C-IBS组首次排黑便时间比灌胃和空白对照组明显延长(277.89±25.08 vs 205.44±15.74, 189.22±18.45, P<0.05). 结肠组织学分析显示各组大鼠均无明显结肠炎性表现. C-IBS组NO阳性的神经元细胞数显著多于D-IBS组和对照组(303.50±14.43 vs 200.89±16.67, 185.78±16.66, P<0.01), 而D-IBS组和对照组NO阳性的神经元细胞数无显著差异(P>0.05).
结论: 抑制性神经递质NO的数量的增加与IBS不同亚型、内脏敏感性及动力异常相关, 提示NO的改变与IBS不同亚型发病机制有一定关系.
引文著录: 徐俊荣, 罗金燕, 尚磊, 孔武明. 从肠肌间神经丛抑制性神经递质的改变探讨IBS不同亚型的发病机制. 世界华人消化杂志 2005; 13(19): 2332-2338
Revised: September 25, 2005
Accepted: September 30, 2005
Published online: October 15, 2005
AIM: To investigate the role of inhibitory neurotransmitter of myoenteric plexus in the carcinogenesis of constipation and diarrhea-predominant irritable bowel syndrome (C-IBS and D-IBS) in rats.
METHODS: Rat model of D-IBS was established by intracolonic instillation of acetic acid and restraint stress, while the positive and blank control were designed; Rat model of C-IBS was established by stomach irrigation with 0-4°C cool water daily for 14 d, while the positive and blank control were also designed. The bowel movement, the properties of fecal pellets, visceral sensitivity, and the content of nitric oxide (NO) in the myoenteric plexus were detected in the rats of each group.
RESULTS: The contraction frequency of the abdominal muscle in D-IBS group was significantly enhanced as compared with that in C-IBS, positive and blank control group (1.2 mL volume: 7.22±2.01 vs 2.77±0.78, 2.89±1.17, 3.59±1.08; 1.6 mL volume: 8.11±1.94 vs 2.89±1.67, 2.44±1.42, 2.89±1.22, P < 0.05) at high intensities of colorectal distention (CRD); while at low intensities of CRD, the contraction frequency in C-IBS group was significantly reduced as compared with that in D-IBS group (0.4 mL volume: 0.44±0.22 vs 2.44±0.67; 0.8 mL volume: 1.56±0.74 vs 6.31±1.74, P < 0.05). The amount, wet weight, and water ratio of the feces expelled by the rats in C-IBS and positive control group were significantly lower than those in blank control group (2.00±0.66, 2.33±0.50 vs 3.67±1.00; 0.80±0.32, 1.69±0.49 vs 2.14±0.27; 39.24±3.11, 40.67±2.84 vs48.38±2.79, P < 0.05); while the weight and water ratio of the feces in D-IBS group were markedly higher than those in positive and blank control group (2.31±0.72 vs 1.52±0.58, 1.57±0.56, P < 0.05; 65.31±3.31 vs 53.41±2.73, 55.78±3.99, P < 0.05). The time before the first melena defecation in C-IBS group was significantly longer than that in positive and blank controls (277.89±25.08 vs 205.44±15.74, 189.22±18.45, P < 0.05). There were no signs of colonic inflammation in the rats of each group. The number of NO positive neurons in rats of the C-IBS group was notably larger than that in D-IBS and blank control group (303.50±14.43 vs 200.89±16.67, 185.78±16.66, P < 0.01), but no obvious difference existed between D-IBS and blank control group (P >0.05).
CONCLUSION: The enhanced inhibitory neurotransmitter NO in the myoenteric plexus of colon is related to the IBS subgroups, visceral sensitivity, and motility dysfunction. The result reveals that the change of NO is related to the occurrence of different IBS subgroups.
- Citation: Xu JR, Luo JY, Shang L, Kong WM. Role of inhibitory neurotransmitter of myoenteric plexus in carcinogenesis of irritable bowel syndrome with different subtypes. Shijie Huaren Xiaohua Zazhi 2005; 13(19): 2332-2338
- URL: https://www.wjgnet.com/1009-3079/full/v13/i19/2332.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i19.2332
肠易激综合征(IBS)是一种常见的肠功能紊乱性疾病. 根据患者的症状, 可将IBS分为两型, 腹泻型(D-IBS)和便秘型(C-IBS). 目前大多数IBS的动物模型都是针对腹泻型的, 对于便秘型IBS动物模型的建立鲜有报道. 受IBS动物模型的影响, 对这两种亚型发病机制的差异的研究主要集中在感觉过敏和动力异常这两大主要方面, 而对于两型肠肌间神经丛之间的差异了解甚少, IBS的确切发病机制尚不明确. 我们通过建立D-IBS和C-IBS动物模型, 并检测IBS两型肠肌间神经丛的抑制性神经递质一氧化氮(NO)的差异, 来探讨肠肌间神经丛神经递质的改变对IBS分型的影响.
成年♂SD大鼠45只, 由第四军医大学实验动物中心提供, 体重220-250?g, 置于安静、温暖(18-20 ℃)、避强光的环境中喂养, 自由饮水、摄食, 随机分为腹泻型IBS组(D-IBS组)、灌肠对照组、便秘型IBS组(C-IBS组)、灌胃对照组和空白对照组, 共5组, 每组各9只.
1.2.1 造模方法和分型标准
1.2.1.1 D-IBS组: 实验前的12 h禁食. 实验第1 d给大鼠称重, 乙醚吸入麻醉后经肛门插入连接注射器的硅胶管(距肛门8 cm), 结肠内灌入4%的乙酸1 mL. 缓慢拔出硅胶管, 用手压迫肛门并将大鼠尾巴抬高30 s, 然后用0.01 mol/L PBS 1 mL冲洗结肠. 实验第3 d, 每只大鼠进行银制双极电极包埋, 术后5 d记录腹壁肌电活动. 实验第7 d行束缚应激, 将大鼠置于一限制其肢体运动但不影响其呼吸的特制透明圆柱形筒内, 3 h后解除束缚将大鼠放入饲养笼中. 收集大鼠在应激期的粪便, 观察大便性状改变. 实验第8 d处死大鼠, 行结肠组织学分析和肠壁NADPH染色.
1.2.1.2 灌肠对照组: 实验前的12 h禁食. 实验第1 d给大鼠称重, 乙醚吸入麻醉后经肛门插入连接注射器的硅胶管(距肛门8 cm), 结肠内灌入生理盐水1 mL. 缓慢拔出硅胶管. 实验第3 d, 每只大鼠进行银制双极电极包埋, 术后5 d记录腹壁肌电活动. 实验第7 d行束缚应激, 观察大便性状改变. 实验第8 d处死大鼠, 行结肠组织学分析和肠壁NADPH染色.
1.2.1.3 C-IBS组: 每只给冰水(0-4 ℃生理盐水)2 mL, 1次/d灌胃, 共14 d. 为消除生物节律的影响, 均于上午08:00开始灌胃. 第14 d行墨汁排便试验, 实验前12 h禁食禁水. 第15 d每只大鼠进行银制双极电极包埋, 术后5 d开始记录腹壁肌电活动.
1.2.1.4 灌胃对照组: 每只给生理盐水2 mL, 1次/d灌胃, 共14 d. 为消除生物节律的影响, 均于上午08:00开始灌胃. 第14 d行墨汁排便试验, 实验前12 h禁食禁水. 第15 d每只大鼠进行银制双极电极包埋, 术后5 d开始记录腹壁肌电活动.
1.2.1.5 空白对照组: 置于安静、温暖(18-20 ℃)、避强光的环境中喂养, 自由饮水、摄食, 行各项指标的检测.
1.2.1.6 IBS分型的判定标准: 观察模型组大鼠粪便性状, 若粪粒数、粪便湿重和粪便含水量均增多, 与对照组相比有统计学差异, 即可认定D-IBS造模成功; 粪粒数、粪便湿重和粪便含水量均减少, 与对照组相比有统计学差异, 即可认定C-IBS造模成功.
1.2.2 检测指标
1.2.2.1 各组大鼠内脏敏感性的检测(腹壁肌电活动的检测): 10 g/L戊巴比妥钠按照40 mg/kg腹腔注射麻醉大鼠, 将一特制银制双极电极(上海诺城电气有限公司)缝合在腹股沟韧带上方距中线1.5 cm的一侧腹外斜肌上. 电极游离端经皮下隧道埋于颈后皮下. 术后5 d开始记录腹壁肌电活动. 在乙醚麻醉下取出埋于大鼠颈后皮下的电极, 并将电极两端连接RM6280型多通道电生理记录仪. 随后将石蜡油润滑的动脉栓子清除术导管(Fogarty 6F; 球囊长2 cm, 直径2 mm, Edwards, 西安欧莱科贸有限公司)经肛门插入, 球囊末端距肛门7 cm, 用胶带将导管缠在大鼠尾巴根部, 固定球囊. 将大鼠放在特制透明塑料筒中, 大鼠在此筒中可前后移动但不能转身. 待大鼠适应环境并完全清醒后, 分别在0.0、0.4、0.8、1.2、1.6 mL容量下注水进行结肠扩张. 每次扩张持续5 min, 记录5 min内腹肌收缩次数. 球囊容量和直径的对应关系是: 0.0 mL容量对应2 mm直径; 0.4 mL容量对应7.9 mm直径; 0.8 mL容量对应10.9 mm直径; 1.2 mL容量对应12.2 mm直径; 1.6 mL容量对应13.5 mm直径. 每次扩张结束后, 将水回抽, 检查球囊有无漏水, 以不少于注入量0.2 mL为准. 用RM6280生物信号采集处理系统2.0软件记录和分析腹壁肌电活动. 高频滤过设置在10 KHz, 低频滤过设置在1 KHz, 电压为1 mV, 肌电活动增高超过基线水平1 mV以上认为是一次有意义的腹壁肌电活动.
1.2.2.2 肠道运动和粪便性状的检测(墨汁灌胃试验): C-IBS组、灌胃对照组和空白对照组大鼠禁食禁水12 h后, 用含有2%墨汁水2 mL灌胃, 然后将大鼠置于铺有滤纸的钟罩内连续观察6 h, 记录大鼠第1次排黑便时间、粪便粒数、称量粪便湿重、干重, 比较各组动物上述指标的差异.
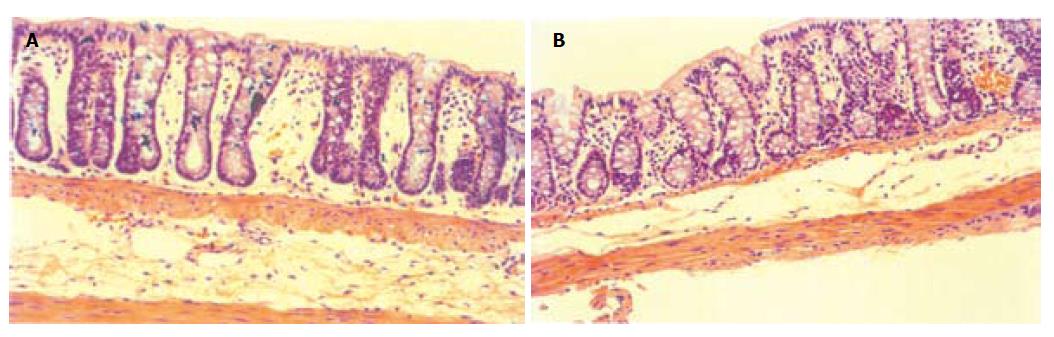
1.2.2.3 结肠组织学分析: 10 g/L戊巴比妥钠按80 mg/kg腹腔注射麻醉大鼠, 沿腹正中线剪开腹壁暴露肠道, 然后剪开腹主动脉和静脉放血. 将大鼠垂直竖起, 放完血后剪开耻骨联合, 沿直肠向上分离, 取距肛门7 cm的结肠片段1 cm, 在生理盐水中漂洗干净后, 立即固定在10 g/L甲醛中, 4 ℃保存. 结肠标本经常规脱水、透明, 石蜡包埋, Leitz 1512型超薄切片机上连续切片, 片厚3-5 mm, HE染色后, 封片. 显微镜下观察结肠组织学变化.
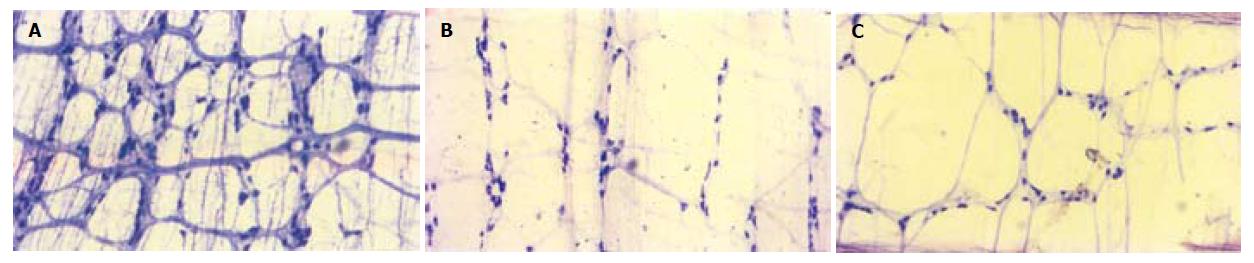
1.2.2.4 肌间神经丛抑制性神经递质NO的检测(肠壁NADPH染色法): 处死大鼠后, 取新鲜远端结肠肠管3-4 cm, 用0.01 M PBS冲洗后用40 g/L多聚甲醛液充盈, 将肠管两端结扎紧, 立即用40 g/L多聚甲醛液固定3 h, 再移至250 g/L蔗糖4 ℃过夜, 次日如下述行全层铺片. 沿肠系膜处剪开肠管, 再将组织剪成0.5 cm×0.5 cm的组织块, 在解剖显微镜下用钟表镊剥除粘膜层和粘膜下层, 再用镊尖轻轻挑去附于肌间神经丛的环行肌, 即得位于环行肌和纵行肌之间的肌间神经丛. 将制备好的肌间神经丛和纵行肌层标本用0.01 mol/L PBS冲洗3次, 移入由0.1 mol/L PB(pH8.0)配置的新鲜的孵育液中(0.5 g/L b-NADPH, 0.2 g/L 硝基四唑氮蓝NBT, 2.0 g/L L-苹果酸, 0.3%Triton X-100)37 ℃孵育45-60 min. PBS冲洗、贴片、晾干、逐级酒精脱水, 二甲苯透明, 中性树胶封片, 光镜观察、照相. 随机挑选5个低倍视野, 计数NADPH染色阳性的神经元细胞数目.
统计学处理 采用SPSS11.0软件进行统计分析, 所用统计方法为方差分析.
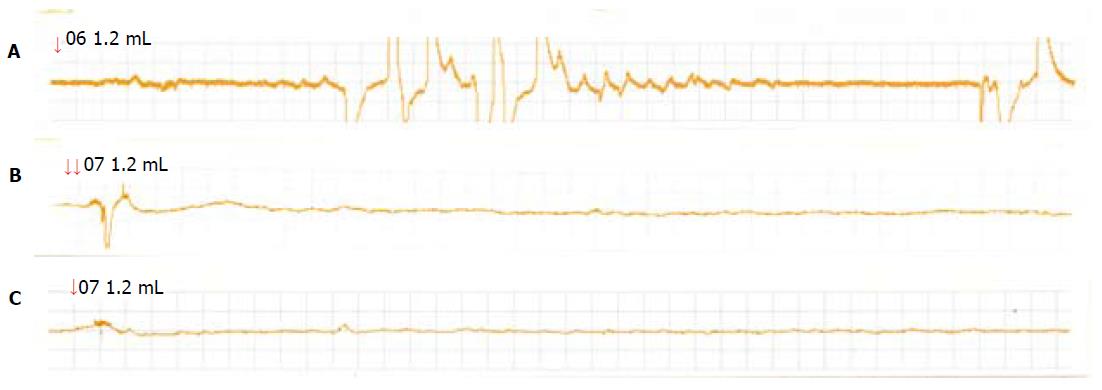
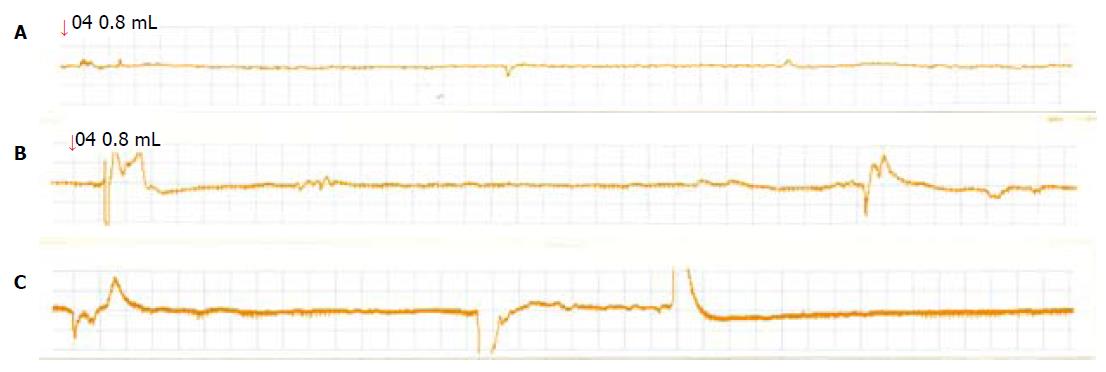
在球囊无扩张时, 可以记录到很少量的腹外斜肌肌电活动, 这与大鼠在记录时间内偶然的身体移动有关, 各实验组和对照组大鼠腹肌收缩次数均无显著性差异(P>0.05). 在高容量(球囊容量≥1.2 mL)球囊扩张时, D-IBS组大鼠的腹肌收缩次数均明显增多, 与对照组及C-IBS组有统计学差异(P<0.05)(图1, 表1). 在低容量(球囊容量为0.4 mL及0.8 mL)球囊扩张时, C-IBS组大鼠的腹肌收缩次数明显减少, 与对照组及D-IBS组有统计学差异(P<0.05)(图2, 表1).
| 分组 | 0.0 mL | 0.4 mL | 0.8 mL | 1.2 mL | 1.6 mL |
| D-IBS组 | 0.44±0.23 | 2.44±0.67g | 6.31±1.74gc | 7.22±2.01aegc | 8.11±1.94aegc |
| 灌肠对照组 | 0.44±0.13 | 2.09±0.95g | 4.43±1.32 | 2.89±1.17 | 2.44±1.42 |
| C-IBS组 | 0.29±0.14 | 0.44±0.22ace | 1.56±0.74ae | 2.77±0.78 | 2.89±1.67 |
| 灌胃对照组 | 0.56±0.24 | 2.56±0.88g | 3.02±1.79 | 3.66±1.83 | 3.44±1.41 |
| 空白对照组 | 0.44±0.17 | 2.89±1.17 | 4.80±1.39 | 3.59±1.08 | 2.89±1.22 |
D-IBS组束缚应激期大鼠粪便外观多呈稀糊状, 色较淡, 粪便湿重大于灌肠对照组和空白对照组(P<0.05), 粪便含水量明显增加, 与灌肠对照组和空白对照组有显著性差异(P<0.05)(表2).
C-IBS组和灌胃对照组的粪粒数、粪便湿重及粪便含水量均小于与空白对照组, 有统计学差异(P<0.05); C-IBS组首次排黑便时间明显延长, 与空白对照组和灌胃对照组有统计学差异(P<0.05)(表3).
IBS的发病机制目前尚未阐明, 研究结果显示IBS的发病可能与肠道动力、内脏感觉过敏、激素水平变化、肠道感染和心理等因素有关[1-9]. Wilder-Smith et al [10]用功能性磁共振(fMRI)研究了腹泻型和便秘型IBS患者与健康对照者结肠刺激后脑激活部位的差异, 发现三组患者的脑活化部位显著不同, 提示两种亚型的IBS患者的疼痛抑制机制不同. 由于腹泻型IBS临床上较为常见, 且大多数IBS的动物模型都是针对腹泻型的[11-16], 故而目前对于腹泻型IBS的发病机制研究较多, 对便秘型IBS的研究较少. 对两种亚型发病机制的差异的研究主要集中在感觉过敏和动力异常这两大主要方面[17-21],而对于两型肠肌间神经丛之间的差异了解甚少.
我们采用乙酸灌肠加束缚应激的方法造成D-IBS动物模型[22], 实验发现乙酸灌肠7 d后结肠组织学恢复正常, 但大鼠对结直肠扩张刺激的敏感性持续增高, 并且束缚应激可以引起大鼠排便的明显增多, 这些表现与D-IBS的特征吻合; 而灌肠对照组大鼠对结直肠扩张刺激的敏感性与空白对照组无差异, 故而排除了损伤因素所导致的内脏敏感性增高, 故而我们认为这种方法造成的D-IBS动物模型是可靠的. C-IBS动物模型我们采用的是彭丽华et al[23]报道的冰水灌胃的方法, 并对其可靠性进行了验证. 实验发现, 冰水灌胃14 d的C-IBS组大鼠无肠道结肠组织学改变, 与对照组相比, 粪粒数及粪便含水量减少, 首次排黑便时间延长, 符合便秘的特征. 进一步研究其对结直肠扩张刺激的腹壁肌电活动的反应发现, 在低容量(球囊容量为0.4 mL及0.8 mL)球囊扩张时C-IBS组大鼠的腹肌收缩次数明显减少, 与对照组和D-IBS组有显著性差异(P<0.05), 提示内脏敏感性降低. 尽管对于C-IBS患者的内脏敏感性报道不一, 有报告认为C-IBS患者的初始感觉阈值、疼痛阈值、排便阈值高于正常人, 即C-IBS患者内脏敏感性降低, 但也有学者认为C-IBS患者存在内脏高敏感[24-27]. 这些结论虽然不同, 但都提示C-IBS患者存在内脏敏感性的改变. 故而我们认为冰水灌胃法制成的C-IBS动物模型与C-IBS患者的临床特征有一定的相似之处, 可用于C-IBS的研究. NO是一种胃肠道抑制性神经递质, 是由一氧化氮合成酶(NOS)催化合成的. 由于NO半衰期短、性质不稳定, 目前多通过对NOS的研究来推测NO的生物效应. 现已证实NOS就是硫辛酸脱氢酶, 该酶的活性有赖于还原型尼克酰胺腺嘌呤二核苷酸脱氢酶(NADPH), 因而现在常用NADPH 组化方法显示的神经元来反应NOS阳性结构的存在[28,29]. 应用NADPH组化方法研究IBS两型肠肌间神经丛NO分布的研究显示, C-IBS组NO阳性的神经元细胞数显著多于D-IBS组和对照组(P<0.01), 而D-IBS组和对照组NO阳性的神经元细胞数无差异(P>0.05). 试验结果表明NO的增加可能导致肠道动力的异常减弱, 说明抑制性神经递质数量的增加可能与C-IBS的发病有关, 而与D-IBS的发病无显著关系.
消化道全层铺片技术是研究肠神经系统必需的一项技术, 经典的方法是将肠管在40 g/L多聚甲醛液固定3 h, 再移至250 g/L蔗糖4 ℃过夜, 次日用大小适宜的玻璃棒穿入肠管使其被动扩张, 用钟表镊剥离纵肌层, 再将剥离的纵肌层放在载玻片上于解剖显微镜下用镊尖轻轻挑去环行肌, 即可得到肠道肌间神经丛[30]. 由于大鼠的个体差异, 被动扩张肠管时需要选择合适的玻璃棒, 故而需要制备各种直径大小的玻璃棒, 并且在硬质玻璃棒上用镊尖剥离纵肌层容易失误. 在孙岚et al[31]对此技术进行改进的启发下, 我们在取材时, 也采用40 g/L多聚甲醛液充盈肠管, 肠管两段用丝线扎紧, 先置于40 g/L多聚甲醛液固定3 h, 再移至250 g/L蔗糖4 ℃过夜, 次日剪开肠管, 再将组织剪成0.5 cm×0.5 cm的组织块, 在解剖显微镜下剥除粘膜层和粘膜下层, 再用镊尖轻轻挑去附于肌间神神经丛的环行肌, 即得位于环行肌和纵行肌之间的肌间神经丛. 与孙岚et al的方法不同的是, 我们发现用40 g/L多聚甲醛液充盈肠管时不必将肠管充盈至最大程度, 也无需应用肌松剂, 即可获得满意的肌间神经丛. 若将肠管充盈至最大程度反而容易造成肠管破损和肠肌层的断裂, 不利于剥离出肌间神经丛. 另外我们发现, 在用镊尖挑去附于肌间神经丛所有的环行肌时, 容易造成肌间神经丛的破损, 若保留组织块上两端的环行肌, 仅仅剥离中间部分的环行肌即可避免这种失误, 且在后续的组化实验及脱水、透明的过程中不容易脱片. 总之, 我们验证了冰水灌胃法造成的C-IBS动物模型的可靠性及其在研究C-IBS中的可行性, 并且应用改良的消化道全层铺片技术研究了IBS两型肠肌间神经丛抑制性神经递质的差异, 发现抑制性神经递质NO数量的增加与IBS不同亚型、内脏敏感性及动力异常相关, 提示NO的改变与IBS不同亚型发病机制有一定关系.
编辑: 潘伯荣 审读:张海宁
| 1. | Mayer EA, Collins SM. Evolving pathophysiologic models of functional gastrointestinal disorders. Gastroenterology. 2002;122:2032-2048. [PubMed] [DOI] |
| 2. | Lieberman MD, Jarcho JM, Berman S, Naliboff BD, Suyenobu BY, Mandelkern M, Mayer EA. The neural correlates of placebo effects: a disruption account. Neuroimage. 2004;22:447-455. [PubMed] [DOI] |
| 3. | Drossman DA, Ringel Y, Vogt BA, Leserman J, Lin W, Smith JK, Whitehead W. Alterations of brain activity associated with resolution of emotional distress and pain in a case of severe irritable bowel syndrome. Gastroenterology. 2003;124:754-761. [PubMed] [DOI] |
| 4. | Nishiyama H, Mizuta Y, Isomoto H, Takeshima F, Omagari K, Miyahara Y, Murata I, Kohno S. Chronic visceral hypersensitivity renders defecation more susceptible to stress via a serotonergic pathway in rats. Dig Dis Sci. 2004;49:763-769. [PubMed] [DOI] |
| 5. | Barbara G, De Giorgio R, Stanghellini V, Cremon C, Salvioli B, Corinaldesi R. New pathophysiological mechanisms in irritable bowel syndrome. Aliment Pharmacol Ther. 2004;20 Suppl 2:1-9. [PubMed] [DOI] |
| 6. | Wang BM, Wang YM, Zhang WM, Zhang QY, Liu WT, Jiang K, Zhang J. [Serotonin transporter gene polymorphism in irritable bowel syndrome]. Zhonghua Nei Ke Za Zhi. 2004;43:439-441. [PubMed] |
| 7. | Sun YN, Luo JY. Effects of tegaserod on Fos, substance P and calcitonin gene-related peptide expression induced by colon inflammation in lumbarsacral spinal cord. World J Gastroenterol. 2004;10:1830-1833. [PubMed] [DOI] |
| 8. | Spiller RC. Postinfectious irritable bowel syndrome. Gastroenterology. 2003;124:1662-1671. [PubMed] [DOI] |
| 9. | Akiho H, Deng Y, Blennerhassett P, Kanbayashi H, Collins SM. Mechanisms underlying the maintenance of muscle hypercontractility in a model of postinfective gut dysfunction. Gastroenterology. 2005;129:131-141. [PubMed] [DOI] |
| 10. | Wilder-Smith CH, Schindler D, Lovblad K, Redmond SM, Nirkko A. Brain functional magnetic resonance imaging of rectal pain and activation of endogenous inhibitory mechanisms in irritable bowel syndrome patient subgroups and healthy controls. Gut. 2004;53:1595-1601. [PubMed] [DOI] |
| 11. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] [DOI] |
| 12. | Bourdu S, Dapoigny M, Chapuy E, Artigue F, Vasson MP, Dechelotte P, Bommelaer G, Eschalier A, Ardid D. Rectal instillation of butyrate provides a novel clinically relevant model of noninflammatory colonic hypersensitivity in rats. Gastroenterology. 2005;128:1996-2008. [PubMed] [DOI] |
| 13. | 刘 新光. 模拟肠易激综合征动物模型研究的评述. 胃肠病学和肝病学杂志. 2004;12:329-330. |
| 14. | Bercík P, Wang L, Verdú EF, Mao YK, Blennerhassett P, Khan WI, Kean I, Tougas G, Collins SM. Visceral hyperalgesia and intestinal dysmotility in a mouse model of postinfective gut dysfunction. Gastroenterology. 2004;127:179-187. [PubMed] [DOI] |
| 15. | Söderholm JD, Yates DA, Gareau MG, Yang PC, MacQueen G, Perdue MH. Neonatal maternal separation predisposes adult rats to colonic barrier dysfunction in response to mild stress. Am J Physiol Gastrointest Liver Physiol. 2002;283:G1257-G1263. [PubMed] [DOI] |
| 17. | Yuan YZ, Tao RJ, Xu B, Sun J, Chen KM, Miao F, Zhang ZW, Xu JY. Functional brain imaging in irritable bowel syndrome with rectal balloon-distention by using fMRI. World J Gastroenterol. 2003;9:1356-1360. [PubMed] [DOI] |
| 18. | Guilera M, Balboa A, Mearin F. Bowel habit subtypes and temporal patterns in irritable bowel syndrome: systematic review. Am J Gastroenterol. 2005;100:1174-1184. [PubMed] [DOI] |
| 19. | Dunlop SP, Coleman NS, Blackshaw E, Perkins AC, Singh G, Marsden CA, Spiller RC. Abnormalities of 5-hydroxytryptamine metabolism in irritable bowel syndrome. Clin Gastroenterol Hepatol. 2005;3:349-357. [PubMed] [DOI] |
| 20. | Mearin F, Baró E, Roset M, Badía X, Zárate N, Pérez I. Clinical patterns over time in irritable bowel syndrome: symptom instability and severity variability. Am J Gastroenterol. 2004;99:113-121. [PubMed] [DOI] |
| 21. | Mearin F, Balboa A, Badía X, Baró E, Caldwell E, Cucala M, Díaz-Rubio M, Fueyo A, Ponce J, Roset M. Irritable bowel syndrome subtypes according to bowel habit: revisiting the alternating subtype. Eur J Gastroenterol Hepatol. 2003;15:165-172. [PubMed] [DOI] |
| 22. | La JH, Kim TW, Sung TS, Kang JW, Kim HJ, Yang IS. Visceral hypersensitivity and altered colonic motility after subsidence of inflammation in a rat model of colitis. World J Gastroenterol. 2003;9:2791-2795. [PubMed] [DOI] |
| 24. | Bouin M, Plourde V, Boivin M, Riberdy M, Lupien F, Laganière M, Verrier P, Poitras P. Rectal distention testing in patients with irritable bowel syndrome: sensitivity, specificity, and predictive values of pain sensory thresholds. Gastroenterology. 2002;122:1771-1777. [PubMed] [DOI] |
| 25. | 李 延青, 王 梅艳, 吕 国苹, 顾 晓萌, 左 秀丽, 郭 玉婷, 张 海燕, 李 君曼, 赵 宪邨. 腹部冷刺激对肠易激 综合征患者内脏感觉阈值的影响. 胃肠病和肝病学杂志. 2002;11:339-341. |
| 27. | Dickhaus B, Mayer EA, Firooz N, Stains J, Conde F, Olivas TI, Fass R, Chang L, Mayer M, Naliboff BD. Irritable bowel syndrome patients show enhanced modulation of visceral perception by auditory stress. Am J Gastroenterol. 2003;98:135-143. [PubMed] [DOI] |
| 29. | Peng X, Feng JB, Yan H, Zhao Y, Wang SL. Distribution of nitric oxide synthase in stomach myenteric plexus of rats. World J Gastroenterol. 2001;7:852-854. [PubMed] [DOI] |